Лабораторная работа № 3
Тема: Термодинамические свойства воды и водяного пара.
Краткие теоретические сведения.
К реальным газам в технической термодинамике принято относить перегретые пары некоторых жидкостей. В отличие от воображаемого идеального газа реальный газ при соответствующих условиях может быть сжижен, т.е. сконденсирован, или же переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака, хлористого метила, сернистого ангидрида и др. Наибольшее применение имеет водяной пар, являющийся основным рабочим телом паровых двигателей, отопительных и других устройств.
Известно, что законы идеальных газов нельзя распространить на рабочие тела, состояние которых не очень удалено от жидкой фазы.
В связи с этим на водяной пар при давлениях и температурах, обычно применяемых в теплоэнергетике, не распространяется уравнение состояния Клапейрона. Из ряда предлагавшихся уравнений состояния, применимых для него с известной степенью приближенности, можно отметить уравнение Ван-дер-Ваальса, составленное для реальных газов:

где а и b — постоянные для данного газа.
Слагаемым a/v 2 в первом множителе учитывается влияние сил взаимодействия молекул, во втором — вычитаемым b учитывается влияние объема молекул (поскольку в идеальном газе, для которого и справедливо уравнение состояния Клапейрона, объем молекул полагается равным нулю).
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для нужд современной паротехники. Наиболее точным является в настоящее время уравнение состояния реальных газов, разработанное М.П. Вукаловичем и Н.И. Новиковым (МЭИ) применительно в основном к водяному пару. Вывод этого уравнения основан на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Для этого уравнения характерно близкое совпадение результатов расчетов с опытными данными. Однако для практических целей пользование этим, как и другими уравнениями состояния реального газа, неудобно вследствие сложности их и необходимости выполнения трудоемких вычислений. Обычно пользуются готовыми данными, которые берут из таблиц водяного пара или из i,s -диаграммы водяного пара.
Промежуточное состояние вещества между состоянием реального газа и жидкостью принято называть парообразным или просто паром. Превращение жидкости в пар представляет собой фазовый переход из одного агрегатного состояния в другое. При фазовом переходе наблюдается скачкообразное изменение физических свойств вещества.
Примерами таких фазовых переходов являются процесс кипения жидкости с появлением влажного насыщенного пара и последующим переходом его в лишенный влаги сухой насыщенный пар или обратный кипению процесс конденсации насыщенного пара. Во всех этих фазовых переходах существует однозначная связь между давлением и температурой (в данном примере — связь давления с температурой кипения или конденсации).
Одно из основных свойств сухого насыщенного пара заключается в том, что дальнейший подвод теплоты к нему приводит к возрастанию температуры пара, т.е. переходу его в состояние перегретого пара, а отвод теплоты — к переходу в состояние влажного насыщенного пара. В современной теплоэнергетике основным рабочим телом является водяной пар. Поэтому изучение термодинамических свойств паров рассмотрим на примере водяного пара.

Рис. 1. Фазовая T,s -диаграмма воды и водяного пара.
На рис. 1 приведены фазовые состояния воды. Здесь может быть выделено несколько областей:
I — газообразное состояние (перегретый пар, обладающий свойствами реального газа);
II — равновесное состояние воды и насыщенного водяного пара (двухфазное состояние); двухфазную область II называют также областью парообразования;
III, ограниченная изотермой ЕК, — жидкое состояние (вода);
IV — равновесное состояние твердой и жидкой фаз;
V — твердое состояние.
Области III, II и II, I отделены так называемыми пограничными линиями: левой АК и правой KD. Общая для левой и правой пограничных линий (и областей I, II и III) точка K обладает особыми свойствами и называется критической точкой. Она имеет определенные параметры р кр, v кр и Т кр, при которых кипящая вода переходит в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее, ее жидкая фаза) не может существовать при температурах выше Т кр. Будучи нагретой до этой температуры, весь объем воды практически мгновенно должен превратиться в пар. Вместе с тем пар при давлениях больших, чем р кр, и при охлаждении до температуры Т кр непосредственно превращается в жидкость, минуя область влажного пара. Критическая точка воды имеет следующие параметры:

Значения р, t, v и s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
На современных крупных тепловых электростанциях основным двигателем является паровая турбина, где в качестве рабочего тела используется водяной пар, который получают в паровых котлах. Процесс парообразования в котлах обычно происходит при постоянном давлении.
На рис. 2 изображены процессы нагрева воды до кипения, парообразования и перегрева водяного пара в p,v - и T,s -диаграммах.
Рассмотрим процесс получения водяного пара из воды. Начальное состояние жидкой воды, находящейся под давление р 0 и имеющей температуру 0°С, изображается на p,v - и Т,s -диаграммах точкой а. При подводе к воде теплоты при р = const температура ее увеличивается, а удельный объем растет. В некоторый момент времени температура воды достигает температуры кипения, и состояние ее при этом изображается точкой b. С дальнейшим подводом теплоты начинается процесс парообразования с сильным увеличением объема.

Рис. 2 p,v - и Т,s -диаграммы воды и водяного пара.
При этом образуется двухфазная среда — смесь воды и пара, называемая влажным насыщенным паром. Температура смеси остается постоянной, так как все тепло расходуется на испарение жидкой фазы. Процесс парообразования на этой стадии является изобарно-изотермическим и изображается участком bс. Наконец, в некоторый момент времени вся вода превращается в пар, называемый сухим, насыщенным. Его состояние изображается точкой с.
При дальнейшем подводе теплоты температура пара увеличивается и происходит процесс перегрева пара с — d. Точка d отражает состояние перегретого пара и в зависимости от его температуры может находиться на разных расстояниях от точки с.
Для обозначения величин, относящихся к различным состояниям воды и пара, устанавливается следующая индексация:
0 — начальное состояние воды;
' — вода, нагретая до температуры кипения;
" — сухой насыщенный пар;
х — влажный насыщенный пар;
без индекса — перегретый пар.
Рассматривая парообразование при более высоком давлении р 1 > р 0, можно отметить, что точка а, изображающая состояние жидкой воды при 0 °С и новом давлении, остается практически на той же вертикали, так как удельный объем воды почти не зависит от давления. Точка b ', изображающая состояние воды при температуре кипения, смещается вправо (на p,v -диаграмме) и поднимается вверх (на Т,s -диаграмме), так как с ростом давления увеличивается температура кипения и, следовательно, удельный объем воды. Точка с ', изображающая состояние сухого насыщенного пара, смещается влево, так как с увеличением давления удельный объем пара уменьшается, несмотря на рост температуры.
Соединение множества точек b и с при различных давлениях дает нижнюю и верхнюю пограничные кривые аК и Кс. Из p,v -диаграммы видно, что по мере увеличения давления разность удельных объемов v " и v ' уменьшается и при некотором давлении становится равной нулю. В этой точке, называемой критической, сходятся пограничные кривые аК и Кс. Состояние, соответствующее точке К, называется критическим. Оно характеризуется тем, что при нем пар и вода имеют одинаковые удельные объемы и не отличаются по свойствам друг от друга. Область, лежащая в криволинейном треугольнике bКс (на p,v -диаграмме), соответствует влажному насыщенному пару.
Состояние перегретого пара изображается точками, лежащими над верхней пограничной кривой Кс.
Следует отметить, что на Т,s -диаграмме площадь oabs ', изображает количество теплоты, потребное для нагрева жидкой воды до температуры кипения. Количество подведенной теплоты, равное теплоте парообразования r, выражается площадью s ' bcs ", и для него имеет место соотношение

Количество подведенной теплоты в процессе перегрева водяного пара изображается площадью s " cds.
На Т,s -диаграмме видно, что по мере увеличения давления теплота парообразования уменьшается и в критической точке становится равной нулю.
Обычно Т,s -диаграмма используется при теоретических исследованиях, так как практическое применение ее сильно затруднено тем, что количества теплоты выражаются в ней площадями криволинейных фигур.
Рассмотренная выше Т,s -диаграмма дает возможность наглядно представить себе характер превращения воды в пар различных состояний (влажный, сухой насыщенный и перегретый). Однако при пользовании этой диаграммой сложно устанавливать количество участвующей в процессе теплоты, так как это связано с необходимостью определения по диаграмме соответствующих площадей, частично ограниченных кривыми линиями. Поэтому для практических расчетов обычно пользуются i,s -диаграммой водяного пара, по которой это выполнить можно значительно проще, i,s -диаграмма (рис. 3) представляет собой график, построенный в системе координат i-s, на котором нанесены изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара.


Рис. 3. i,s -диаграмма воды и водяного пара (а) и ее практически используемая область для водяного пара (б).



Семейство изобар в области насыщения представляет собой пучок расходящихся прямых, начинающихся на нижней и оканчивающихся на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой.
В i,s -диаграмме водяного пара наносятся также линии постоянного паросодержания (x = const) и линии постоянного удельного объема (v = const). Изохоры идут несколько круче, чем изобары.
Состояние перегретого пара обычно определяется в технике давлением р и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы.
Состояние влажного насыщенного пара определяется в технике давлением р и паросодержанием х. Точка, изображающая это состояние, находится на пересечении изобары и линии х = const.
На рис. 4 представлены основные термодинамические процессы для водяного пара в i,s -диаграмме.
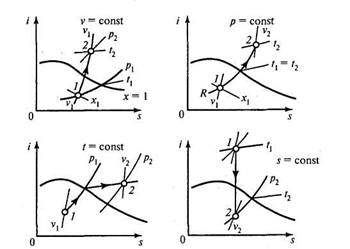
Рис.4 Основные термодинамические процессы для водяного пара в i,s -диаграмме.
i,s -диаграмма получила исключительно большое применение в технике благодаря тому, что техническая работа и количество теплоты изображаются на ней отрезками, а не площадями.
Практическое задание.
Используя программу Water Steam Pro 6.0, в рабочей области i,s -диаграммы построить изохоры, изобары и линии постоянного паросодержания для значений, указанных преподавателем. Результаты занести в таблицу 1. Для построения графика использовать миллиметровую бумагу.
Таблица 1
| № | р | v | t | x | i | s |
| МПа | м3/кг | ºС | % | кДж/кг | кДж/(кг∙К) | |
Контрольные вопросы:
1. Какие газы можно отнести к реальным, при каких условиях?
2. Чем отличается уравнение Ван-Дер-Ваальса от уравнения Клапейрона-Менделеева?
3. В чем разница между влажным насыщенным, сухим насыщенным и перегретым паром? Какими параметрами определяется состояние влажного насыщенного пара, перегретого пара?
4. Что показано на фазовой T,s -диаграмме водяного пара?
5. Какие параметры характеризуют критическую точку на T,s -диаграмме для воды и водяного пара?
6. К какому термодинамическому процессу относится процесс парообразования при степени сухости, отличной от нуля?
7. Покажите на T ,s -диаграмме области, характеризующие количество теплоты парообразования, нагрева воды до кипения, перегрева пара.
8. Для чего используется i,s -диаграмма водяного пара?
9. Какие линии и кривые нанесены на i,s -диаграмме водяного пара?
10. Определите на i,s -диаграмме значение удельной работы (количества теплоты) по участку 1-2 (состояния 1,2 задаются преподавателем).