Оксид и гидроксид мед
-Cu2O + 4HCl → 2H[CuCl2 ] + H2O CuOH + HCl → CuCl↓ + H2O
- Cu2O + H2 SO4 → CuSO4 + H2O + Cu↓ Cu2O + 2NaOH(конц.) → 2Na[Cu(OH)2 ]
- CuOH + NaOH(конц.) → Na[Cu(OH)2 ] Cu2O + 4NH3 + H2O → 2[Cu(NH3)2 ]OH
- CuOH + 2NH3 (водн.) → [Cu(NH3)2 ]OH 4CuOH + O2 + 2H2O → 4Cu(OH)2
Соли меди
- 4CuCl + O2 + 4HCl → 4CuCl2 + 2H2O 2CuCl (t°) → 2Cu + CuCl2
-CuSO4 (t°) → Cu + CuSO4 CuCl + Cl2 → CuCl2
- CuCl2 + 4NH3 → [Cu(NH3)4 ]Cl2 CuCl2 + 2NaCl(конц.) → Na2 [CuCl4 ]
- 2CuSO4 + 4KI → K2 SO4 + CuI + I2
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.

Электролиз раствора сульфата меди:



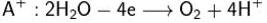
Чистое серебро — необычайно пластичный серебристо-белый металл (коэффициент отражения света близок к 100 %), лучше всех металлов проводит электрический ток. C течением времени металл тускнеет, реагируя с содержащимися в воздухе следами сероводорода и образуя налёт сульфида, чья тонкая пленка придает тогда металлу характерную черную окраску.
4Ag + 2H2 S + O2 → 2Ag2 S + 2H2O
Химические свойства серебра
2Ag + H2 S (t°) → Ag2 S + H2↑
2Ag + S (t°) → Ag2 S • 2Ag + 2HI(р-р) (t°) → 2AgI + H2↑
2Ag + 2HCl(г) (t°) → 2AgCl + H2↑
2Ag + 2H2 SO4 (конц.) → Ag2 SO4 + SO2↑ + 2H2O
Ag + 2HNO3 (конц.) → AgNO3 + NO2↑ + H2O
3Ag + 4HNO3 (разб.) → 3AgNO3 + NO↑ + 2H2O
Золото —мягкий пластичный металл жёлтого цвета. При нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, поэтому его относят к благородным металлам, в отличие от обычных металлов, разрушающихся под действием кислот и щелочей. Золото сравнительно легко реагирует с кислородом при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
4Au + 8KCN + 2H2O + O2 → 4K[Au(CN)2 ] + 4KOH 2K[Au(CN)2 ] + Zn → K2 [Zn(CN)4 ] + 2Au↓
Химические свойства золота
Золото растворяется в селеновой кислоте (но не в растворах других кислот) при 200 °C:
2Au + 6H2 SeO4 → Au2 (SeO4)3 + 3H2 SeO3 + 3H2O
2Au + 3Cl2 (200°C) → 2AuCl3
2Au + 3Br2 → 2AuBr3
2Au + I2 + 2KI → 2K[AuI2 ]
Au + Cs → CsAu
2Au + 2HCl + 3Cl2 → 2H[AuCl4 ]
К элементам группы II В относятся цинк (Zn), кадмий (Cd), ртуть (Hg). Все эти элементы – металлы и являются d-элементами, так как у них застраивается электронами d-подуровень предвнешнего уровня. Электронная конфигурация внешнего уровня и d-подуровня предвнешнего уровня:
Zn – 3d104S2 Cd – 4d105S2 Hg – 5d106S2
│↑↓│↑↓│↑↓│↑↓│↑↓│
│↑↓│ (n – 1)d
nS
Каждый из этих элементов в своем периоде является последним элементом d-семейства, поэтому d-подуровень предвнешнего уровня полностью заполнен и устойчив. Поэтому в образовании химических связей могут участвовать только два S-электрона внешнего уровня. В соединениях цинк и кадмий имеют степень окисления +2 (ZnO, CdS), а ртуть имеет степени окисления, равные +1 и +2 (Hg+2Cl2, Hg2+1Cl2).
Радиусы атомов (ra) и ионов (rЭ2+) в подгруппе цинка сверху вниз увеличиваются, но незначительно и у кадмия и ртути радиусы атомов почти одинаковые;
Так как от цинка к ртути размер атома почти не изменяется, а масса атома и число электронов существенно возрастают (у ртути атомная масса Ar в 3 раза больше, чем у цинка), поэтому происходит уплотнение электронной структуры атома и оторвать электрон от атома ртути труднее, чем от атома цинка, поэтому значение энергии ионизации (ЕЭо → Э+) сверху вниз в подгруппе увеличивается. Если значение энергии ионизации возрастает сверху вниз, то химическая активность металлов от цинка к ртути уменьшается. Стандартный электродный потенциал (Ео) возрастает от цинка к ртути, то есть цинк будет проявлять наиболее сильные восстановительные свойства, а ртуть будет самым слабым восстановителем. Кроме того, электродные потенциалы цинка и кадмия отрицательны, а у ртути электродный потенциал положительный (+0,85 в), поэтому цинк и кадмий способны вытеснять водород из растворов кислот, а ртуть водород из кислот не вытесняет.
Большинство простых растворимых соединений цинка и кадмия являются ионными соединениями. Однако некоторые соли кадмия и особенно ртути в водных растворах значительно менее диссоциированы, чем это обычно для солей типа ЭХ2.
Цинк Zn — тяжелый цветной металл, химически активен, обладает хорошо выраженными восстановительными свойствами. Подобно алюминию, он покрыт защитной пленкой окиси, однако реагирует с кислородом при нагревании и даже может гореть в кислороде с образованием окиси цинка ZnO:
2Zn + О2 = 2ZnO

Если смешать тонкий порошок металлического цинка с мелкорастертой серой и нагреть, топроисходит бурная реакция, сопровождающаяся яркой вспышкой, образуется сульфид цинка белого цвета:
Zn + S = ZnS
С галогенами цинк реагирует без нагревания:
Zn + Cl2 = ZnCl2
Взаимодействие с водой практически прекращается сразу после начала реакции, так как на поверхности металла образуется плотная пленка гидроокиси цинка, которая прекращает доступ воды к металлу. Однако если вода берется в виде перегретого пара, а цинк — сильно раскаленный, то идет реакция с образованием окиси цинка:
Zn + H2O = ZnO + H2↑
С кислотами цинк активно реагирует с вытеснением водорода. Реакция идет при обычных условиях и служит общеизвестным способом получения водорода в лаборатории:
Zn + 2НСl = ZnCl2 + H2↑
Zn + 2H+ = Zn2+ + H2↑
При взаимодействии с концентрированной серной кислотой цинк в зависимости от концентрации кислоты и других условий может восстанавливать серу до сероводорода, до свободной серы или до двуокисисеры:
4Zn+5H2SO4(k)→4ZnSO4+H2S↑+4H2O
3Zn+4H2SO4(k)→3ZnSO4+S+2H2O
Zn+2H2SO4(k)→ZnSO4+SO2↑+2H2O
Особенностью цинка является его амфотерность. Наряду с реакцией между цинком и кислотами легко происходит реакция между цинком и щелочами. При этом цинк вытесняет из щелочей водород и соли цинкаты:
Zn+2NaOH=Na2ZnO2+H2↑ цинкат натрия
Zn + 2Na+ + 2OH— = 2Na+ + ZnO22— + H2↑
Zn + 2OH— = ZnO22— + H2↑
Окись цинка ZnO с водой в реакцию не вступает, однако обладая амфотерным характером
В ряду ZnO → CdO → HgO усиливаются основные свойства оксидов. Если ZnO амфотерен, то HgO проявляет только основной характер.
Реакция с кислотами
ZnO+H2SO4=ZnSO4+Н2O
ZnO+2Н+ +SO24— =Zn2+ +SO24— +H2O
ZnO+2H+ =Zn2+ +H2O:
Щелочами
ZnO+2NaOH=Na2ZnO2+H2O
ZnO+2Na+ +2OH— =2Na+ +ZnO22— +H2O
ZnO + 2OH— = ZnO22— + H2O
Окись цинка широко используется для изготовления нетемнеющих цинковых белил.
При сильном нагревании с углем окись цинка может быть восстановлена до свободного цинка:
ZnO + С = Zn + СО
Ртуть — единственный металл, находящийся при обычной температуре в жидком состоянии (температуре плавления — 38,8°). Ртуть белого цвета. Она обладает меньшей восстановительной активностью, чем цинк. В ряду напряжений ртуть располагается правее водорода, т. е. не вытесняет его из воды и кислот. Радиус атома ртути почти равен радиусу атома кадмия, а заряд ядра атома значительно больше, поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее.
Ртуть легко образует с другими металлами сплавы, которые называются амальгамами.
Ртуть химически малоактивна и на воздухе без изменений может храниться довольно долго. Однако при длительном слабом нагревании может окисляться, образуя окись ртути:
2Hg + O2 = 2HgO
При растирании в ступке ртуть очень легко взаимодействует с серой, образуя сульфид ртути (II) черного цвета:
Hg + S = HgS
С водой ртуть в реакцию не вступает, но хорошо реагирует с азотной и концентрированной серной кислотами, обладающими сильным окисляющим действием. При этом в зависимости от того, при какой температуре ведется реакция, образуются соли как одновалентной, так и двухвалентной ртути. Ртуть в соединениях может быть одновалентной и двухвалентной. Соединения как одновалентной, так и двухвалентной ртути достаточно устойчивы, хотя и могут превращаться друг в друга
Hg + 4HNO3(конц) = Hg(NO3)2 + 2NO2 + 2H2O;
6Hg + 8HNO3(разб) = 3Hg2(NO3)2 + 2NO + 4H2O
Термическая стабильность оксидов от ZnO к HgO резко уменьшается. Если ZnO распадается на простые вещества при 1950оС, то HgO – при 400оС:
400о
2HgO → 2 Hg + O2.
Есть также оксид ртути (I) Hg2О – это черное твердое вещество, термически очень нестойкое и уже при обычной температуре диспропорционирует на металлическую ртуть и HgO:
Hg2+1О → Hgо + Hg+2О.
Соединения ртути (П) – сильные окислители, из их растворов легко восстанавливается металлическая ртуть: Hg(NO3)2 + Zn = Zn(NO3)2 + Hgo.
Соединения ртути (I) проявляют окислительно-восстановительную двойственность.
Hg+12Cl2 + Clo2 = 2Hg+2Cl-12; в этой реакции Hg2Cl2 – восстановитель.
Hg+12Cl2 + Sn+2Cl2 = 2Hgo + Sn+4Cl4; в этой реакции Hg2Cl2 – окислитель.
Кадмий ‑ серебристо-белый, отливающий синевой металл, тускнеющий на воздухе из-за образования защитной пленки оксида. Температура плавления – 321°C, температура кипения - 770 °С. Палочка чистого кадмия при сгибании хрустит подобно олову, но любые примеси в металле уничтожают этот эффект. Кадмий тверже олова, но мягче цинка – его можно резать ножом. При нагревании выше 80°C кадмий теряет упругость до такой степени, что его можно истолочь в порошок.
Кадмий образует сплавы и соединения со многими металлами, хорошо растворяется в ртути.
При нагревании кадмий энергично окисляются (сгорают), образуя соответствующие оксиды:
2Cd + O2 → 2CdO (при температуре)
Cd(OH)2 в воде практически не растворяется. Гидроксида легко реагирует с кислотами:
Cd(OH)2 + 2HCl = CdCl2 + 2H2O.
Cd(OH)2 кислотные свойства проявляет в жестких условиях – растворяется при длительном кипячении в концентрированных растворах щелочей с образованием гидроксокадматов:
Cd(OH)2 + 4КОН (конц.) = К4[Cd(OH)6].
Большинство солей Zn, Cd, Hg бесцветны. Растворимость хлоридов, бромидов и иодидов в ряду Zn – Cd – Hg уменьшается. Соли слабых кислот (карбонаты, сульфиды и др.), как правило, плохо растворимы в воде. Большинство солей ртути (I) малорастворимы в воде.
Содержание в живом организме и биологическое действие
Общее содержание меди в организме человека составляет 100-150 мг. В печени взрослых людей содержится в среднем 35 мг меди на 1 кг сухого веса. В хрусталике глаза медь составляет 0,4 мг на 100 г свежего вещества. В крови - примерно 1 мг/ 1 литр. В эритроцитах медь находится в соединении с белком стромы. Содержание меди в крови ритмически меняется в течение суток: максимум меди отмечается в полдень, минимум - в полночь. Увеличение содержания меди в сыворотке крови наблюдается при инфекционных болезнях, при некоторых формах цирроза печени. У некоторых моллюсков кровь не красная, а бледно-голубая, поскольку ее пигментом является гемоцианин (0,15-0,26% меди). Медь необходима для процессов гемоглобинообразвания и не может быть заменена никаким другим элементом. Медь способствует переносу железа в костный мозг и превращению его в органически связанную форму. Медь входит в состав окислительных ферментов, участвуя в тканевом дыхании. Медь также участвует в процессах роста и размножения, участвует в процессах пигментации, так как входит в состав меланина. Потребность в меди у взрослого человека составляет 2 мг в день (около 0,035 мг/ 1 кг веса). Всасывание меди происходит в верхних отделах кишечника, отсюда соединения меди поступаю в печень. Основным путем выведения меди является кишечник. С калом выводится в среднем 85% меди. С мочой здоровый человек за сутки выделяет 0,009-0,008мг меди. При недостатке меди в организме наблюдаются задержка роста, анемия, дерматозы, депигментация волос, частичное облысение, потеря аппетита, сильное исхудание, понижение уровня гемоглобина, атрофия сердечной мышцы.В организме человека содержится 1,8 г (2,4*10-3%) цинка, 7*10-5% кадмия, 2*10-5% ртути, 10-4% меди, 10-6% серебра, 10-5% золота. По своей роли уникальны цинк и медь: здоровье зависит от строгого соблюдения их баланса - опасны недостаток и избыток этих элементов. Цинк играет в организме человека не менее важную роль, чем железо. Карбоангидраза - фермент, являющийся цинкопротеидом. Цинк находится в нем в 0,33-0,34%. Карбоангидраза содержится в эритроцитах крови всех животных и человека. В 1л крови млекопитающих - примерно 1г карбоангидразы. Наличие этого фермента дает организму возможность освобождаться от избытка СО2. Цинк оказывает влияние на активность половых и гонадотропных гормонов гипофиза. Цинк усиливает и тиреотропное действие гипофизарных экстрактов. Цинк увеличивает активность ферментов: фосфатаз кишечной и костной, катализирующих гидролиз. Тесная связь цинка с гормонами и ферментами объясняет его влияние на углеводный, жировой и белковый обмен веществ, на окислительно-восстановительные процессы, на синтетическую способность печени. По новым исследованиям цинк обладает липотропным эффектом, т.е. способствует повышению интенсивности распада жиров, что проявляется уменьшением содержания жира в печени. Кроме того, отмечно, что ткань злокачественных новообразований захватывает больше цинка, чем нормальная ткань. Всасывание цинка происходит в верхнем отделе тонкого кишечника. Процессу мешают карбонаты, с которыми цинк образует труднорасторимые соли. Даже при питании продуктами, богатыми цинком, не удается повысить содержание цинка в крови. Поступающий в кровь цинк задерживается в основной массе печенью. Отложение цинка в печени доходит до 500-600мг/1 кг веса. Затем цинк отлагается преимущественно в мышцах и костной системе. Выделение из организма происходит в основном через кишечник. Суточная потребность человека в цинке составляет 12-16мг для взрослых и 4-6мг для детей. Наибольшая потребность в цинке имеет место в периоды бурного роста и полового созревания. Цинк находится во всех растениях. Наиболее богаты цинком дрожжи, пшеничные, рисовые и ржаные отруби, зерна злаков и бобовых, какао. Наибольшее количество цинка содержат грибы - в них содержится 130-202,3мг на 1 кг сухого вещества. В луке - 100,0 мг, в картофеле -11,3 мг. При дефиците цинка наблюдается задержка роста, перевозбуждение нервной системы и быстрое утомление. Поражение кожи напоминает пеллагрозный дерматит. Гистологическое исследование показывает гиперкератинизацию, утолщение эпидермиса, отек кожи, слизистых оболочек рта и пищевода. Недостаточность цинка приводит к бесплодию. В основе цинковой недостаточности лежат изменения углеводного и азотистого обмена, нарушение химизма тканей. Недостаток цинка отражается на продолжительности жизни. Экспериментально доказано, что крысы, получавшие достаточное количество витаминов, но находившиеся на безцинковой диете, погибали.