Модуль 2 Лекция 8
Методы расчёта энтропии в разных процессах. Примеры расчёта энтропии. Энтропия и ТД вероятность. Связь макроскопической ТД и статистической физики. Изменение энтропии при фазовых переходах. Виды энтропии для различных видов систем. Оценка величины энтропии на основе экспериментальных данных.
Энтропия в открытых системах
В силу второго начала термодинамики, энтропия Si замкнутой системы не может уменьшаться" (закон неубывания энтропии). Математически это можно записать так:  , индекс i обозначает так называемую внутреннюю энтропию, соответствующую замкнутой системе. В открытой системе возможны потоки тепла как из системы, так и внутрь неё. В случае наличия потока тепла в систему приходит количество тепла δ Q 1 при температуре T 1 и уходит количество тепла δ Q 2 при температуре T 2. Приращение энтропии, связанное с данными тепловыми потоками, равно:
, индекс i обозначает так называемую внутреннюю энтропию, соответствующую замкнутой системе. В открытой системе возможны потоки тепла как из системы, так и внутрь неё. В случае наличия потока тепла в систему приходит количество тепла δ Q 1 при температуре T 1 и уходит количество тепла δ Q 2 при температуре T 2. Приращение энтропии, связанное с данными тепловыми потоками, равно:

В стационарных системах обычно δ Q 1 = δ Q 2, T 1 > T 2, так что dSo < 0. Поскольку здесь изменение энтропии отрицательно, то часто употребляют выражение «приток негэнтропии», вместо оттока энтропии из системы. Негэнтропия определяется таким образом как обратная величина энтропии.
Суммарное изменение энтропии открытой системы будет равно:
dS = dSi + dSo.
Если всё время dS > 0, то рост внутренней энтропии не компенсируется притоком внешней негэнтропии, система движется к ближайшему состоянию равновесия. Если dS = 0, то мы имеем стационарный процесс с неизменной общей энтропией. В этом случае в системе осуществляется некоторая внутренняя работа с генерацией внутренней энтропии, которая преобразует, например, температуру T 1 внешнего потока тепла в температуру T 2 уходящего из системы потока тепла.
Измерение энтропии
В реальных экспериментах очень трудно измерить энтропию системы. Техники измерения базируются на термодинамическом определении энтропии и требуют экстремально аккуратной калориметрии.
Для упрощения мы будем исследовать механическую систему, термодинамические состояния которой будут определены через её объем V и давление P. Для измерения энтропии определенного состояния мы должны сперва измерить теплоёмкость при постоянных объёме и давлении (обозначенную CV и CP соответственно), для успешного набора состояний между первоначальным состоянием и требуемым. Тепловые ёмкости связаны с энтропией S и с температурой T согласно формуле:

где нижний индекс X относится к постоянным объёму и давлению. Мы можем проинтегрировать для получения изменения энтропии:

Таким образом, мы можем получить значение энтропии любого состояния (P, V) по отношению к первоначальному состоянию (P0, V0). Точная формула зависит от нашего выбора промежуточных состояний. Для примера, если первоначальное состояние имеет такое же давление, как и конечное состояние, то

В добавление, если путь между первым и последним состояниями лежит сквозь любой фазовый переход первого рода, скрытая теплота, ассоциированная с переходом, должна также учитываться.
Энтропия первоначального состояния должна быть определена независимо. В идеальном варианте выбирается первоначальное состояние как состояние при экстремально высокой температуре, при которой система существует в виде газа. Энтропия в этом состоянии подобна энтропии классического идеального газа плюс взнос от молекулярных вращений и колебаний, которые могут быть определены спектроскопически.
Построение графика изменения энтропии
Адиабатический процесс
Следующее уравнение может быть использовано для построения графика изменения энтропии на диаграмме P—V:
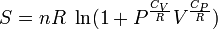
Здесь два замечания:
· это не определение энтропии (но выведено из него);
· предполагается, что CV и CP постоянные, что на самом деле не так.