Определения, которые нам дал преподаватель:
Биополимеры – высокомолекулярные природные соединения, являются структурной основой всех живых организмов, и играют определяющую роль в процессах жизнедеятельности.
Регулярные полимеры – группы атомов, размещенные в строго определенном порядке по отношению к углеродной цепи (некоторые полисахариды).
Нерегулярные полимеры – группы атомов, располагающиеся по отношению к цепи хаотично (белки, нуклеиновые кислоты, некоторые полисахариды).
Полисахариды – молекулы полимерных углеводов, соединенных длинной цепочкой, моносахаридных остатков.
Белки – высокомолекулярные соединения, полимеры, мономерами которых являются аминокислоты.
Биополимеры - являются структурной основой живых организмов и обеспечивают их жизнедеятельность, выполняя разнообразные биологические функции. К биополимерам относятся белки, нуклеиновые кислоты, полисахариды. Существуют также смешанные биополимеры, например, гликопротеины (соединения, в молекулах которых олиго- или полисахаридные цепи ковалентно связаны с пептидными цепями) и липопротеины (состоят из белков и липидов).
Исторически термин «липопротеины» применяется к любым структурам, в состав которых входят белки и липиды. Следует различать липопротеины-биополимеры, где белки связаны с липидами ковалентной связью (например, липопротеины, служащие якорем, с помощью которого белки прикрепляются к мембране) и липопротеины — агрегаты липидов с белками, не имеющие строго определенного состава (такие липопротеины, например, в плазме крови обеспечивают транспорт водонерастворимых липидов). Гликопротеины являются важным структурным компонентом клеточных мембран животных и растительных организмов. Гликопротеинами являются все антитела, интерфероны, белки плазмы крови, молока, рецепторные белки, большинство белковых гормонов и др. Гликопротеины мембран эритроцитов, специфически гликозилированные теми или иными углеводными остатками, но имеющие гомологичную белковую часть, предопределяют группу крови у человека.
|
|
Многие биополимеры находят применение в пищевой, перерабатывающей и фармацевтической промышленности.
Полисахари́ды – общее название класса сложных, высокомолекулярных углеводов, молекулы которых состоят из десятков, сотен или тысяч мономеров — моносахаридов.
Полисахариды необходимы для жизнедеятельности животных и растительных организмов. Они являются одним из основных источников энергии, образующейся в результате обмена веществ организма. Они принимают участие в иммунных процессах, обеспечивают сцепление клеток в тканях, являются основной массой органического вещества в биосфере.
К полисахаридам относятся вещества, построенные из большого числа остатков моносахаридов или ихпроизводных. Если полисахарид содержит остатки моносахарида одного вида, его называют гомополисахаридом. В том случае, когда полисахарид составлен из моносахаридов двух видов или более, регулярно или нерегулярно чередующихся в молекуле, его относят к гетерополисахаридам.
Структурные полисахариды придают клеточным стенкам прочность.
Водорастворимы е полисахариды не дают клеткам высохнуть.
Резервные полисахариды по мере необходимости расщепляются на моносахариды и используютсяорганизмом
|
|
Белки, или протеины, — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. На их долю приходится 50 — 80% сухой массы клетки.
Молекулы белков имеют большие размеры, поэтому их называют макромолекулами. Кроме углерода, кислорода, водорода и азота, в состав белков могут входить сера, фосфор и железо. Белки отличаются друг от друга числом (от ста до нескольких тысяч), составом и последовательностью мономеров. Мономерами белков являются аминокислоты (рис. 1)
Бесконечное разнообразие белков создается за счет различного сочетания всего 20 аминокислот. Каждая аминокислота имеет свое название, особое строение и свойства. Их общую формулу можно представить в следующем виде:
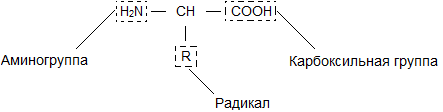
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (—NH2) с основными свойствами, другая — карбоксильной группой (—COOH) с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение. Наличие в одной молекуле аминокислоты основной и кислотной групп обусловливает их высокую реакционную способность.через эти группы происходит соединение аминокислот при образовании белка. При этом возникает молекула воды, а освободившиеся электроны образуют пептидную связь. Поэтому белки называют полипептидами.
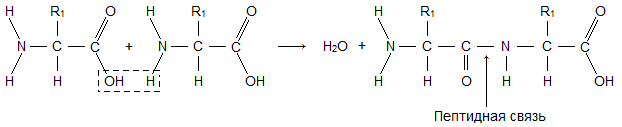
Молекулы белков могут иметь различные пространственные конфигурации, и в их строении различают четыре уровня структурной организации.
|
|
Последовательность аминокислот в составе полипептидной цепи представляет первичную структуру белка. Она уникальна для любого белка и определяет его форму, свойства и функции.
Большинство белков имеют вид спирали в результате образования водородных связей между —CO- и —NH- группами разных аминокислотных остатков полипептидной цепи. Водородные связи малопрочные, но в комплексе они обеспечивают довольно прочную структуру. Эта спираль — вторичная структура белка.
Третичная структура — трехмерная пространственная «упаковка» полипептидной цепи. В результате возникает причудливая, но для каждого белка специфическая конфигурация — глобула. Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот.
Четвертичная структура характерна не для всех белков. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Например, гемоглобин крови человека представляет комплекс из четырех макромолекул белка.
Такая сложность структуры белковых молекул связана с разнообразием функций, свойственных этим биополимерам.
Нарушение природной структуры белка называют денатурацией. Она может происходить под воздействием температуры, химических веществ, лучистой энергии и других факторов. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остается в виде полипептидной цепи.
Этот процесс частично обратим: если не нарушена первичная структура, то денатурированный белок способен восстанавливать свою структуру. Отсюда следует, что все особенность строение макромолекулы белка определяются его первичной структурой.
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками.
Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина.
У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в регуляции кислотно-щелочного состояния.