Белки. Свойства белков.
Белки являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Белки – это биополимеры, сложные высокомолекулярные природные соединения, построенные из α-аминокислот, соединённых между собой пептидными связями (-CO-NH-). В состав белков входит 20 различных аминокислот, отсюда следует огромное многообразие белков при различных комбинациях аминокислот. Как из 33 букв алфавита мы можем составить бесконечное число слов, так из 20 аминокислот – бесконечное множество белков. В организме человека насчитывается до 100 000 белков.
Белки подразделяют на протеины (простые белки) и протеиды (сложные белки).
Число аминокислотных остатков, входящих в молекулы, различно: инсулин – 51, миоглобин – 140. Отсюда Mr белка от 10 000 до нескольких миллионов.

Молекулы белка
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Многие белки состоят из нескольких полипептидных частиц, которые складываются в единый агрегат. Так, молекула гемоглобина (С738Н1166S2Fe4O208) состоит из четырех субъединиц. Отметим, что Mr белка яйца = 36 000, Mr белка мышц = 1 500 000.
2. Строение белков.
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Фишер предположил, что белки представляют собой полимеры из остатков аминокислот, соединенных пептидной связью NH–CO. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида). Согласно полипептидной теории белки имеют определенную структуру.
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.

Белок тирозин
В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков - инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована.
Структуры белка.
Первичная структура белка – последовательность чередования аминокислотных остатков в линейной полипептидной цепи за счёт пептидных связей (все связи ковалентные, прочные) (рис. 1).

|
| Рис. 1. Первичная структура белка |
Вторичная структура – это пространственная конфигурация полипептидной цепи белковой молекулы, напоминающая спираль, которая образуется в результате скручивания полипептидной цепи за счёт многочисленных водородных связей между группами: CO и NH. форма в пространстве.

|
| Рис. 2. Вторичная структура белка |
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль полипептидной цепи за счет дисульфидных мостиков (-S-S-), солевых мостиков (NH3+COO−), сложноэфирных мостиков (-O-CO-), водородных связей (рис. 3).
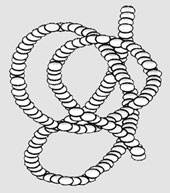
|
| Рис. 3. Третичная структура белка |
У большинства белков полипептидные цепи свёрнуты особым образом в «клубок» - компактную «глобулу». Эта структура поддерживается за счёт гидрофобных взаимодействий, а также и вышеперечисленных видов связей.
В количественном отношении наиболее важны гидрофобные (от греч. гидро – вода, фобос − страх) взаимодействия. Белок в водном растворе свёртывается таким образом, чтобы его гидрофобные (водоотталкивающие) боковые цепи были внутри молекулы, а гидрофильные (растворимые) – повёрнуты наружу.
По характеру «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.
Для глобулярных белков более характерна α-спиральная структура, спирали изогнуты, «свёрнуты». Макромолекулы имеют сферическую форму. Они растворяются в воде и солевых растворах с образованием коллоидных систем. Большинство белков животных, растений и микроорганизмов относится к глобулярным белкам.
Для фибриллярных белков более характерная нитевидная структура. Они, как правило, не растворяются в воде. Фибриллярные белки обычно выполняют структурообразующие функции. Их свойства зависят от способа упаковки полипептидных цепочек. Примером фибриллярных белкрв служат белки мускольной ткани (миозин), кератин (роговая ткань).
Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс - ассоциатами (рис. 4).

|
| Рис. 4. Четвертичная структура белка |
Свойства белков.