Квантовая биофизика изучает электронную структуру биологически важных молекул, электронные переходы в этих молекулах и пути превращения энергии возбужденного состояния молекул в энергию продуктов.
Каждый электрон в молекуле находится на определенной орбитали и обладает определенной энергией. Если молекуле сообщить энергию, например, в форме кванта света, может произойти переход с заполненного основного уровня (S0) на один из незаполненных (рис. 1). При этом молекула оказывается в синглетном (S1, S2, …, Sn) электронно-возбужденном состоянии.

|
| Рис. 1. Электронные переходы в молекулах. |
За счет внутренней конверсии (безизлучательная отдача энергии) электроны всегда оказываются на низшем колебательном подуровне синглетного возбужденного состояния (S1). Спины электронов не изменяются (антипараллельны), время жизни молекул в состоянии составляет 10–8–10–9 с. Далее, с определенной вероятностью, могут реализовываться следующие пути превращения энергии состояния S1:
1. В тепло: S1 → S0 (внутренняя конверсия).
2. Испускание кванта флюоресценции: S1 → S0 + hnфл
3. Фотохимическая реакция: S1 → продукт.
4. Передача энергии возбуждения другой молекуле.
5. Обращение спина электрона и переход молекулы в триплетное возбужденное состояние: S1 → Т1 (интеркомбинационная конверсия). Спины электронов в состоянии Т1 и S0 одинаковы, поэтому переход в основное состояние запрещен и время жизни молекулы в Т1 значительно больше – 10–4–10 с. Из триплетного состояния возможны следующие пути реализации энергии:
– безизлучательный переход с обращением спина электрона: Т1 → S0;
– испускание кванта фосфоресценции: Т1 → S0 + hn;
– фотохимическая реакция: Т1 → продукт;
– передача энергии возбуждения другой молекуле.
Любые излучательные переходы в молекуле (флюоресценция, фосфоресценция) называют общим термином – люминесценция.
Для того чтобы данный раствор или вещество поглощали энергию падающего пучка света необходимо выполнение энергетического условия: частота поглощаемого излучения (n) должна соответствовать выражению Бора:
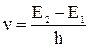 ,
,
где h – постоянная Планка – 6,63∙10–34 Дж∙с, Е1 – энергия основного состояния молекулы, Е2 – энергия возбужденного состояния. Уравнение показывает, что энергия кванта (фотона) поглощается молекулой целиком, а не по частям.
Поглощение света внешне проявляется в ослаблении светового потока при прохождении через исследуемый объект. Это явление может быть измерено инструментально с помощью приборов: спектрофотометра, фотоэлектроколориметра:
 ,
,
где Т – коэффициент светопропускания; I0 – интенсивность света, падающего на образец; I – интенсивность света, прошедшего через раствор (величина 1–Т называется коэффициентом светопоглощения). Поскольку коэффициент светопропускания связан с концентрацией раствора сложной экспоненциальной зависимостью, на практике обычно используют величину оптической плотности (D).
Закон Бугера–Ламберта–Бера: поглощение света исследуемым образцом прямо пропорционально зависит от концентрации вещества (с, моль∙л–1), расстояния, которое свет проходит в растворе – длины оптического пути (l, см) и способности вещества поглощать свет данной длины волны – коэффициента молярной экстинкции (e, л∙моль–1∙см–1):
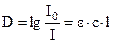 ,
,
Коэффициент молярной экстинкции является фундаментальной характеристикой вещества, его величина не зависит от условий измерения, а определяется лишь способностью данных молекул поглощать свет той или иной длины волны. Значения e для многих веществ определены и внесены в соответствующие справочные издания.
Закон Бугера-Ламберта-Бера иногда выражают в виде

Коэффициент молярной экстинкции может быть выражен через натуральный молярный показатель поглощения (cl):  . Величина cl отражает суммарное эффективное сечение поглощения всех молекул одного моля (cl=s×NA). Поэтому закон Бугера-Ламберта-Бера может иметь вид
. Величина cl отражает суммарное эффективное сечение поглощения всех молекул одного моля (cl=s×NA). Поэтому закон Бугера-Ламберта-Бера может иметь вид

Графики, выражающие зависимость D (реже e) от длины волны падающего света, называют спектрами поглощения вещества.
За поглощение света в ультрафиолетовой и видимой областях спектра ответственны определенные группы, входящие в состав сложных молекул и называемые хромофорными группами. Обычно они имеют систему сопряженных двойных связей (часто циклические, ароматические системы).
Наиболее значимые полосы поглощения биологических макромолекул:
1. λ ≈ 190 нм – пептидные связи белковой молекулы (интенсивность полосы увеличивается при нарушении пространственной организации молекулы);
2. λ ≈ 255-280 нм – серосодержащие аминокислоты (цистин, цистеин, метионин);
3. λ ≈ 260 нм – пуриновые и пиримидиновые основания нуклеотидов;
4. λ ≈ 280 нм – ароматические аминокислоты (триптофан, фенилаланин, тирозин);
5. λ ≈ 412 нм (полоса Соре) – порфиринсодержащие соединения (гемоглобин);
6. λ ≈ 500 нм – комплекс ретиналя и опсина (зрительный пигмент родопсин).
Регистрация спектров поглощения – широко используемый диагностический и научно-исследовательский метод. Он позволяет:
1. Идентифицировать вещество в исследуемой пробе.
2. Определить концентрацию вещества в растворе.
3. Оценить конформационные перестройки макромолекул, которые приводят к изменению соотношения хромофоров на их поверхности.
Люминесценция.
Одним из путей реализации возбужденного состояния молекулы может быть излучательный переход на основной уровень (S0), сопровождающийся испусканием кванта света. Это явление носит название – люминесценция. Способностью к люминесценции обладают различные вещества – люминофоры.
Люминесценцию классифицируют по типу возбуждения:
– фотолюминесценция (свечение вещества в результате его возбуждения светом);
– радиолюминесценция (свечение под действием ядерных излучений – a-, b-, g-излучения);
– рентгенолюминесценция (свечение люминофора при его возбуждении рентгеновскими лучами);
– катодолюминесценция (свечение люминофора при его бомбардировке электронами – катодными лучами);
– электролюминесценция (свечение вещества в электрическом поле);
– триболюминесценция (свечение тел в результате их деформации);
– хемилюминесценция (свечение тел при химических реакциях);
– биолюминесценция (свечение биообъектов, связанное с процессами их жизнедеятельности).
Явление люминесценции подчиняется следующим законам.
Закон Стокса – спектр люминесценции сдвинут в длинноволновую область относительно спектра поглощения того же вещества, поскольку средняя энергия квантов люминесценции ниже средней энергии поглощенных квантов. Излучение кванта люминесценции всегда происходит с нижнего колебательного подуровня нижнего возбужденного состояния (S1 или T1) независимо от того на каком уровне находился электрон после возбуждения молекулы. Переход электрона на нижний подуровень происходит за счет рассеивания части энергии в виде тепла (q), поэтому квант люминесценции hνлюм имеет меньшую энергию и большую длину волны, чем кванты возбуждающего света hνвозб.
hνвозб = hνлюм + q
ν = c/λ
λлюм > λ возб
Правило Каши – форма спектра люминесценции не зависит от длины волны возбуждения люминесценции, а определяется природой вещества. Спектр фотолюминесценции по форме совпадает со спектрами других типов люминесценции данного вида молекул, то есть не зависит от способа возбуждения молекулы.
Для фотолюминесценции вводится понятие квантового выхода (h) – отношение числа излученных квантов (Nлюм) к числу поглощенных (Nвозб):



Квантовый выход может принимать значения от 0 до 1 и отражает вероятность протекания люминесценции относительно иных путей дезактивации возбужденного состояния.
Согласно закону Вавилова квантовый выход фотолюминесценции постоянен в широкой области длин волн возбуждающего света, следовательно, определяется природой вещества. Так, квантовый выход флуоресценции триптофана ≈ 0,17 (в составе белков от 0,02 до 0,4); тирозина ≈ 0,2; фенилаланина ≈ 0,04; ДНК≈10–4. При этом необходимо учитывать, что при определенных условиях внешней среды может увеличиться вероятность безизлучательных переходов, что приводит к тушению люминесценции (повышение температуры, увеличение концентрации люминофора, наличие примесей).
Явление люминесценции нашло широкое применение в науке и промышленности и используется:
1. Люминесцентные микроскопы применяются в гистологических, цитологических исследованиях.
2. Иммунный анализ при помощи флуоресцентных меток, присоединенных к антигену или антителу.
3. Исследование проницаемости гематоэнцефалического и гистогематического барьеров по флуоресценции флуоресцеина.
4. В исследованиях энергетического состояния вещества, пространственной структуры молекул, процессах миграции энергии.
5. Стимулированная хемилюминесценция клеток в присутствии люминола является важным показателем функционального состояния фагоцитов, их способности к генерации активных форм кислорода.
6. Для химического анализа веществ, обнаружения примесей (правило Каши).
7. При создании экранов электронных приборов (катодолюминесценция), люминесцентных источников света с высоким КПД.