ЗАДАНИЯ ИЗ ЕГЭ 2019 ПО ХИМИИ
Задание (ОВР)
Максимальное количество баллов – 2:
- выбраны вещества, и записано уравнение окислительно-восстановительной реакции;
- составлен электронный баланс, указаны окислитель и восстановитель
Самая частая ошибка – неправильно составлена реакция.
Пс… А ты хоть раз видел ОВР с мышьяком?
www.youtube.com/watch?v=vgWEmUtzkLg
Реакции из ЕГЭ 2019 (без электронного баланса):
2КMnO₄ + 16HCl = 2KCl + 2MnCl₂ + 5Cl₂ + 8H₂O
KMnO₄ - окислитель
HCl – восстановтель
6KI + 2KMnO₄ + 4H₂O = 2MnO₂ + 3I₂ + 8KOH
КI - восстановитель
КMnO4 – окислитель
KNO₂ + Br₂ + 2KOH = KNO₃ + 2KBr + H₂O
KNO₂ - восстановитель
Br₂ - окислитель
2KMnO₄ +3H₂O₂ =2MnO₂ +2KOH+3O₂ +2H₂O
KMnO₄ - окислитель
H₂O₂ - восстановитель
2Cr(OH)₃ + NaClO₃ + 4NaOH = 2Na₂CrO₄ + NaCl + 5H₂O
Cr(OH)₃ - восстановитель
NaClO₃ - окислитель
Cr₂O₃+4KOH+3KClO=2K₂CrO₄+3KCl+2H₂O
KClO – окислитель
Сr₂O₃ – восстановитель
3Cl₂+6NaOH(горяч.)=5NaCl+NaClO₃+3H₂O
Cl₂ – и окислитель, и восстановитель
Cl₂+2NaOH(холод.)= NaCl+NaClO+H₂O
Cl₂ – и окислитель, и восстановитель
Задание (РИО)
Максимальное количество баллов – 2:
- выбраны вещества, и записано молекулярное уравнение реакции ионного обмена;
- записаны полное и сокращенное ионное уравнения реакций.
Частые ошибки:
Не до конца сокращено ионное уравнение.
На ионы расписан слабый электролит (то, что нельзя расписывать).
Реакции из ЕГЭ 2019:
Sr(NO₃)₂+2KF=SrF₂↓+2KNO₃
Sr²⁺+2NO₃⁻+2K⁺+2F⁻=SrF₂↓+2K⁺+2NO₃⁻
Sr²⁺+2F⁻=SrF₂↓
Na₂HPO₄+NaOH=Na₃PO₄+H₂O
2Na⁺+HPO₄²⁻+Na⁺+OH⁻=3Na⁺+PO₄³⁻+H₂O
HPO₄²⁻+OH⁻=PO₄³⁻+H₂O
Fe₂(SO₄)₃+6KOH=2Fe(OH)₃+3K₂SO₄
2Fe³⁺+3SO₄²⁻+6K⁺+6OH⁻=2Fe(OH)₃+6K⁺+3SO₄²⁻
Fe³⁺+3OH⁻=Fe(OH)₃
(CH₃COO)₂Mg+2NaOH=2CH₃COONa+Mg(OH)₂↓
2CH₃COO⁻+Mg²⁺+2Na⁺+2OH⁻=2CH₃COO⁻+2Na⁺+Mg(OH)₂↓
Мg²⁺+2OH⁻=Mg(OH)₂↓
(CH₃COO)₂Sr+Na₂S=2CH₃COONa+SrS↓
2CH₃COO⁻+Sr²⁺+2Na⁺+S²⁻=2CH₃COO⁻+2Na⁺+SrS↓
Sr²⁺+S²⁻=SrS↓
2AgF+(CH₃COO)₂Mg=MgF₂↓+2CH₃COOAg
2Ag⁺+2F⁻+2CH₃COO⁻+Mg²⁺=MgF₂↓+2CH₃COO⁻+2Ag⁺
Mg²⁺+2F =MgF₂↓
Na₂HPO₄+NaOH=Na₃PO₄+H₂O
2Na⁺+HPO₄²⁻+Na⁺+OH⁻=3Na⁺+PO₄³⁻+H₂O
HPO₄²⁻+OH⁻=PO₄³⁻+H₂O
Задание
Максимальное количество баллов – 4:
За каждую верно написанную реакция 1 балл.
Частая ошибка – не уравнена или неправильно уравнена реакция.
Пример решения 32 задания - www.youtube.com/watch?v=gR_dYFo_yU8
Задания с ЕГЭ 2019:
Сульфат меди прореагировал с алюминием. Выделившуюся соль отделили, растворили в воде и добавили раствор карбоната натрия.
Выделявшийся осадок прореагировал с гидроксидом натрия. Образовавшаяся соль прореагировала с избытком серной кислоты.
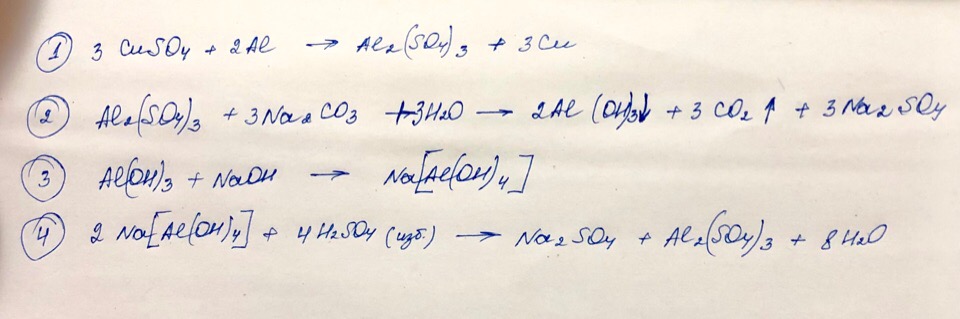
Карбонат натрия сплавили с оксидом железа (III). Полученное вещество обработали избытком раствора, полученном при пропускании через воду оксида азота (IV) и кислорода. Образовавшееся соединение выделили и поместили в в раствор карбоната калия.
Напишите уравнения 4 представленных реакций.

К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте.
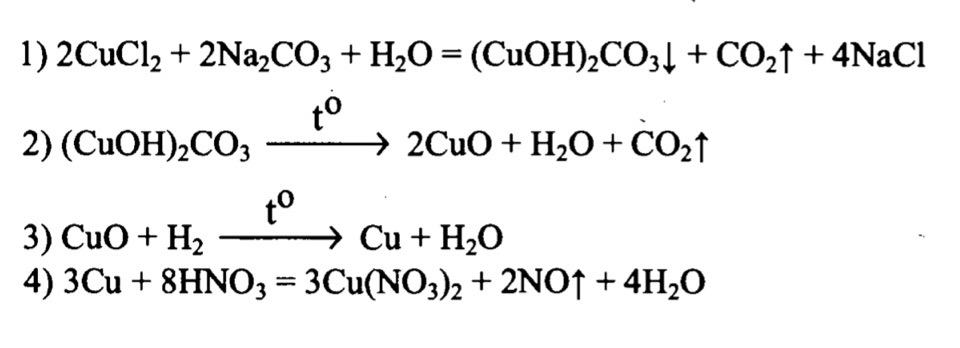
Задание
Максимальное количество баллов – 5:
За каждую верно написанную реакция 1 балл.
Частая ошибка – не уравнена или неправильно уравнена реакция (особенно реакция окисления с участием КMnO4, или K2Cr2O7, или KCrO4).
Полезным будет повторить важнейшие способы получения органических веществ - www.youtube.com/watch?v=-3ArY4gOLAA
Или можно посмотреть решение нескольких вкусных органических цепочек - www.youtube.com/watch?v=Oyvu2MxJVI4
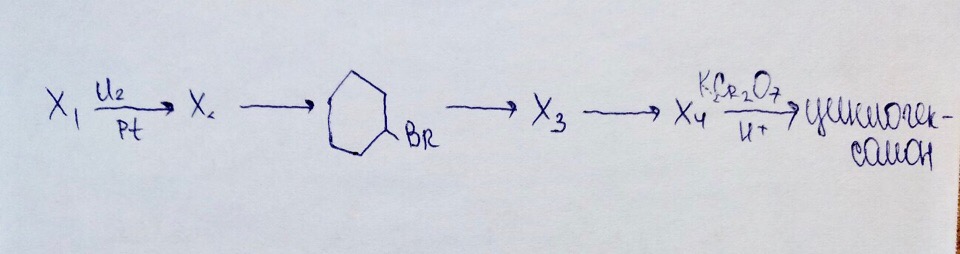


CaC₂ → X₁ —Hg²⁺→ CH₃CHO —KMnO₄, H₂SO₄→ X₂ —NaHCO₃ → CH₃COONa —NaOH → X₃
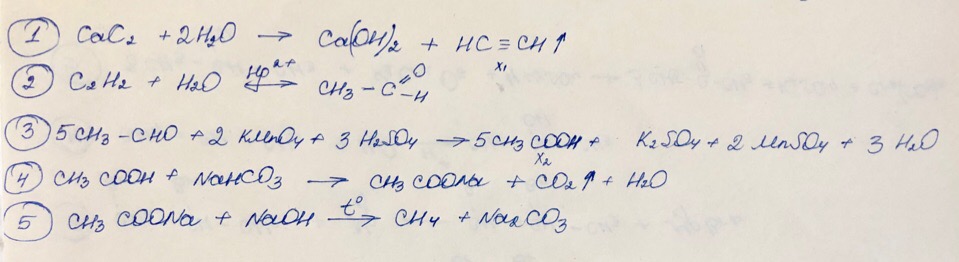
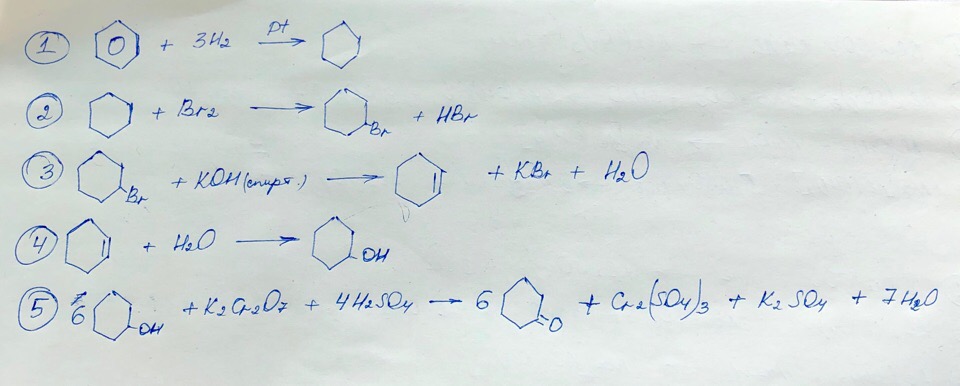
Х₁ —Pt, t⁰→ Х₂ —Br₂→ 1,2-дибромпропан → Х₃ —Н₂О, Н⁺→ Х₄ —K₂Cr₂O₇, H₂SO₄→ CH₃-C(O)-CH₃

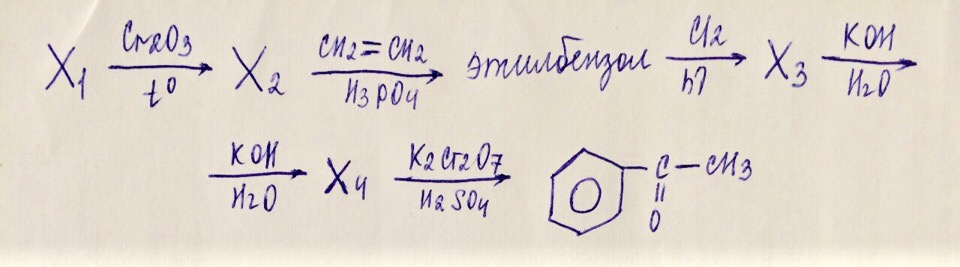

Толуол → бензоат калия —КОН, t°→ X₁ → изопропилбензол → 2-фенил-2-хлорпропан —КОН (водн.) → Х₂
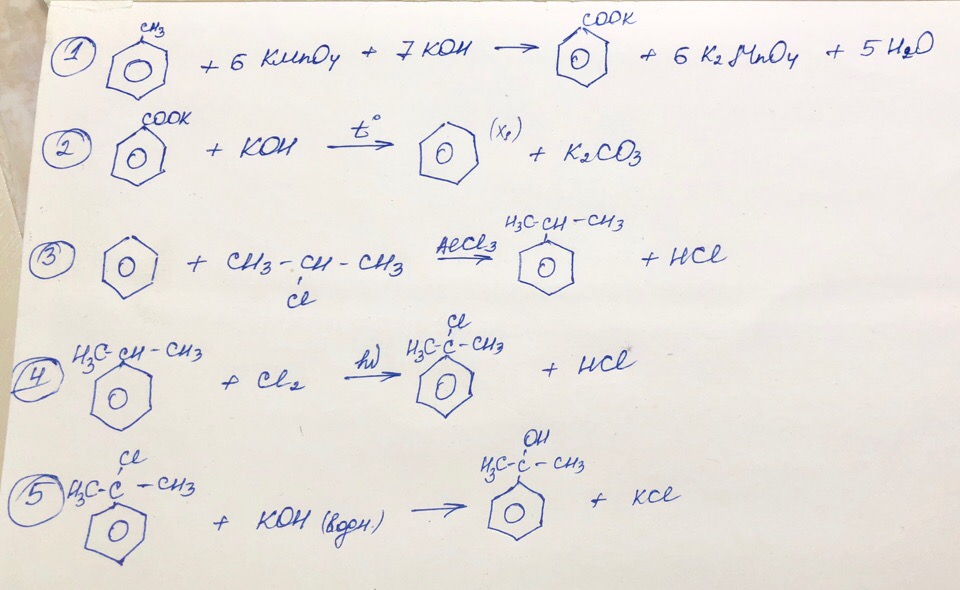
Задание
Максимальное количество баллов – 4:
- правильно записаны уравнения реакций, соответствующих условию задания;
- правильно произведены вычисления, в которых используются необходимые физические величины, заданные в условии задания;
- продемонстрирована логически обоснованная взаимосвязь физических величин, на основании которых проводятся расчёты;
- в соответствии с условием задания определена искомая физическая величина.
Пример решения 34 задания (самого сложного задания в ЕГЭ!) - www.youtube.com/watch?v=RjvK9F5nz8w
Растворимость безводного карбоната натрия составляет 31,8 г на 100 г воды. Его растворили в 400 мл воды и получили насыщенный раствор. Раствор разлили по двум колбам. К первой добавили сульфат железа 3, а ко второй азотную кислоту (масса раствора - 300 г). В результате второй реакции обьем выделившегося углекислого газа был два раза больше, чем в первой реакции. Найдите массовую долю нитрата натрия в полученном в ходе второй реакции растворе.

Задание
Максимальное количество баллов – 3:
- правильно произведены вычисления, необходимые для установления молекулярной формулы вещества и записана молекулярная формула вещества;
- записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания;
- с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания.
Частая ошибка – неправильно составлена структурная формула органического вещества.
Пример решения не самой простой 35 задачки - www.youtube.com/watch?v=CkQO88v7ud0
Органическое вещество содержит 49,31% углерода, 43,84% кислорода. Известно что данное вещество реагирует с гидроксидом натрия при нагревании, образуя этанол и соль органической кислоты. Написать реакцию с гидроксидом натрия.

Соль вторичного амина прореагировала с ацетатом серебра с образованием органического вещества А и бромида серебра. Известно,что вещество А содержит 11,76% азота, 10,92% водорода, 26,89 кислорода.
1) Установить формулу вещества А.
2) Написать реакцию взаимодействия соли вторичного амина с ацетатом серебра.

Задания 1 части
Свойства ионных решёток:
Ø Свойства веществ ионного строения:
1) Высокие t плавления
2) Высокая электропроводность расплавов
3) Летучесть
4) Пластичность
5) Высокая электропроводность кристаллических структур
Ответ: 12
1 – конечно, субъективное определение. Температура плавления выше, чем у молекулярных, но ниже, чем у атомных. Но выбираем этот вариант (остальное не подходит)
2 – расплавы содержат «свободные» заряженные частицы, которые могут направленно двигаться. А ток – это направление заряженных частиц.
Ø Как отличить пентан от пропанола-2 (часть задания на соответствие):
1) Аммиачный раствор оксида серебра
2) Бромная вода
3) Хлороводород
4) Крахмал
5) Кальций
Ответ: 5
Спирт будет взаимодействовать с кальцием, при этом будет происходить активное выделение газа:
2(CH₃)₂-CH-OH + Ca → ((CH₃)₂-CH-O)₂Ca + H₂↑
Ø Выберите вещества с молекулярной кристаллической решёткой:
1) Формиат натрия
2) Оксид кремния
3) Калий
4) Ацетальдегид
5) Оксид серы (IV)
Ответ: 45
Кристаллические решётки (виды):
• ионная
• атомная
• молекулярная
• металлическая
________
 Формиат натрия - ионная
Формиат натрия - ионная
 Оксид кремния - атомная!
Оксид кремния - атомная!
 Калий - металлическая
Калий - металлическая
 Ацетальдегид - молекулярная
Ацетальдегид - молекулярная
 Оксид серы - молекулярная
Оксид серы - молекулярная
Ø Выберите вещества, с которыми взаимодействует барий:
1) Хлорид кальция (р-р)
2) Водород
3) Сера
4) Гидроксид натрия
5) Сульфат калия (р-р)
Ответ: 23
1) Ва в растворе будет реагировать с водой.
2) Ва + Н₂ = ВаН₂
Активные Ме образуют с водородом гидриды 
3) Ba + S = BaS
4) Ноу, активные металлы с щелочами не взаимодействуют
5) Нет (причину можешь найти в первом пункте)
Ø Выберите два вещества, которые имеют изомеры:
1) Ацетон
2) Формальдегид
3) Бутен-1
4) Пропан
5) Ацетилен
Ответ: 13
 Aцетон - это кетон, а кетоны изомерны альдегидам.
Aцетон - это кетон, а кетоны изомерны альдегидам.
Ацетон (диметилкетон) - пропаналь
 Формальдегид - альдегид, которому нет изомерного кетона
Формальдегид - альдегид, которому нет изомерного кетона
 Бутен-1
Бутен-1
Ему можно подобрать несколько изомеров:
Среди циклоалканов: метилциклопропан и циклобутан
Среди алкенов: бутен-2
 Пропан - это алкан. Алканам свойственна структурная изомерия, НО начиная с бутана, поэтому Ноу!
Пропан - это алкан. Алканам свойственна структурная изомерия, НО начиная с бутана, поэтому Ноу!
 Ацетилен - алкин. Алкинам свойственна структурная изомерия и изомерия положения кратной связи, НО не для ацетилена: уж слишком короткая углеродная цепь.
Ацетилен - алкин. Алкинам свойственна структурная изомерия и изомерия положения кратной связи, НО не для ацетилена: уж слишком короткая углеродная цепь.
Ø Выберите два вещества, с которыми взаимодействует метилэтиламин:
1) C₆H₆
2) NaOH
3) HCl
4) C₂H₅Cl
5) NaCl
Ответ: 34
Метилэтиламин СН₃-NH-C₂H₅ - вторичный амин.
 Амины являются производными аммиака и проявляют ОСНОВНЫЕ свойства, поэтому реагируют с кислотами (как органическими, так и неорганическими) с образованием солей (3):
Амины являются производными аммиака и проявляют ОСНОВНЫЕ свойства, поэтому реагируют с кислотами (как органическими, так и неорганическими) с образованием солей (3):
СН₃-NH-C₂H₅ + HCl → [СН₃-NH₂-C₂H₅]⁺Cl⁻
 Ещё одним свойством аминов является способность вступать в реакции алкилирования с галогеналканами (4). При этом из вторичного амина может получиться соль третичного амина:
Ещё одним свойством аминов является способность вступать в реакции алкилирования с галогеналканами (4). При этом из вторичного амина может получиться соль третичного амина:
СН₃-NH-C₂H₅ + C₂H₅Сl → [СН₃-NH-(C₂H₅)₂]⁺Сl⁻
 Взаимодействие с углеводородами, щелочами и солями для аминов не характерно!
Взаимодействие с углеводородами, щелочами и солями для аминов не характерно!
Ø Пропанол-1 → Х → 2-хлорпропан —NaOH(водн.)→ Y
Выберите вещества Х и Y.
Ответ: 13
1)CH₂OH-CH₂-CH₃ —(H₂SO4, t>140°)→ CH₂=CH-CH₃ + H₂O
2)CH₂=CH-CH₃ + НCl → CH₃-CHCl-CH₃
3)CH₃-CHCl-CH₃ + NaOH(водн.) → CH₃-CH(OH)-CH₃ + NaCl
Ø В двух пробирках были растворы Al₂(SO4)3. При добавлении в первую пробирку раствора Х выпал нерастворимый гидроксид и растворимая соль. При добавлении раствора Y образовалась нерастворимая и растворимая соль.
Выберите вещества Х и Y:
1) Mg(OH)₂
2) KOH
3) CH₃COONH₄
4) (NH₄)₃PO₄
5) HNO₃
Ответ: 24
 Ну, разберёмся с первой пробиркой.
Ну, разберёмся с первой пробиркой.
Чтобы выпал нерастворимый гидроксид, необходимо добавить основание: 1 или 2
Так как соли реагируют только с РАСТВОРИМЫМИ ОСНОВАНИЯМИ (ЩЕЛОЧАМИ), выбираем 2 вариант:
Al₂(SO₄)₃ + 6KOH (нед.) = 2Al(OH)₃↓ + 3K₂SO₄
 Теперь вторая пробирка.
Теперь вторая пробирка.
Две соли образуются только при взаимодействии двух солей (оба реагента должны быть растворимыми!)
Al₂(SO₄)₃ + 2(NH₄)₃PO₄ = 2AlPO₄↓ + 3(NH₄)₂SO₄