Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Олово, свинец, медь, ртуть, золото, платина, серебро не реагируют с водой.
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
Металлы, стоящие в ряду активности после водорода, не реагируют с водой. Олово, свинец, медь, ртуть, золото, платина, серебро не реагируют с водой. | ||||
| с щелочными и щелочноземельными металлами оксиды не образуются Щелочные металлы – это I группа, А - главная подгруппа – Li, Na, K, Rb, Cs, Fr Щелочно-земельные металлы – это II группа, А – главная подгруппа (Be, Mg не относятся) – Ca, Sr, Ba, Ra | 3Fe + 4H2O = =4H2 +Fe3O4 (только при нагревании) | t Si + 2H2O = SiO2 + 2H2 2B + 3H2O(пар) → B2O3 +3H2 S + H2O≠ N2+ H2O≠ 4Р + 6Н2О = РН3 + 3Н3РО2 (фосфорноватистая кислота, оксид не образуется). Галогены оксидов не образуют с водой: F2 + H2O = 2HF + O или 3F2 + 3H2O = OF2 + 4HF + H2O2; остальные галогены (Сl2, I2, Br2)по схеме: Hal + H2O = HHal + HHalO. Сl2 + Н2О → НСl + НСlO Эта реакции является реакцией диспропорционирования, где галоген одновременно является окислителем и восстановителем. | При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород: C + H2O = CO + H2. | |
| Окислительно-восстановительные реакции с участием кислот | ||||
| 2P + 5H2SO4 = 2H3PO4 + 5SO2 + 2H2O. Cu + 4HNO3(конц.)→ Cu(NO3)2+ 2NO2 + 2H2O S + 2H2SO4(конц.)→ 3SO2 + 2H2O S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2H2O Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV): C + 2H2SO4 = CO2 + 2SO2 + 2H2O; C + 4HNO3 = CO2 + 4NO2 + 2H2O. | 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO; S + 2HNO3 = 2NO + H2SO4. | |||
| прочие реакции | ||||
| 6P + 5KClO3 = 5KCl + 3P2O5 CH4 + 2O2 → CO2 + 2H2O. черный порох: 2KNO3 + 3C + S = N2 + +3CO2 + K2S. | ||||
Кислородсодержащие соединения галогенов
Все кислородсодержащие соединения галогенов получены косвенным путем. Наиболее устойчивы соли, меньше – оксиды и кислоты. Для галогенов характерно образование большого числа оксидов, отвечающих различным степеням окисления. Больше всего устойчивых соединений образует хлор. Из соединений кислорода с фтором существует только фторид кислорода OF2. Хлор образует четыре оксида, степень окисления хлора +1, +3, +4, +7; бром – один, степень окисления брома +4, и большое число неустойчивых оксидов; йод – один, степень окисления йода +5. Все оксиды неустойчивы, разлагаются с большим выделением тепла.
Физические свойства и способы получения некоторых оксидов галогенов приведены в таблице:
| Соединение | Агрегатное состояние | Температура плавления,°С | Температура кипения,°С | Получение |
| OF2 | Бесцветный газ | -224 | -145 | 2F2 + 2NaOH = OF2 + 2NaF + H2O (при 0°С) |
| Cl2O | Желто-коричневый газ с резким запахом | -116 | 3HgO + 2Cl2 = Hg3O2Cl2 + Cl2O | |
| ClO2 | Желтый газ | -60 | 2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2 | |
| Cl2O7 | Маслянистая бесцветная жидкость | -90 | 2HClO4 + P2O5 = Cl2O7 + 2HPO3 | |
| Br2O4 | Бледно-желтые кристаллы | Разлагается при Ткомн. | - | Br2 + O3  Br2O4, Br2O, Br2O3, BrO3 Br2O4, Br2O, Br2O3, BrO3
|
| I2O5 | Бесцветные кристаллы | - | 2HIO3 = I2O5 + H2O (при 230°С) |
ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
| основные | амфотерные | кислотные | несолеобразующие | |||||||||||||
| с кислотами (основные и амфотерные взаимодействуют с кислотами, если образуется растворимая соль. Большинство кислотных оксидов не взаимодействует с кислотами) | ||||||||||||||||
| K2O+2HNO3 → →2KNO3 +H2O 3K2O+ 2H3PO4= 2K3PO4+ +3H2O | Al2O3+6HCl→2AlCl3+3H2O



| СО2+HCl≠
СО2+HNO3≠
СО2+ H2SO4≠
реакции с кислотами нехарактерны, но возможны следующие
12 HBr + 2 CrO3 = =3Br2 + 2 CrBr3 +
+6 H2O
SO2 + 2HNO3 = H2SO4 + 2NO2 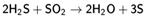 SiO2 + 6HF = H2SiF6 + +2H2O.
SiO2 + 4 HF = =SiF4↑ + 2 H2O
2NO2 + 8HI = N2 + +4I2 + 4Н2О (возникает фиолетовое пламя)
2HNO3+Р2O5=
=2НРО3+N2O5
Р2О5 + 2НСlО4 = =2HPO3 + Сl2О7
Р2О5 + 2НСl≠
SiO2 + 6HF = H2SiF6 + +2H2O.
SiO2 + 4 HF = =SiF4↑ + 2 H2O
2NO2 + 8HI = N2 + +4I2 + 4Н2О (возникает фиолетовое пламя)
2HNO3+Р2O5=
=2НРО3+N2O5
Р2О5 + 2НСlО4 = =2HPO3 + Сl2О7
Р2О5 + 2НСl≠
| нехарактерно, но 2 NO + 2 H2S = =N2 + 2S СO + H2SO4 = CO2 + +SO2 + H2O | |||||||||||||
| с солями | ||||||||||||||||
| не характерны | Амфотерные оксиды вытесняют при сплавлении летучие кислотные оксиды из их солей, например:
 Al2O3 + K2CO3
Al2O3 + K2CO3  2KAlO2 + CO2 2KAlO2 + CO2  , ,
| Менее летучие оксиды вытесняют более летучие из их солей CaCO3+SiO2=CaSiO3+CO2 Са3(РО4)2 + 3 SiO2 (10000) → 3 CaSiO3 + +P2O5 (менее летучий оксид вытесняет более летучий) 2NO2 + Na2CO3→ →NaNO3 + NaNO2 + CO2 также реакции вида (образование кислых солей): CaCO3 + H2O + +CO2 = Сa(HCO3)2. | нехарактерно Восстановление некоторых благородных металлов из солей (при комнатной Т): СО + PdCl2 + Н2О = Pd↓ + СО2↑ + +2HCl | |||||||||||||
| с основаниями | ||||||||||||||||
| не взаимодействуют | амфотерные оксиды реагируют с сильными щелочами
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] (в растворе)
ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
оксид железа реагирует только при сплавлении с раствором щелочи не взаимодействует

| все кислотные оксиды реагируют с основаниями P2O5 + 6KOH = =2K3PO4 + 3H2O 2NO2 + 2NaOH→ →NaNO3 + NaNO2 + H2O NaOH + SO2изб.→ NaHSO3- если сернистый газ взят в избытке 2NaOH + SO2→ Na2SO3 + H2O CO2 + Ba(OH)2 → →BaCO3 + H2O. | нехарактерно, но CO + NaOH = HCOONa | |||||||||||||
| с оксидами | ||||||||||||||||
с кислотными и амфотерными
CaO + SO2 = CaSO3
ВаО + SiO2 = ВаSiO3,
МgО + Аl2О3 = Мg(AlO2)2,
СaO + Al2O3  Сa (AlO2)2. Сa (AlO2)2.
| вступают с основными и с кислотными:

 Al2O3+Na2O =2NaAlO2
ZnO + CoO = CoZnO2
ZnO+ Аl2О3 =ZnAl2O4
Al2O3+Na2O =2NaAlO2
ZnO + CoO = CoZnO2
ZnO+ Аl2О3 =ZnAl2O4
| 2ZnO + SiO2 = Zn2SiO4, ZnO + B2O3 = Zn(BO2)2. кислотный оксид с кислотным не реагирует, но возможны: SO2+ NO2 =SO3 + NO N2O5 + SО2 = N2 + +SО3 + 2 О2 | ZnO + CO = Zn + CO2 N2O + SO2 + H2O = N2 + H2SO4 SO2 + 2СО = S + 2CO2 Fe2O3+CO→ 2FeO+CO2 | |||||||||||||
| с водой реакции идут только тогда, когда возможно образование растворимого или мало растворимого гидрооксида, все амфотерные - нерастворимые гидроксиды. | не реагируют | |||||||||||||||
Na2O + H2O = 2NaOH
Мелкокристаллический оксид магния химически активен, медленно реагирует с водой:
MgO + H2O = Mg(OH)2;
с кислородом идет реакция:

| не взаимодейсвуют ZnO + H2O = реакция не идет (Zn(OH)2 не растворим в воде) CuO+ H2O = реакция не идет (Cu(OH)2 не растворим в воде) Fe2O3 + H2O = реакция не идет (Fe(OH)3 не растворим в воде) |  все кислотные реагируют с водой всегда с образованием кислоты, только оксид кремния не реагирует
H2O +SiO2≠
P2O5 + H2O = 2HPO3,
P2O5 + 3H2O = 2H3PO4.
Cl2O + H2O→ 2HClO - Хлорноватистая кислота
ClO2 + H2O→ HClO2 + HClO3
Cl2O6 + H2O→ HClO3 + HClO4
Cl2O7 + H2O→ 2HClO4
2NO2 + H2O→ HNO3 + +HNO2
N2О3 + Н2O = 2HNО2
все кислотные реагируют с водой всегда с образованием кислоты, только оксид кремния не реагирует
H2O +SiO2≠
P2O5 + H2O = 2HPO3,
P2O5 + 3H2O = 2H3PO4.
Cl2O + H2O→ 2HClO - Хлорноватистая кислота
ClO2 + H2O→ HClO2 + HClO3
Cl2O6 + H2O→ HClO3 + HClO4
Cl2O7 + H2O→ 2HClO4
2NO2 + H2O→ HNO3 + +HNO2
N2О3 + Н2O = 2HNО2
| ||||||||||||||
| с простыми веществами с галогенами, фосфором, азотом не взаимодействуют, есть исключения SO2 + Cl2 — SO2Cl2 хлористый сульфурил и др. | ||||||||||||||||
При сильном нагревании оксидов с углеродом часто образуются карбиды (СаО + 3С  СаС2 + СО)
CaO + 2H2 СаС2 + СО)
CaO + 2H2  CaH2 + H2O
4FeO +O2→ 2Fe2O3
2MgO + Si = 2Mg + SiO2
FeO + C CaH2 + H2O
4FeO +O2→ 2Fe2O3
2MgO + Si = 2Mg + SiO2
FeO + C  Fe + CO Fe + CO  ,
FeO +H2 → Fe + H2O ,
FeO +H2 → Fe + H2O
|
Восстановители (С, Н2, активные металлы, в частности Mg, Al) при нагр. восстанавливают многие оксиды до металла, напр.:

 ZnO + H2 = Zn + H2O.
ZnO + C = Zn + CO
PbO + C = Pb + CO
ZnO + H2 = Zn + H2O.
ZnO + C = Zn + CO
PbO + C = Pb + CO

|
2SO2 + O2 = SO3
SO2 + O3 = SO3+ O2
SO2 + Вr2 + 2Н2О = H2SO4 + 2НВr
При температуре выше 1000 °С реагирует с активными металлами, при этом образуется кремний:
SiO2 + 2Mg = Si + 2MgO
или при избытке восстановителя – силициды:
SiO2 + 4Mg = Mg2Si + 2MgO.
При температуре = 1150°С реагирует с углеродом:
SiO2 + 3С = SiС+ 2СО
По твердости карборунд близок к алмазу.
SiO2 + 2Н2 = Si + 2Н2O.
2Mg+CO2 =2MgO+C
Р2О3 + 2Cl2 + 5Н2О = 4HCl + 2H3PO4
P2O5 + 5 C = 2 P + 5 CO
С+2NO2 =CO2 +2NO
S + 2NO2 = SO2 + +2NO.
2NO2 + 7Н2 = 2NH3 + +4Н2О
2 NO2 + 2 S = N2 +2 SО2 

|
2NO + O2→ 2NO2
При реакции с монооксидом углерода образуется фосген:
 2NO + 2H2 = N2 + 2Н2О (со взрывом)
2NO + 2H2 = N2 + 2Н2О (со взрывом)
| |||||||||||||
| разложение оксидов | ||||||||||||||||
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
оксид алюминия, меди не разлагаются | не разлагаются,
за исключением
 NO + NО2 + 2NaOH = 2NaNО2 + Н2O
N2O3 и N2O5 Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
NO + NО2 + 2NaOH = 2NaNО2 + Н2O
N2O3 и N2O5 Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
2N2O5 = 4NO2 + O2
| |||||||||||||||
| прочие реакции | ||||||||||||||||
3CuO+2NH3  3Cu+
+N2+3H2O 3Cu+
+N2+3H2O
| 4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2O. 3SO2 + 2КМnO4 + 4Н2О = 3H2SO4 + 2MnO2↓ + 2КОН Cl2+SO2+2H2O=H2SO4+ +2HCl SO2 + Н2O2 = H2SO4 | |||||||||||||||
|
| Поделиться: |
Поиск по сайту:
Читайте также:
Деталирование сборочного чертежа
Когда производственнику особенно важно наличие гибких производственных мощностей?
Собственные движения и пространственные скорости звезд