Химия 10 класс
03.11. 2021
Задания присылать на эл.адрес: vikusja1_87@mail.ru либо в https://vk.com/id22224588
Тел.: 071 350 95 40 (Viber и WhatsApp)
Тема: « Химические свойства (на примере метана и этана): реакции замещения (галогенирование), дегидрирования как способы получения важнейших соединений в органическом синтезе. Горение метана как один из источников тепла. Нахождение в природе и применение алканов»
Цель: обобщение и углубление знаний о химических свойствах алканов, их получении и применении.
Содержание учебного материала:
Посмотреть видео по ссылке: https://youtu.be/bGkafXoHr6Y
Изучить текстовый материал:
Химические свойства алканов
1) реакции замещения (наиболее характерны для алканов).
а) галогенирование – процесс замещения атомов водорода на атомы галогенов (хлор, бром, йод, фтор). Эти реакции проводятся под действием УФ-излучения или высокой температуры, и в их результате образуется смесь галогензамещенных алканов. Схематично хлорирование метана можно изобразить следующим образом:
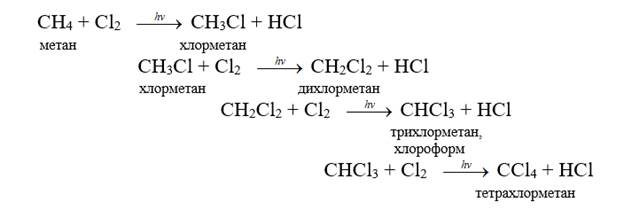 CHCl3 + Cl2
CHCl3 + Cl2 
 CCl4 + HCl
CCl4 + HCl
б) нитрование (реакция Коновалова) – процесс замещения атома водорода на нитрогруппу.
СН4 + HNO3 
 CH3NO2 + H2O
CH3NO2 + H2O
нитрометан
2) реакции отщепления (также характерны для алканов)
а) дегидрирование – отщепление от молекулы алкана молекулы водорода и получение непредельного УВ.
СН3 – СН2 - СН3  СН3 – СН = СН2 + Н2
СН3 – СН = СН2 + Н2
пропан пропен
б) ароматизация. Алканы с шестью и более атомами углерода в цепи в присутствии катализатора циклизуются с образованием бензола и его производных
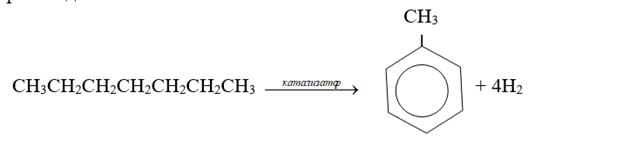
3) окисление
а) горение (характерно для всех углеводородов)
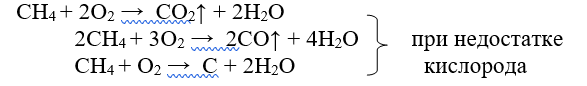
б) каталитическое окисление. В зависимости от условий проведения реакции (температура, давление) и природы катализатора могут образовываться спирты, альдегиды или карбоновые кислоты.
|
|
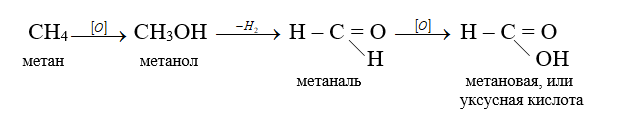
4) разрушение цепи. В результате этих реакций происходит разрыв связей между атомами углерода или между атомами углерода и водорода.
а) пиролиз – термическое разложение без доступа воздуха при пониженном давлении.
СН4  С + 2Н2
С + 2Н2
б) крекинг С6Н14 → С3Н8 + С3Н6
в) изомеризация – процесс превращения углеводородов нормального (линейного) строения в разветвленные.
СН3 – СН2 – СН2 – СН3  СН3 – СН – СН3
СН3 – СН – СН3
бутан ׀
СН3 2-метилпропан
Основные промышленные способы получения:
1) из природного сырья (нефти, природного и попутного нефтяного газов) с помощью ректификации.
Ректификация(фракционная перегонка) – физический способ разделения смеси компонентов с различными температурами кипения.
Газообразные алканы чаще получают из природного и попутного нефтяного газов, а твердые – из нефти.
2) газообразные и жидкие алканы находят более широкое применение в народном хозяйстве, чем твердые. Поэтому часть твердых (высших) алканов, получившихся в результате ректификации, используют для получения низших предельных УВ. Для этого их подвергают крекингу.
Крекинг – разложение молекул высших углеводородов под действием высокой температуры примерно пополам.
С10Н22 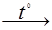 С5Н12 + С5Н10
С5Н12 + С5Н10
декан пентан пентен
3) При крекинге высших УВ, как мы видим, кроме предельных УВ образуются непредельные УВ. Из них также можно получить алканы с помощью реакции гидрирования.
Гидрирование – присоединение водорода к молекулам непредельных УВ.
|
|
С5Н10 + Н2 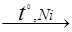 С5Н12
С5Н12
пентен пентан
Основные лабораторные способы получения.
4) Синтез Вюрца. При взаимодействии галогеналканов с натрием образуются предельные УВ и галогенид натрия.
2СН3 – СН2Br + 2Na → CH3 – CH2 – CH2 – CH3 + 2NaBr
бромэтан бутан бромид натрия
Синтез Вюрца хорошо протекает только в том случае, когда атом галогена присоединен к первичному атому углерода. В результате этой реакции цепь атомов углерода увеличивается в два раза. Если натрием подействовать на смесь галогеналканов (например, бромэтан и бромметан), то в результате образуется смесь алканов (этан, пропан и бутан).
5) Гидролиз карбидов. При обработке некоторых карбидов, например, карбида алюминия, водой образуется метан.
Al4C3 + 12 H2O → 4 Al(OH)3 + 3 CH4
Применение алканов
Предельные УВ, в особенности метан, находят очень широкое применение в народном хозяйстве. Их применение связано с их свойствами.
1) Благодаря высокой теплоте сгорания алканы используют в качестве достаточно дешевого топлива в быту, в промышленности, как моторное топливо.
2) Получение спиртов, альдегидов, органических кислот, а далее из них – каучуков, синтетических моющих средств, синтетических жиров, смазочных материалов, лаков, эмалей и т.д.
3) Метан – источник водорода для синтеза аммиака, ацетилена – для газосварки, сажи – для резины и типографской краски.
4) Получение галогенпроизводных:
- хлорметан – растворитель;
- дихлорметан – используют как растворитель и в холодильной технике;
- трихлорметан (хлороформ) – как растворитель, получение фреонов, тефлона, хлорофоса;
|
|
- тетрахлорметан (четыреххлористый углерод) – как растворитель, получение фреона, гашение пламени, обезжиривающее средство;
- хлорэтан – средство местной анестезии.
Задания для выполнения:
1. В рабочую тетрадь записать все способы получения и все химические свойства алканов с уравнениями реакции.
2. Подготовить презентацию «Применение алканов».