При непрерывном внутрисосудистом введении между поддерживающей и нагрузочной дозами (скоростями введения) существует следующая зависимость:
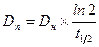 .
.
Единственным принципиальным отличием постоянного введения лекарства в организм от его дискретного назначения является постоянное непрерывное поступление вещества в организм, поэтому, естественно сделать вывод, что все закономерности, которые мы установили для дискретного введения будут иметь место и в случае непрерывной инфузии:
· Время достижения стационарной концентрации лекарства составляет 4-5t½ и не зависит от скорости инфузии (величины вводимой дозы).
· При увеличении скорости инфузии (вводимой дозы) величина СSS также увеличивается в пропорциональное число раз.
· Элиминация лекарства из организма после прекращения инфузии занимает 4-5t½.
Однако, благодаря тому, что лекарство поступает в организм человека непрерывно, его концентрация при введении изменяется не ступенчато (как при дискретном введении), а плавно. Кроме того, отсутствует колебание концентрации в стационарном состоянии, поэтому определение максимальной и минимальной границы колебаний CSS теряет свой смысл.
11. Элиминацией лекарств (лат. elimino – выносить за порог) – называют совокупность процессов метаболизма и выведения, которые способствуют удалению активной формы лекарства из организма и снижению его концентрации в плазме крови. Элиминация включает в себя 2 процесса: биотрансформацию (метаболизм) и экскрецию лекарств. Основными органами элиминации являются печень и почки. В печени элиминация протекает путем биотрансформации, а в почках – путем экскреции.
Биотрансформацией (метаболизмом) называют изменение структуры лекарств в результате их химической модификации. Основная направленность процессов метаболизма – перевод лекарств в гидрофильную форму, которая лишена фармакологической активности и способна легко выводиться из организма.
Лекарственные вещества и их метаболиты выводятся из организма следующими путями:
· через почки (с мочой);
· через печень (с желчью);
· через легкие (с выдыхаемым воздухом, мокротой);
· через кожу и слизистые с секретами расположенных в них желез (сальные, потовые, слизистые, слюнные);
· через молочные железы (с молоком).
13-16. Почечный клиренс лекарств, механизмы, их количественные и качественные характеристики.
Почечный клиренс - это мера объема плазмы крови, которая очищается от лекарственного вещества в единицу времени почками: Cl (мл/мин) = U × V/P, где U - концентрация ЛС в мл мочи, V – объем мочи, выделяемой в мин и P = концентрация ЛС в мл плазмы.
Механизмы почечного клиренса и их характеристика:
1. Фильтрация: ЛС, выделяемое только фильтрацией {инсулин} будет иметь клиренс, равный СКФ (125-130 мл/мин).Определяется: почечным кровотоком, несвязанной фракцией ЛС и фильтрационной способностью почек.
Большинство препаратов имеет низкие молекулярные массы и поэтому свободно фильтруется от плазмы в клубочке.
2. Активная секреция: ЛС, выделяемое фильтрацией и полной секрецией {парааминогиппуриевая кислота}, будет иметь клиренс, равный почечному плазменному клиренсу (650 мл/мин)
Почечный каналец содержит две транспортных системы, которые могут выделить препараты в ультрафильтрат, одна для органических кислот и другая для органических оснований. Эти системы требуют энергии для активного транспорта против градиента концентраций; они – место конкуренции за переносчика одних лекарственных веществ с другими.
Определяется: максимальной скоростью секреции, объемом мочи
3. Реабсорбция: значения клиренса между 130 и 650 мл/мин предполагают, что ЛС фильтруется, выделяется, и частично повторно реабсорбируется. Реабсорбция происходит на протяжении всего почечного канала и зависит от полярности ЛС, реабсорбируются неполярные, липофильные.
Определяется: величиной рН первичной и ионизацией ЛС.
Ряд таких показателей как возраст, совместное употребление нескольких лекарственных препаратов, болезни значительно влияют на почечный клиренс:
а) почечная недостаточность уменьшение клиренса ЛС высокий уровень ЛС в крови
б) гломерулонефрит потеря сывороточного белка, который обычно был доступен и связывал ЛС увеличение уровня свободной фракции ЛС в плазме
21. Факторы, влияющие на почечный клиренс лекарств. Зависимость клиренса от физико-химических свойств лекарственных средств.
Факторы, влияющие на почечный Cl:
а) гломерулярная фильтрация
б) скорость почечного кровотока
в) максимальная скорость секреции
г) объѐм мочи
д) несвязанная фракция ЛС в крови
Зависимость почечного клиренса от физико-химических свойств ЛВ:
Общие закономерности: 1) полярные ЛС не реабсорбируются, неполярные – реабсорбируются 2) ионные ЛС секретируются, не ионные – не секретируются.
I. Неполярные неионогенные вещества: фильтруются только в несвязанных формах, не секретируются, реабсорбируются.
Почечный клиренс мал и определяется: а) фракцией ЛС, несвязанной в крови б) объемом мочи
II. Полярные неионогенные вещества: фильтруются в несвязанной форме, не секретируют, не реабсо рбируются
Почечный клиренс высокий, определяется: а) фракцией ЛС, несвязанной в крови б) скоростью гломерулярной фильтрации
III. Ионизированные в моче неполярные в неионной форме: фильтруются, активно секретируются, неполярные реабсорбируются
Почечный клиренс определяется: а) фракцией ЛС, несвязанной в крови б) фракцией ЛС, ионизированной в моче в) объемом мочи
IV. Ионизированные в моче полярные в неионизированном виде: фильтруются, активно секретируются, не реабсорбируются
Почечный клиренс определяется: а) почечным кровотоком и скоростью гломерулярной фильтрации б) максимальной скоростью секреции.
Печеночный клиренс лекарств, его детерминанты и ограничения.
Механизмы печеночного клиренса:
1) метаболизм (биотрансформация) путем окисления, восстановления, алкилирования, гидролиза, коньюгации и т.д.
Основная стратегия метаболизма ксенобиотиков: неполярные вещества полярные (гидрофильные) метаболиты, выводимые с мочой.
2) секреция (выведение нетрансформированных веществ в желчь)
Только полярные вещества с молекулярной массой > 250 активной транспортируются в желчь (органические кислоты, основания).
Детерминанты печеночного клиренса:
а) Скорость кровотока в печени
б) Максимальная скорость экскреции или метаболических превращений
в) Km – константа Михаэлиса
г) Несвязанная с белком фракция
Ограничения печеночного клиренса:
1. Если Vmax/Km велико → Cl печ = скорости кровотока в печени
2. Если Vmax/Km средние величины → Cl = сумма всех факторов
3. Если Vmax/Km мало → Cl печ мал, ограничен
19. Биотрансформация лекарств. Несинтетические и синтетические реакции метаболизма.
Биотрансформацией (метаболизмом) называют изменение структуры лекарств в результате их химической модификации. Основная направленность процессов метаболизма – перевод лекарств в гидрофильную форму, которая лишена фармакологической активности и способна легко выводиться из организма.
Метаболизм лекарств включает 2 фазы:
I фаза – несинтетические реакции метаболизма. К этой фазе относят окисление, восстановление или гидролиз молекул лекарства. Основная направленность реакций этого типа – лишить ксенобиотик активности.
Восстановление. Реакции восстановления характерны для:
·  Кетонов, альдегидов и карбоновых кислот. Эти реакции протекают в печени. Таким образом происходит, например, восстановление варфарина.
Кетонов, альдегидов и карбоновых кислот. Эти реакции протекают в печени. Таким образом происходит, например, восстановление варфарина.
· Нитроредукции ароматических соединений, содержащих нитрогруппу. Данный вид реакций протекает в печени и кишечнике. Таким образом происходит метаболизм метронидазола. R-NO2¦R-NH2
· Азоредукция. Характерна для салазопиридазина. R-N=N-R’¦R-NH2+H2N-R’
Гидролиз. Наиболее характерен для сложных эфиров и замещенных амидов. Протекает в стенке кишечника, печени и крови. Функцию гидролиза эфиров в крови чаще всего осуществляет фермент псевдохолинэстераза (бутирилхолинэстераза), который имеет низкую субстратную специфичность и может гидролизовать любую эфирную связь.
Путем гидролиза протекает метаболизм эналаприла, тестостерона пропионата (эфирный гидролиз), лидокаина (амидный гидролиз).
Окисление. Окисление биологических субстратов – универсальный механизм инактивации ксенобиотиков, который обеспечивают микросомальные ферменты печени. Это группа липофильных белков, сосредоточенная в мембранах эндоплазматического ретикулума гепатоцитов. Основой микросомальной системы ферментов являются 2 энзима: флавопротеин-НАДФ·Н-зависимая цитохром Р450 редуктаза и гемопротеин цитохром Р450.
 Схема 6. Цикл микросомального окисления. Пояснения в тексте. Л – лекарственное вещество.
Схема 6. Цикл микросомального окисления. Пояснения в тексте. Л – лекарственное вещество.
|
Первоначально, окисленный Р450 присоединяет лекарственное вещество. Затем, комплекс цитохром-лекарство восстанавливается НАДФ·Н-зависимой редуктазой и присоединяет кислород. Для активации молекулы кислорода НАДФ·Н-зависимая редуктаза повторяет цикл восстановления. На финальном этапе, один из атомов кислорода включается в молекулу воды, а второй – в лекарственное вещество, после чего цитохром регенерирует в исходное состояние.
Цитохром Р450 является не 1 ферментом, а суперсемейством из более чем 300 изоформ, способных катализировать около 60 типов окислительных реакций, с сотнями потенциальных субстратов. Фактически, цитохромы способны обеспечить окисление не только всех существующих в настоящее время молекул лекарств, но и все лекарства, которые когда-либо еще будут синтезированы.
Молекулы цитохрома Р450, которые функционируют в клетках человека могут быть объединены в 17 семейств: CYP1-CYP17. Наибольшую роль в метаболизме лекарств играют первые 3 семейства CYP1-CYP3 (из них изоформы CYP3A4/3A5 и CYP2D6 метаболизируют 75% всех лекарств).
II фаза – синтетические реакции метаболизма. Как правило, эти реакции протекают только после того, как завершиться фаза I. Синтетические реакции метаболизма призваны повысить гидрофильность ксенобиотика. Все реакции этой группы могут быть разделены на 2 вида:
· Реакции, в которых активируется конъюгирующее вещество:
º Глюкуронизация;
º Ацетилирование;
º Сульфатирование;
º Метилирование.
· Реакции, в которых активируется ксенобиотик:
º Глицилирование.
Основной реакцией конъюгации в организме взрослого человека является глюкуронизация.
21. Энтерогепатический цикл ЛС - ряд препаратов и продуктов их превращения в значительном количестве выводится с желчью в кишечник, откуда частично выводится с экс крементами, а частично - повторно всасывается в кровь, вновь попадает в печень и выводится в кишечник.
Печеночная элиминация препаратов может быть значительно изменена болезнью печени, возрастом, диетой, генетикой, продолжительность назначения лекарственных средств (например, вследствие индукции печеночных ферментов), и других факторов.
Факторы, изменяющие клиренс лекарственных веществ. Стратегия индивидуальной лекарственной терапии.
1. Взаимодействия ЛС на уровне: почечной секреции, биохимической трансформации, явлений ферментативной индукции
2. Болезни почек: нарушения кровотока, острые и хронические поражения почек, исходы длительных почечных заболеваний
3. Болезни печени: алкогольный цирроз, первичный цирроз, гепатиты, гепатомы
4. Болезни ЖКТ и эндокринных органов
5. Индивидуальная непереносимость {отсутствие ферментов ацетилирования – непереносимость аспирина}
Признание важной роли концентрации как связующего звена фармакокинетики и фармакод инамики способствует созданию стратегии целевой концентрации - оптимизации дозы у данного больного на основе измерения концентрации ЛС. Она складывается из следующих этапов:
1. Выбор целевой концентрации
2. Расчет Vd и Cl на основе типовых значений и внесения поправок с учетом таких факторов как масса тела и функция почек.
3. Ввод загрузочной дозы или поддерживающей дозы, рассчитанных с учетом значений TC, Vd и Cl.
4. Регистрация реакции больного и определение концентрации ЛС
5. Пересмотр Vd и Cl на основе результатов измерения концентрации.
6. Повтор шагов 3-6 с целью подбора необходимой для оптимальной реакции на лекарство поддерживающей дозы.