Ортодоксальная термодинамика считает сегодня внутренней энергией не только энергию движения молекул, но и приплюсованную к ней энергию молекулярного взаимодействия, внятного определения которой нет. А толкование такое: всем ясно, мол, что молекулы в жидкости взаимодействуют сильнее, чем в газе, а в твёрдом теле сильнее, чем в жидкости. Значит, агрегатное превращение должно сопровождаться энергетическим эффектом, конкретно тепловым. Чтобы расплавить твёрдое тело, не достаточно нагреть его до температуры плавления, требуется вогнать в него некоторое количество теплоты Qпл, которое пойдёт на само плавление. Чтобы превратить жидкость в газ – аналогично (Qисп). А при конденсации и затвердевании, наоборот, тепло, якобы, выделяется (Qконд, Qкр).
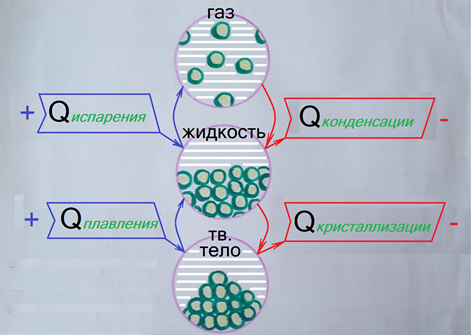
Правда агрегатные превращения происходят при фиксированной температуре и калориметры не реагируют на теплоты агрегатных превращений (К слову, как мы показывали в статье про калориметры, калориметрическим способом вовсе НЕ измеряются теплоты реакций, а ВЫЧИСЛЯЮТСЯ, исходя из принятой теории. Т.е., если теория окажется верна, то вычисляемые теплоты тоже будут верны, а если теория окажется НЕ верна, то делайте выводы сами). Поэтому эти теплоты называют скрытыми. Они включаются в балансы энергий, ведь считается, что они реально имеют место. Но так ли это?
В своё время исследователи смешивали холодную и горячую воду и определяли результирующую температуру смеси. При равных количествах холодной и горячей воды она оказывалась средне арифметической. И вот химик Блэк, а затем ещё и химик Вильке (это примерно в середине 18 века) провели аналогичные исследования, смешивая горячую воду не с холодной водой, а со льдом. Для случая равных исходных весов для льда при 00С и для воды при 730С, после полного расплавления льда, конечная температура всей воды оказалась далеко от средне арифметического. Она составляла 00С. До сих пор считается, что этот опыт доказывает наличие скрытой теплоты плавления льда. Ибо, куда делся весь 73-х градусный запас тепла горячей воды, если не на плавление льда?
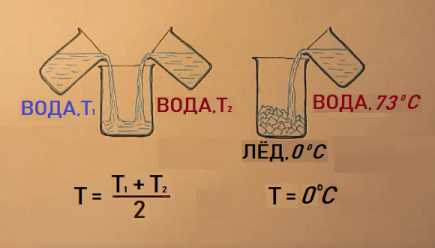
А теперь следите за рассуждениями. Так, если весь этот запас тепла был вкачан в плавящийся лёд, то внутренняя энергия получившейся изо льда воды должна быть больше (!), чем она была у льда. А температура то осталась прежней, значит должна увеличиться энергия молекулярных взаимодействий. Выходит, что в жидкости молекулярное взаимодействие сильнее, чем в твёрдом теле? Тогда и в газе – сильнее, чем в жидкости? Но ведь в газе, особенно в идеальном, энергия молекулярных взаимодействий считается равной нулю. Выход ортодоксы нашли такой: энергию молекулярных взаимодействий считать ОТРИЦАТЕЛЬНОЙ (?!!). Тогда, ДА! Чем энергия БОЛЬШЕ, тем энергия взаимодействия СЛАБЕЕ!!! Такие вот шуточки!
А теперь вспомните положения «цифровой» физики применительно к контакту «горячего» тела с «холодным» - никакой перекачки тепловой энергии от первого тела ко второму НЕ происходит. В обеих телах происходят скоррелированные перераспределения энергий в двух сопряжённых парах энергий. Но, если следить только за энергиями в этих парах, ответственных за температуры (максвелловскую и планковскую) по принципу: «тут вижу, а там не вижу», то, действительно, можно впасть в иллюзию «передачи энергии от горячего тела к холодному». Но стоит только раскрыть глазки по шире (при рассмотрении анализа «теплообмена») и эта иллюзия сразу пропадает. См. соответствующие статьи на стене в ВК и на сайте. Вывод: теплоты плавления/кристаллизации и испарения/конденсации – заблуждения теоретиков! Да, понимаем, очень многие положения официальной термодинамики летят к едреней фене. Но академики тут сами виноваты, кривотолки официальной термодинамики будут продолжаться до тех пор, пока они (академики) будут продолжать цепляться за средневековые архаизмы в виде Первого и Второго начал термодинамики. Ещё раз подчеркнём, плавление ни в какой скрытой теплоте не нуждается! Что нагрелось до температуры плавления, то и расплавиться. Просто у всех материалов очень разная теплопроводность. Вот, например, металлы с их хорошей теплопроводностью. Образец прогревается и начинает плавиться сразу во всём объёме. В индукционных печах металлический лом, например, алюминиевый не плавится постепенно, по капельке, торчащие фрагменты начинают плыть и течь сразу по всему своему объёму. А вот у льда теплопроводность гораздо хуже, чем у металлов, вот он и тает постепенно, по капельке. Но принцип тот же: что нагрелось до температуры плавления – то и расплавилось!
В опытах, проделанных Блэком, и Вильке, и им подобным нет доказательной силы о наличии теплоты плавления у льда. Просто фазовый переход льда в воду происходит из-за конечной и малой теплопроводности льда некоторое время, в которое плавящийся лёд всё время находится при температуре 00С и является источником охлаждения окружающей его воды. При этом лёд не забирает никакой тепловой энергии у остывающей воды (См. статьи о ТЕМПЕРАТУРЕ и СОРЯЖЁННЫХ ПАРАХ ЭНЕРГИЙ). У остывающей воды две энергии – средняя энергия кинетического движения молекул и средняя энергия возбуждения УМЕНЬШАЮТСЯ, а сопряжённые с ними – собственная энергия и энергия связи УВЕЛИЧИВАЮТСЯ. Так же и при замерзании воды (образовании льда), никакая теплота кристаллизации (равная теплоте плавления) НЕ выделяется. И проверить это можно довольно легко. Известно, что вода замерзает именно при 00С из-за наличия в воде различных примесей и растворённых солей, вокруг этих примесей и начинаются формироваться первые кристаллики льда. А вот дистиллированная вода может быть охлаждена до значительных отрицательных температур. Подойдёт для такого опыта даже не обязательно дистиллированная вода, а достаточно и просто очищенной через бытовой фильтр. Поставьте бутылочку такой воды в морозильник и её там можно охладить до -50С, -70С и даже максимум где-то до -120С и вода будет оставаться в жидкой фазе. Достаньте аккуратно такую переохлаждённую воду из морозильника, например, при -70С, встряхните её и вода в бутылке за 3-5 секунд превратится в снежные хлопья, переверните её, вытекать она не будет. А теперь возьмите справочное значение теплоты кристаллизации льда и посчитайте, до какой температуры должна нагреться эта быстро замёрзшая бутылка воды. Получится, что вы должны просто обжечься об такую теоретически «горячую» бутылку. А она как была при -70С, так при них и осталась! Куда-то тут «испарилась» вся ортодоксальная теплота кристаллизации! А также считается, что при образовании льда на водоёмах тоже выделяется та самая теплота кристаллизации. Как вы знаете, уже при небольшой отрицательной температуре (-20С, -30С) ледяная корочка на водоёмах образуется. Опять, берём справочное значение теплоты кристаллизации льда и теплоёмкости воздуха. И решаем простенькую задачку: сколько ортодоксального тепла должно выделится с каждого квадратного метра водоёма при образовании на поверхности ледяной корки (или при дальнейшем нарастании льда) толщиной всего в 1 мм? Так вот, оказывается столько, что прилегающий к земле десятиметровый слой воздуха должен нагреться аж на 23 (!) градуса. Получается, в момент первого заморозка должно сразу лето наступить? Или я ошибся? Посчитайте сами, если что, поправьте меня. Да и опыт с плавлением (с пресловутой теплотой плавления) льда можно видоизменить. У льда, как мы отмечали выше, малая теплопроводность, поэтому он должен будет относительно долго контактировать с тёплым телом (водой, в нашем случае), чтобы постепенно растаять. В сопряжённых парах энергий в воде конечно будут происходить внутренние перераспределения. Но! Для плавления льда нужно поддерживать температуру всего лишь на чуть-чуть выше точки ликвидуса, например, доли градуса выше нуля. Кто из вас имеет доступ к лаборатории с калориметрами, проделайте простой эксперимент, смешайте во внутреннем стаканчике калориметра лёд при 00С и воду, например, при 0,50С. Здесь тающий лёд тоже будет источником охлаждения этой холодной воды, но в отличии от условий опыта Блэка и Вильке, здесь, так называемый, теплообмен будет минимальным, в воде в сопряжённых парах энергий также будут происходить внутренние перестановки. Но они в этом случае будут очень малы. Правда тающий лёд всё равно будет остужать воду, поэтому в опыт нужно внести следующую коррективу: нужно подогревать воду, удерживая её на уровне температуры в 0,50С и измерять производимые теплозатраты. Так вот, теплозатраты на поддержание температуры смеси на уровне чуть больше точки ликвидуса (0,50С) будут в РАЗЫменьше, чем расчётная теплота плавления. Попробуйте проверить сами. Вот такие шуточки с этими теплотами плавления/кристаллизации.
И ещё, любителям математики: если для плавления требуется дополнительное тепло, то получается чудо чудное, диво дивное. Даже старшеклассник сможет набросать график, изображающий зависимость количества тепловой энергии в образце от его температуры – в окрестностях точки плавления. Если у него рука не дрогнет, то получится следующее. Подходим мы к точке плавления со стороны низких температур: температура растёт монотонно, и количество тепловой энергии растёт монотонно. Но вот добрались до точки плавления: количество тепловой энергии продолжает расти, а температура остаётся постоянной – т.е. на графике будет вертикальный участок, с бесконечной производной от тепловой энергии по температуре. А производная от тепловой энергии по температуре – это и есть теплоёмкость. Выходит, что у плавящегося образца теплоёмкость должна быть бесконечна!? Да уж… Дойдя до этого места, теоретики, ради самоуспокоения, начинают здраво рассуждать в том духе, что на самом деле плавление происходит не строго при одной и той же температуре, а, как бы, в небольшом температурном интервальчике – чтобы теплоёмкость была не бесконечной, а как раз в соответствии со скрытой теплотой плавления. Ну, коли так, тогда оно, конечно… Вы бы, теоретики, тогда подсказали полярникам, что по нарастающей льдине можно гулять в пляжных костюмчиках – благодаря «теплу кристаллизации, уходящему через лёд в атмосферу» - а то они, глупенькие, сами не догадываются.
И ведь не только плавлению приписывают скрытую теплоту перехода – испарение тоже не обделили. «Мало нагреть воду до температуры кипения, - поучают нас, - чтобы её всю выпарить, нужно и далее подводить к ней кучу тепла! Это каждая домохозяйка знает!» Да, домохозяйки это знают. Только они к тому же понимают, что «дальнейший подвод тепла» требуется просто для поддерживания температуры кипения – иначе кипение быстро прекращается. А академики этого не понимают – они полагают, что «дальнейший подвод тепла» идёт как раз на испарение. Кто же ближе к истине – домохозяйки или академики? Сейчас поглядим! Нас ведь как учили: если тепло на испарение не подводят добровольно… то, получается, что оно должно заимствоваться насильственно. Вот, например, вода теряет молекулы на испарение даже при комнатной температуре – так нас уверяют, что при этом непременно охлаждаются окружающая среда и сама вода, которая ещё не успела испариться. И в доказательство приводят пример с измерителем влажности воздуха – на основе двух одинаковых термометров, у одного из которых шарик со ртутью обмотан влажной тряпочкой. Из-за испарения воды с этой тряпочки, «влажный» термометр показывает меньшую температуру, чем «сухой». Но говорит ли эта разность показаний о верности справочного значения теплоты испарения воды? Если прикинуть, какая часть воды от её исходного количества должна испариться, чтобы оставшаяся часть оказалась охлаждена до 0оС, то получаются, опять же, пугающие цифры – даже если считать, что лишь половина тепла на испарение заимствуется из остающейся воды (а другая половина – из окружающего воздуха). Так, при стартовой температуре воды 10оС, оставшаяся часть воды окажется при 0оС, если испарится всего 7% от исходного количества воды, а при стартовой температуре воды 90оС – для того же конечного результата потребуется испарение 32% исходной воды. Как в XXI веке может считаться научной концепция, из которой прямо следует такая чушь? Ведь, в действительности, даже если вода испаряется с тряпочки полностью, показания «влажного» термометра отнюдь не приближаются к 0оС – пока идёт это испарение воды, разность показаний «сухого» и «влажного» термометров составляет всего-то единицы градусов. Так что пусть не морочат нам головы: работа этого измерителя влажности наглядно демонстрирует: теплота испарения воды тут совершенно не при чём.
Да, но ведь при испарении воды охлаждение всё-таки имеет место. Если теплота испарения тут не при чём, то что же тут при чём? А вот нам подсказывают: конденсированное состояние воды возможно лишь при наличии достаточно большого коллектива её молекул. В процессе испарения воды с тряпочки, уменьшаются размеры остающихся микрокапель – и, при достижении микрокаплей некоторого критического размера, происходит её скачкообразный переход в парообразное состояние. Т.е., происходит взрывное испарение микрокапли, с расширением получившихся водяных паров – а, при расширении газа, он, как известно, охлаждается. И немного охлаждает тряпочку, с которой разлетается. Красота!
И ещё, возвращаясь к разногласиям между академиками и домохозяйками. Домохозяйки, как и академики, знают про сублимацию льда, т.е. про его испарение. Но, в отличие от академиков, домохозяйки имеют здесь практический опыт: они сушат сырое бельё на морозе – вода на белье сначала замерзает, а потом этот лёд испаряется. Домохозяйки отлично знают: высушенное таким образом бельё имеет температуру окружающего воздуха. Они даже не догадываются о том, насколько этот факт антинаучен. Ведь академики, из своих академических соображений, полагают, что скрытая теплота сублимации равна сумме скрытых теплот плавления и испарения. И тогда сублимация должна сопровождаться мощным охлаждающим действием. Желающие могут прикинуть – нельзя ли, с помощью циклически сохнущих на морозе тряпок, наладить дешёвое производство жидкого азота?
Нам, наверное, вежливо укажут на то, что для лазерного воздействия на металлы известны пороговые плотности мощности, выше которых происходит испарение металла. Эти пороговые величины, мол, вполне отвечают тепловому балансу, в котором фигурирует тепло, идущее не только на нагрев металла, но и на его плавление и испарение. Значит, мол, скрытые теплоты плавления и испарения – физически реальны! На это мы культурно ответим: дяденьки, вы невнимательно читали того же Григорьянца, у которого выставлены на всеобщее обозрение формулы для тех самых пороговых плотностей мощности. В этих формулах отнюдь не фигурируют скрытые теплоты плавления и испарения. В них фигурируют эмпирические коэффициенты: пороговые величины получаются верные, но что там происходит в лазерном фокусе – сие остаётся не расшифровано. Такой подход можно истолковать как проявление гуманности: у читателей, мол, и так мозг плавится – так пусть он только плавится, но не испаряется. Этот гуманизм можно понять; но про подтверждения-то реальности скрытых теплот плавления и испарения – не надо ля-ля, хорошо?
«Но ведь при плавлении и испарении, - кричат нам, - разрушаются структуры, рвутся связи! Есть у этих связей энергия, или нет?!» Вон оно чего. Связи-то рвутся! Но, видите ли, связи связям рознь. Есть связи физические, на которых держатся ядерные и атомные структуры. Вот эти связи, действительно, обладают энергией; она так и называется: энергия связи. А при плавлении и испарении рвутся не физические связи, а химические. А у них-то энергии связи как раз и нету. (См. статью «О ТЕМПЕРАТУРЕ И ТЕПЛОВЫХ ЭФФЕКТАХ ХИМИЧЕСКИХ РЕАКЦИЙ»).
Эх, термодинамика, прости!