Ко времени создания теории был хорошо изучен экспериментально атом водорода. Было известно, что он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода (так называемый линейчатый спектр). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра.В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
νnm = R(1/m2 – 1/n2) (44.3)
Для серии Бальмера m = 2, n = 3, 4, 5,.... Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4,.... Постоянная R в этой формуле называется постоянной Ридберга. Ее численное значение R = 3,29·1015 Гц. Для круговых орбит правило квантования Бора записывается в виде:
meυrn = n  (n = 1, 2, 3,...) (44.4)Здесь m e – масса электрона, υ – его скорость, rn – радиус стационарной круговой орбиты. Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением
(n = 1, 2, 3,...) (44.4)Здесь m e – масса электрона, υ – его скорость, rn – радиус стационарной круговой орбиты. Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий. Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением

где e – элементарный заряд, ε0 – электрическая постоянная. Скорость электрона υ и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда радиусы стационарных круговых орбит определяются выражением
rn =  n2
n2
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен 5,29∙10-11 м.Радиусы последующих орбит возрастают пропорционально n 2.Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом rn, равна:
Е = Ек + Еп =  -
-  (44.5)
(44.5)
Следует отметить, что E g < 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ2 и rn, получим:
En = -  ∙
∙  (44.6)
(44.6)
Целое число n = 1, 2, 3,... называется в квантовой физике атома главным квантовым числом.
Согласно второму постулату Бора, при переходе электрона с одной стационарной орбиты с энергией En на другую стационарную орбиту с энергией Em < En атом испускает квант света, частота которого ν nm:
ν nm =  =
=  (
( -
-  )
)
Рис. 44.2 иллюстрирует образование спектральных серий в излучении атома водорода при переходе электрона с высоких стационарных орбит на более низкие.

Рис. 44.2
44.3. Строение атомных ядер. Ядерные реакции
Атомное ядро состоит из элементарных частиц - протонов и нейтронов (протонно-нейтронная модель ядра была предложена российским физиком Д. Д. Иваненко (р. 1904), а впоследствии развита В. Гейзенбергом).
Протон (р) имеет положительный заряд, равный заряду электрона, и массу покоя mp = 1,6726× 10- 27 кг »1836 те, где те - масса электрона. Нейтрон (n) - нейтральная частица с массой покоя тп- 1,6749× 10- 27 кг »1839 те. Протоны и нейтроны называются нуклонами (от лат. nucleus - ядро). Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Ze, где Z - зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в Периодической системе элементов Менделеева. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z= 1 до Z= 107.
Ядро обозначается тем же символом, что и нейтральный атом: 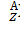 , где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А- массовое число (число нуклонов в ядре).
, где X - символ химического элемента, Z - атомный номер (число протонов в ядре), А- массовое число (число нуклонов в ядре).
Так как атом нейтрален, то заряд ядра определяет и число электронов в атоме. Ядра с одинаковыми Z, но разными А(т. е. с разными числами нейтронов
N=A-Z ) называются изотопами, а ядра с одинаковыми А, но разными Z- изобарами. Например, водород (Z=1)имеет три изотопа: 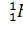 - протий (Z=1, N=0),
- протий (Z=1, N=0),  - дейтерий (Z=1, N=1),
- дейтерий (Z=1, N=1), 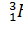 -тритий (Z=1, N=2), олово - десять, и т. д.
-тритий (Z=1, N=2), олово - десять, и т. д.
Радиус ядра задается эмпирической формулой R = R0A1/3,гдеR0=(1,3 -1,7)∙10-15 м.Плотность ядерного вещества для всех ядер 1017 кг/м3.
Исследования показывают, что атомные ядра являются устойчивыми образованиями. Это означает, что в ядре между нуклонами существует связь.
Macc-спектрометрические измерения показали, что масса ядра меньше, чем сумма масс составляющих его нуклонов. Но так как всякому изменению массы должно соответствовать изменение энергии, то, следовательно, при образовании ядра должна выделяться определенная энергия. Из закона сохранения энергии вытекает и обратное: для разделения ядра на составные части необходимо затратить такое же количество энергии, которое выделяется при его образовании. Энергия, которую необходимо затратить, чтобы расщепить ядро на отдельные нуклоны, называется энергией связи ядра, которая равна:
Есв = [Zmp + (A – Z)mn – mя]c2
где тр, тn, тя - соответственно массы протона, нейтрона и ядра. В таблицах обычно приводятся не массы т, ядер, а массы т атомов. Поэтому для энергии связи ядра пользуются формулой
Есв = [ZmH + (A – Z)mn – m]c2 (44.7)
где mн - масса атома водорода. Так как mн больше mpна величину m е, то первый член в квадратных скобках включает в себя массу Z электронов. Но так как масса атома mотличается от массы ядра m я как раз на массу Z электронов, то вычисления по данным формулам приводят к одинаковым результатам. Величина
Δm = [Zmp + (A – Z)mn] – mя
называется дефектом массы ядра. На эту величину уменьшается масса всех нуклонов при образовании из них атомного ядра.
Часто вместо энергии связи рассматривают удельную энергию связи δ Еа - энергию связи, отнесенную к одному нуклону. Она характеризует устойчивость (прочность) атомных ядер, т. е. чем больше δЕсв,тем устойчивее ядро. Удельная энергия связи зависит от массового числа Аэлемента (рис. 44.3). 
Рис. 44.7
Для легких ядер (A <12) удельная энергия связи круто возрастает до 6-7 МэВ, затем более медленно возрастает до максимальной величины 8,7 МэВ у элементов с A = 50-60, а потом постепенно уменьшается у тяжелых элементов (например, для  она составляет 7,6 МэВ). Отметим для сравнения, что энергия связи валентных электронов в атомах составляет примерно 10 эВ (в 10б! раз меньше).
она составляет 7,6 МэВ). Отметим для сравнения, что энергия связи валентных электронов в атомах составляет примерно 10 эВ (в 10б! раз меньше).
Уменьшение удельной энергии связи при переходе к тяжелым элементам объясняется тем, что с возрастанием числа протонов в ядре увеличивается и энергия их кулоновского отталкивания. Поэтому связь между нуклонами становится менее сильной, а сами ядра менее прочными.
Наиболее устойчивыми оказываются так называемые магические ядра, у которых число протонов или число нейтронов равно одному из магических чисел: 2, 8, 20,28, 50, 82, 126. Особенно стабильны дважды магические ядра, у которых магическими являются и число протонов, и число нейтронов (этих ядер насчитывается всего пять: 24He, 168O, 4020Ca, 4820Ca, 20882Ru.
Из рис. 44.3 следует, что наиболее устойчивыми с энергетической точки зрения являются ядра средней части таблицы Менделеева. Тяжелые и легкие ядра менее устойчивы. Это означает, что энергетически выгодны следующие процессы: 1) деление тяжелых ядер на более легкие; 2) слияние легких ядер друг с другом в более тяжелые. При обоих процессах выделяется огромное количество энергии; эти процессы в настоящее время осуществлены практически: реакции деления и термоядерные реакции
44.4. Радиоактивное излучение и его виды
Французский физик А. Беккерель (1852-1908) в 1896 г. при изучении люминесценции солей урана обнаружил самопроизвольноеиспускание ими излучения неизвестной природы, которое действовало на фотопластинку, ионизировало воздух, проникало сквозь тонкие металлические пластинки, вызывало люминесценцию ряда веществ.
Обнаруженное излучение было названо радиоактивным излучением, а само явление - испускание радиоактивного излучения - радиоактивностью.
Дальнейшие опыты показали, что на характер радиоактивного излучения препарата не оказывают влияния вид химического соединения, агрегатное состояние, механическое давление, температура, электрические и магнитные поля. Радиоактивные свойства элемента обусловлены лишь структурой его ядра.
В настоящее время под радиоактивностью понимают способность некоторых атомных ядер самопроизвольно (спонтанно) превращаться в другие ядра с испусканием различных видов радиоактивных излучений и элементарных частиц. Радиоактивность подразделяется на естественную (наблюдается у неустойчивых изотопов, существующих в природе) и искусственную (наблюдается у изотопов, полученных посредством ядерных реакций). Радиоактивное излучение бывает трех типов: α-, β - и γ-излучение. Подробное их исследование позволило выяснить природу и основные свойства.
α-излучение отклоняется электрическим и магнитным полями, обладает высокой ионизирующей способностью и малой проникающей способностью (например, поглощаются слоем алюминия толщиной примерно 0,05 мм).
α-излучение представляет собой поток ядер гелия; заряд α-частицы равен + 2е, а масса совпадает с массой ядра изотопа гелия 24He.
β-излучение отклоняется электрическим и магнитным полями; его ионизирующая способность значительно меньше (примерно на два порядка), а проникающая способность гораздо больше (поглощается слоем алюминия толщиной примерно 2 мм), чем у α-частнц. β-излучение представляет собой поток быстрых электронов (это вытекает из определения их удельного заряда).
γ-излучение не отклоняется электрическим и магнитным полями, обладает относительно слабой ионизирующей способностью и очень большой проникающей способностью (например, проходит через слой свинца толщиной 5 см), при прохождении через кристаллы обнаруживает дифракцию. γ-излучение представляет собой коротковолновое электромагнитное излучение с малой длиной волны λ< 10- 10 м, т. е. является потоком частиц γ-квантов (фотонов).
44.5. Закон радиоактивного распада. Правила смещения
Под радиоактивным распадом, или просто распадом, понимают естественное радиоактивное превращение ядер, происходящее самопроизвольно. Атомное ядро, испытывающее радиоактивный распад, называется материнским, возникающее ядро - дочерним. Теория радиоактивного распада строится на предположении о том, что радиоактивный распад является спонтанным процессом, подчиняющимся законам статистики. Так как отдельные радиоактивные ядра распадаются независимо друг от друга, то можно считать, что число ядер dN, распавшихся в среднем за интервал времени от t до t+dt, пропорционально промежутку времени dt и числу N нераспавшихся ядер к моменту времени t: dN = - λNdt,
где λ- постоянная для данного радиоактивного вещества величина, называемая постоянной радиоактивного распада; знак минус указывает, что общее число радиоактивных ядер в процессе распада уменьшается.
Разделив переменные и интегрируя: dN/N = - λdt,
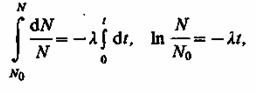
получим:N = N0e-λt, (44.8)
где N0 - начальное число нераспавшихсяядер (в момент времени t=0),N- число нераспавшихсяядер в момент времени t. Формула (44.8) выражает закон радиоактивного распада, согласно которому число нераспавшихся ядер убывает со временем по экспоненциальному закону.
Интенсивность процесса радиоактивного распада характеризуют две величины: период полураспада T1/2 и среднее время жизни mрадиоактивного ядра. Период полураспада T1/2 - время, за которое исходное число радиоактивных ядер в среднем уменьшается вдвое. Тогда, согласно (44.8)
T1/2 = ln2/λ = 0,693/λ (44.9)
Периоды полураспада для естественно-радиоактивных элементов колеблются от десятимиллионных долей секунды до многих миллиардов лет.
Суммарная продолжительность жизни dN ядер равна t∙|dN| = λNtdt.
Проинтегрировав это выражение и разделив на начальночисло ядер получим среднее время жизни τ радиоактивного ядра:
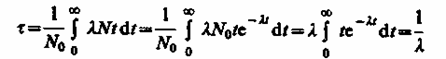
Таким образом, среднее время жизни т радиоактивного ядра есть величина, обратная постоянной радиоактивного распада λ.
Активностью А нуклида (общее название атомных ядер, отличающихся числом протонов Z и нейтронов N)в радиоактивном источнике называется число распадов, происходящих с ядрами образца в 1 с:
A = │ 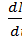 │ = λN, (44.10)
│ = λN, (44.10)
Единица активности в СИ - беккерель (Бк): 1 Бк - активность нуклида, при которой за 1 с происходит один акт распада. До сих пор в ядерной физике применяется и внесистемная единица активности нуклида в радиоактивном источнике - кюри (Ки): 1 Ки = 3,7∙1010 Бк.
Радиоактивный распад происходит в соответствии с правиламисмещения, позволяющими установить, какое ядро возникает в результате распада данного материнского ядра.
Правила смещения являются следствием двух законов, выполняющихся при радиоактивных распадах, - сохранения электрического заряда и сохранения массового числа: сумма зарядов (массовых чисел) возникающих ядер и частиц равна заряду (массовому числу) исходного ядра.
Возникающие в результате радиоактивного распада ядра могут быть, в свою очередь, радиоактивными. Это приводит к возникновению цепочки, или ряда, радиоактивных превращений,заканчивающихся стабильным элементом. Совокупность элементов, образующих такую цепочку, называется радиоактивным семейством.
Из правил смещения вытекает, что массовое число при α-распаде уменьшается на 4, а при β-распаде не меняется. Поэтому для всех ядер одного и того же радиоактивного семейства остаток от деления массового числа на 4 одинаков. Таким образом, существует четыре различных радиоактивных семейства, для каждого из которых массовые числа задаются одной из следующих формул: A = 4n, 4n + 1, 4n + 2, 4n + 3,где n - целое положительное число. Семейства называются по наиболее долгоживущему «родоначальнику»: семейства тория (от 23290Th), нептуния (от 23793Np), урана (от 23892U) и актиния (от23589Ас). Конечными нуклидами соответственно являются:
20882Pb,20983Bi, 20682Pb, 20782Pb, т. е. единственное семейство нептуния (искусственно-радиоактивные ядра) заканчивается нуклидом Bi, а все остальные (естественно-радиоактивные ядра) - нуклидами РЬ.
Единица активности в СИ - беккерель (Бк): 1 Бк - активность нуклида, при которой за 1 с происходит один акт распада. До сих пор в ядерной физике применяется и внесистемная единица активности нуклида в радиоактивном источнике - кюри (Ки): 1 Ки = 3,7∙1010 Бк.