МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН
КАЗАХСКИЙ НАЦИОНАЛЬНЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ АБАЯ

| Утверждаю Директор института Естествознания и географии _______ К.Д. Каймулдинова «__» ____ 2017г. |
ПРОГРАММА ПОДГОТОВКИ К ВСТУПИТЕЛЬНОМУ ЭКЗАМЕНУ
В магистратуру
для специальности 6M011200 –Химия
Алматы, 2017
Составители: д.п.н., профессор Шокыбаев Ж.А.
к.х.н., профессор Сейтжанов А.Ф.
к.х.н., профессор Мансуров Б.А.
Обсуждена на заседании кафедры «Химии» ИЕиГ, КазНПУ им.Абая
«__» ___.2017 г., протокол №__
Заведующий кафедрой:
д.п.н., профессор ____________ Н.К.Ахметов
Зам.директор по учебной работе
ИЕиГ ____________ Мукатаева Ж.С.
Программа рекомендована Советом института естествознания и географии «__» ___.2017 г., протокол №__
Неорганическая химия
1. Химический элемент. Изотопы. Распространение элементов, в земной коре. их массовая доля (в процентах). Редкие и рассеянью элементы.
2. Простое вещество как форма существования химического элемента. Аллотропия. Сложные вещества. Закон постоянства состава. Понятие о степени чистоты вещества. Простейшие и истинные химические формулы.
3. Закон сохранения массы вещества. Расчеты по уравнениям реакций. Закон сохранения энергии. Взаимосвязь массы и энергии. Уравнения Эйнштейна. Закон объемных отношений Гей-Люссака. Закон Авогадро. Закон кратных отношений.
4. Химический эквивалент элемента. Эквивалентная масса. Закон эквивалентов. Химические эквиваленты сложных веществ.
5. Оксиды. Классификация оксидов. Номенклатура. Способы получения, физические и химические свойства.
6. Гидроксиды. Растворимые и нерастворимые. Способы получения. Номенклатура гидроксидов. Физические и химические свойства растворимых и нерастворимых оснований.
7. Кислоты. Классификация кислот. Номенклатура. Способы получения. Физические и химические свойства кислот.
8. Соли. Классификация солей. Получение солей. Номенклатура. Физические и химические свойства солей.
9. Комплексные соединения. Основные положения координационной теории Вернера. Комплексообразователь, лиганды, внутренняя и внешняя сферы координационного соединения. Важнейшие типы координационных соединений: аквакомплексы, аммиакаты, ацидокомплексы. Номенклатура координационных соединений. Комплексные соединения в живых организмах.
10. Атом как сложная микросистема. Атомное ядро как динамическая система протонов и нейтронов. Атомные радиусы.
11. Теория атома водорода по Бору. Первоначальные атомы модели (Томсон, Резерфорд).
12. Современная Формулировка периодического закона Д.И.Менделеева. Элементы s-, p-, d-, f-, семейств. Периодически изменяющиеся свойства элементов (радиусы, энергия ионизации, электроотрицательность).
13. Основные характеристики связи: энергия, длина, направленность, поляризуемость. Типы химической связи: ковалентная и ионная.
14. Квантовое число. Атомные орбитали (АО). Электронная формула атомов.
15. Ионная связь. Катионы и анионы. Направленность ионной связи.
16.Тепловые эффекты химических реакций. Теплота образования химических соединений. Экзотермические и эндотермические реакции. Закон Гесса. Термохимические уравнения.
17. Понятие о скорости химической реакции. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действия масс. Константа скорости реакции. Зависимость скорости реакции от температуры. Влияние катализаторов на скорость химических реакций. Виды катализа: гомогенный и гетерогенный.
18. Необратимые и обратимые химические реакции. Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье.
19. Общая характеристика элементов V группы. Азот. Фосфор строение и свойства. Водородные соединения азота. Соли аммиака и аммония.
20. Общая характеристика элементов ІV группы. Сторение и свойства. Применение. Способы получения.
21. Общая характеристика элементов III группы периодической системы. Алюминий. Бор. Борная кислота. Физические и химические свойства. Применение
22. Общая характеристика элементов VIII группы периодической системы. Электронные строение железа, кобальта и никелья. Способы получения. Свойства. Применение.
23. Общая характеристика элементов VII группы периодической системы. Электронные строение. Марганец. Оксиды, кислоты и гидроксиды марганца. Способы получения. Свойства. Применение.
24. Общая характеристика элементов II группы периодической системы. Электронные структуры атомов. Магний. Кальций. Физические и химические свойства. Способы получения. Применение.
25. Общая характеристика элементов VI группы. Электронные структуры атомов. Хром. Оксиды, гидроксиды, кислоты хрома. Физические и химические свойства. Способы получения. Применение.
Основная литература:
1. Б.А. Бірімжанов. “Жалпы химия”. Алматы 2000ж.
2. Ж.Ә.Шоқыбаев. «Бейорганикалық химияның теориялық негіздері». Оқу құралы. 1-бөлім. Абай ат. ҚазҰПУ-2010ж.
3. Ж.Ә.Шоқыбаев. «Элементтер химиясы». Оқу құралы. 2-бөлім. Абай ат. ҚазҰПУ-2010ж.
4. С.Ж. Пірәлиев,Б.М. Бутин, Г.М. Байназарова, С.Ж. Жайлау. Жалпы химия. 1-2томдар. Алматы -2003ж.
5. Ж.Ә.Шоқыбаев және басқалар. Бейорганикалық химия практикумы. Алматы, Мерсал, 2005.
6. Ж.Ә.Шоқыбаев, Қаражанова Д.Ә., Оразбаева М.А. «Химия есептері мен жаттығулары». Оқу құралы. Алматы-2011ж. ИП Волкова Н.А.
Дополнительная литература:
1. Л.Б.Бабич, С.А.Балезин. Практикум по неорганической химии. М,1991 г.
2. А.И.Врублевский 1000 задач по химии. Минск, 2003 т.
3. С.К.Мырзалиева, Ж.Ы.Сабыралиева. “Жалпы және бейорганикалық химия практикумы”, Алматы, “Prints”, 2005 ж.
4. Қ.Ә.Дүйсебаев, К.М.Нарманова. Бейорганикалық химия. 300 есеп. Алматы, “Мектеп” 2004 ж.
5. Глинка.Н.Л. Задачи и упражнения по общей химии. Л.Химия.1988.
6. Угай Я.А. Общая химия. –М: Высшая школа, 1989.
7. Ерыгин В.П. Методика решения задач по химии. М: Просвещение. 1992.
8. К.А. Аханбаев. “Жалпы және бейорганикалық химия”. Алматы “Сана”, 1999 ж.
9. Ю.М.Ерохин. Химия в вопросах и ответах (учеб. пособие). Москва, Проспект-2010г. (144 стр.)
10. Ж. Шоқыбаев. “Бейорганикалық және аналитикалық химия”. Алматы “Білім”, 2003ж.
11. Өтелбаева А., Өтелбаев Б. Химия 1-2-3-4-5-6 том. Шымкент. 2002 ж.
12. Қ. Бекішев. Тотығу-тотықсыздану реакциялары. Алматы, АОМКДИ-2009.
13. Қ. Бекішев, Р. Рысқалиева, Солтанбекова. Жалпы химия есептері мен жаттығулары. Оқу құралы. Қазақ Ұлттық Университеті, Алматы – 2009.
14. Қ. Бекішев. Бейорганикалық реакциялар тізбектері. Алматы, АОМКДИ-2009.
Органическая химия
1. Основные положения теории А.М.Бутлерова. Теория строения органических молекул с точки зрения электронного строения атомов. Изомерия. Виды изомерии строения (углеродного скелета, положения функциональных групп, таутомерия), пространственной изомерии (геометрическая, оптическая, конформационная). Примеры.
2. Взаимное влияние атомов в молекуле. Индуктивный эффект (I) и его виды (+I,-I).Примеры. Мезомерный эффект (М) и его виды (+М,-М).Виды эффектов сопряжения. (π-π, σ-π). Примеры.
3. Классификация органических реакций: а) по направлению (замещение, отщепление, присоединение, перегруппировка), б) по типу разрыва ковалентной связи или по характеру реагирующих частиц (радикальные и ионные реакции), в) по количеству частиц, участвующих в стадии, определяющей скорость реакции. Примеры.
4. Предельные углеводороды. Гомологический ряд. Изомерия. Номенклатуры:историческая, рациональная, систематическая.Углеводородные радикалы. Методы получения алканов: без изменения углеродного скелета, с увеличением и уменьшением углеродного скелета.
5. Пространственное и электронное строение молекул метана и этана. Свойства алканов. Реакции замещения (галогенирование, нитрование, сульфохлорирование). Радикальный механизм.
6. Галогенопроизводные углеводородов. Изомерия, номенклатура. Способы получения из алканов, спиртов, этиленовых и ацетиленовых углеводородов.
7. Галогенопроизводные углеводородов. Химические свойства. Реакции замещения. Механизм реакций нуклеофильного замещения. Примеры. Реакции отщепления. Правило Зайцева.
8. Амины алифатического ряда. Изомерия. Номенклатура. Первичные, вторичные, третичные амины. Четвертичные соли аммония. Получение аминов (из галогеноалканов, восстановлением нитросоединений и нитритов). Кислотно-основные свойства аминов. Сравнение основных свойств.
9. Aлкeны. Гомологический ряд, изомерия, номенклатура. Методы получения алкенов (из алканов, алкилгалогенидов, спиртов алкинов). Механизм реакции отщепления. Правило Зайцева.
10. Электронное строение этилена и пропилена. Химические свойства алкенов. Электрофильный механизм присоединения по двойной связи (галогенирование, нитрогалогенирование, гидратация серной кислоты). Правило Марковникова. Исключение из правила Марковникова.
11. Химические свойства алкенов. Реакция окисления, озонирования. Реакции полимеризации и сополимеризации. Значение полимеров.
12. Диеновые углеводороды. Изомерия, номенклатура. Электронное строение 1,3-бутадиена (π,π-сопряжение). Электрофильный механизм присоединения (галогенов, галогеноводородов) к диеновым углеводородам. Промышленный синтез бутадиена и изопрена. Применение.
13. Алкины. Изомерия. Номенклатура. Электронное строение ацетилена. Связь валентного состояния атома углерода с его электроотрицательностью. Кислотные свойства ацетилена.
14. Химические свойства алкинов. Реакции присоединения (гидрирование, гидрогалогенирование, присоединение цианистоводородной и уксусной кислот) Механизм АE. Реакция гидратации. Правило Эльтекова.
15. Одноатомные спирты. Гомологический ряд, изомерия, номенклатура. Электронное строение этилового спирта. Физические свойства, влияние на них водородных связей. Способы получения спиртов (из алканов, алкенов, галогеналканов, карбонильных соединений, сложных эфиров, аминов. с помощью реактивов Гриньяра.)
16. Химические свойства спиртов. Кислотно-основные свойства. Сравнение кислотно-основных свойств воды, первичных, вторичных и третичных спиртов. Взаимодействие спиртов с металлами, магний органическими соединениями.
17. Химические свойства спиртов. Нуклеофильное замещение гидроксогруппы на галоген, образование простых и сложных эфиров. Получение этиленовых углеводородов. Окисление спиртов.
18. Двух- и трехатомные спирты. Изомерия, номенклатура. Получение. Свойства. Сравнение кислотно-основных свойств одно-, двух, трехатомных спиртов.
19. Электронное строение карбонильной группы. Получение альдегидов и кетонов: окислением спиртов, из карбоновых кислот и их солей, из дихлоропроизводных, по реакции Кучерова. Гомологический ряд, изомерия и номенклатура альдегидов и кетонов.
20. Химические свойства альдегидов и кетонов. Нуклеофильное присоединение (водорода, цианистоводородной кислоты, магний органических соединений
спиртов, аммиака, его производных). Сравнение реакционной способности альдегидов и кетонов.
21. Химические свойства альдегидов и кетонов. Реакции конденсации (альдольная и кротоновая).Окислительно-восстановительные реакции. Правило Попова. Реакции замещения и полимеризации.
22. Монокарбоновые кислоты. Изомерия. Номенклатура. Электронное строение карбоксильной группы. Взаимное влияние карбонильной и карбоксильной группы.
Кислотные свойства карбоновых кислот. Влияние углеводородного радикала на кислотные свойства. Сравнение кислотных свойств минеральных органических кислот, воды, спиртов, аминов.
23. Карбоновые кислоты. Способы получения: из спиртов, альдегидов, галогеналканов, через нитрилы и магнийорганические соединения, гидролизом жиров и масел. Производство синтетической уксусной кислоты из ацетилена.
24. Производные карбоновых кислот. Общий механизм нуклеофильного замещения. Получение хлорангидридов (действием хлорида фосфора (V) тионилхлоридом ангидридов кислот (из уксусной кислоты), хлорангидридов и солей карбоновых кислот. Использование их в качестве ацилирующих средств (гидролиз, алкоголиз, аммонолиз).
25. Производные карбоновых кислот. Получение сложных эмиров карбоновых кислот из кислот этерификацией. Механизм (кислотный катализ). Доказательство механизма с использованием меченых атомов. Гидролиз (кислотный и щелочной катализ), реакции переэтериaикации и аммонолиза. Сложные эфиры в природе и их значение в промышленности.
26. Производные карбоновых кислот. Получение амидов карбоновых кислот (ацилированием аминов, неполным гидролизом нитрилов, термическим разложением аммонийных солей). Электронное строение амидов. Сравнение основных и кислотных свойств аминов и амидов. Гидролиз амидов, взаимодействие амидов с азотной кислотой.
27. Жиры. Строение триглицеридов, состав, биологическое значение. Гидролиз жиров, гидрогенизация. Мыла, получение из жиров, синтетические моющие средства.
28. Оксикислоты. Изомерия и номенклатура. Способы получения оксикислот из альдегидов и кетонов через оксинитрил, гидролизом галогензамещенных кислот, гидратацией непредельных кислот. Химические свойства оксикарбоновых кислот, как бифункциональных производных. Отношение к нагреванию a, b, γ -оксикислот.
29. Оптическая изомерия оксикислот (молочной, винной, хлоряблочной). Оптическая активность, оптические антиподы, рацематы, диастереомеры, мезоформы, знак вращения. Проекционные сормулы Фишера. a, D -ряды.
30. Физические и химические свойства энантиомеров, рацематов, диастерео-меров. Способы разделения рацематов на антиподы: самопроизвольное расщепление при кристаллизации, биохимический метод, химический, (перевод в диастереомеры) и хроматографический.
31. Дикарбоновые кислоты. Гомологический ряд, номенклатура. Сравнение кислотных свойств дикарбоновых кислот в гомологическом ряду и с одноосновными кислотами. Отношение к нагреванию щавелевой, малоновой, янтарной и глутаровой кислот. Разложение щавелевой кислоты; (при нагревании с серной кислотой, отношение её к окислителям. Строение малоновой кислоты. Подвижность a-водородного атома. Синтез на основе натриймалонового эфира.
32. Аминокислоты, изомерия, номенклатура. Получение аминокислот: аминирова-нием a-галогенокислот, из альдегидов и кетонов, гидролизом белка. Химические свойства. Амфотерность. Комплексные соли с ионами меди (II). Реакции по аминогруппе (алкилирование, ацилирование, взаимодействие с азотной кислотой) и карбоксильной группе (образование сложных эфиров, галогеноангидридов, амидов). Отношение к нагреванию (a, b, 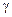 и d-аминокислот. Лантамлактимная таутомерия. Полипептиды.
и d-аминокислот. Лантамлактимная таутомерия. Полипептиды.
33. Углеводы: классификация, оптическая изомерия. Структурные, проекционные, перспективные и конформационные формулы. Антиподы, диастере-омеры, эпимеры. Мутаротация. Число оптических изомеров цепной и циклических форм.
34. Химические свойства моносахаридов. Реакции карбонильных цепных форм с синильной кислотой, с фенилгидразином. Восстановление альдоз и кетоз до многоатомных спиртов. Окисление до -оновых, -уроновых и аровых кислот. Качественные реакции на моносахариды (серебряного зеркала и с гидроксидом меди (II). Реакции циклических форм (по гидроксильным группам), метилирование.
35. Два типа дисахаридов на примере мальтозы и сахарозы: различие в химических свойствах, биологическое значение.
36. Высшие углеводы. Важнейшие представители. Крахмал. Строение цепей амилозы и амилопептина. Отличия в строении целлюлозы от крахмала. Гидролиз крахмала и целлюлозы, продукты. Нитрование и ацетилирование целлюлозы, их практическое значение.
37. Циклоалканы. Виды изомерии, связанные с числом атомов углерода в цикле со строением боковых цепей, с положением заместителей в цикле. Виды стереоизомерии: геометрическая, оптическая, конформационная. Сравнение свойств циклобутана, циклопентана, циклогексана со свойствами алканов и алкенов (отношение к действию водорода, галогенов, галогеноводородов, окислителей).
38. Бензол. Электронное строение молекулы бензола. Ароматичность. Получение ароматических соединений (дегидрирование циклоалканов и циклоалкенов, дегидроциклизация ацетилена). Окисление:озоном, контактно-каталитическое до малеинового ангидрида.
39. Химические свойства бензола и его алкилзамещенных. Механизм реакции электрофильного замещения (галогенирование, нитрование, сульфирование, алкилирование).
40. Правила ориентации для реакций электрофильного замещения в бензольном кольце. Заместители первого и второго рода. Особенность атома галогена. Статический и динамический подход. Ориентация в дизамещенных производных бензола. Согласованная и несогласованная ориентация.
41. Галогенопроизводные ароматического ряда. Галогенирование толуола в ядро и в боковую цепь. Электроннoe строение хлорбензола. Реакции нуклеофильного замещения активированного и неактивированного атома галогена. Реакции SЕ в ядро хлорбензола (хлорирование, нитрование). Свойства атома галогена в боковой цепи.
42. Ароматические сулъфокислоты. Сульфирование бензола и его производных. Электронное строение бензолсульфокислоты. Химические свойства. Реакции сульфогруппы (кислотные свойства, получение сульфохлоридов и сульфамидов. Десулъфирование, щелочное плавление (Sn). Реакции SЕ в бензольном кольце.
43. Нитросоединения ароматического ряда. Нитрование бензола и его производных (фенола, хлорбензола, нитробензола). Условия нитрования толуола в ядро и в боковую цепь. Электронное строение нитробензола. Влияние нитрогруппы в орто- и пара-положениях на реакционную способность атома галогена.
44. Фенол. Номенклатура. Получение (из изопропилбензола, щелочным плавлением ароматических сульфокислот, гидролизом арилгалогенидов и солей диазония). Электронное строение фенола. Кислотные свойства. Влияние заместителей 1 и 2 рода на кислотные свойства Фенола. Реакции электронного замещения в ядро (нитрование, галогенирование, алкилирование). Сравнение кислотных свойств фенолов, спиртов, угольной кислоты.
45. Ароматические амины. Изомерия. Номенклатура. Получение анилина (из нитробензола), вторичных и третичных аминов. Электронное строение анилина. Химические свойства, SЕ -реакции в ядре (галогенирование, нитрование) с целью получения мета-, орто- и пара-нитроанилина. Реакции аминогруппы (алкилирование, ацилирование, арилирование, взаимодействие с азотистой кислотой).
46. Соли арилдиазония. Получение солей диазония: диазотирование, условия реакции. Механизм диазотирования, строение нитрозокатиона. Электронное строение катиона арилдиазония, предельные структуры, мезоформула. Формы диазосоединений в зависимости от рН среды. Химические свойства. Реакции диазосоединений с выделением азота. Реакции солей диазония без выделения азота. Реакции азосочетания с фенолами и третичными ароматическими аминами, условия, механизм. Азосоединения. Азокрасители, электронное строение азогруппы. Примеры азокрасителей.
47. Многоядерные ароматические соединения с неконденсированными бензольными кольцами. Дифенил, его получение. Оптическая изомерия динитродифеновой кислоты (аторопоизомерия). Фенилметаны, трифенилхлорметан, трифенилкарбинол, строение, синтез. Свойства трифенилкарбинола. Трифенилметильный радикал, катион и анион, электронное строение, резонансная стабилизация. Красители трифенилметанового ряда.
48. Ароматические углеводороды с конденсированными бензольными кольцами. Нафталин. Изомерия, получение нафталина. Строение нафталина. Квазиароматические свойства. Реакции замещения, присоединения и окисления нафталина. Биологическое значение производных 1,4-нафтохинона (витамины группы К). Антрацен. Ароматический и ненасыщенный характер (квазиароматичность). Реакции замещения, присоединения, диеновый синтез. Реакции окисления антрацена. Сопоставление ароматических свойств бензола, нафталина, антрацена. Фенантрен. Фенантреновый цикл в природных соединениях. Канцерогенные углеводороды каменноугольной смолы (3,4-бензопирен и др.).
49. Пятичленные гетероциклы (пиррол, фуран, тиофен), их электронное строение. Квазиароматические свойства гетероциклов. Реакции пpиcоeдинения (гидрирование, диеновый синтез) к реакции электрофильного замещения (мягкое нитрование, сульфирование, ацилирование).Сравнение реакционной способности в реакциях Sе пиррола, фурана, тиофена, бензола и нафталина.
50. Шестичленные гетероциклы (пиридин, пиримидин, пурин). Электронное строение пиридина. Сравнение реакционной способности в реакциях пиридина, бензола, пятичленных гетероциклов. Реакции нуклеофильного замещения в ядре пиридина. Основные свойства пиридина, сопоставление со свойствами пиперидина, пиррола и анилина. Пуриновые и пиримидиновые основания, входящие в состав нуклеиновых кислот, их строение, свойства.
Основная литература:
1. Ахметов Н.С. Неорганическая химия М.,Высшая школа,1975
2. Некрасов Б.В. Общая и неорганическая химия М., Химия 1973 в трех томах.
3. Глинка Н.Л. Общая химия М.,1979
4. Николаев Л.А. Общая и неорганическая химия М., Просвещение, 1974
5. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия М., 1974
6. Перекалин В.В., Зонис С.А. Органическая химия М., 1982
7. Несмеянов А.Н., Несмеянов Н.А. Начало органической химии М.,1982
8. Нейланд О.Я. Органическая химия М., 1990
Дополнительная литература:
I. Угай Я.А, Общая химия М., Высшая школа,1977
2. Гринберг А.А. Введение в химию комплексных соединений.
3. Дей К., Сэлбин Д. Теоретическая неорганическая химия. Химия, 1976
4. Карапентьянц М.X., Дрaкин С.И. Строение вещества., Высшая школа, 1978
5. Днепровский А.С., Темникова Т.И. Теоретические основы неорганической химии Л., 1979
6. Робертс Дж.Касерио М. Органическая химия. М.,1978 Т.1.П.
7.Потапов В.М. Стереохимия. М., 1976
8. Грандберг И.И. Органическая химия. М., 1976
9. Сеитжанов А.Ф. Органическая химия. Алматы, 1993
Методика обучения химии
1. Лабораторные опыты, их место, цель значение.
2. Требования к демонстрации опытов.
3. Практические занятия, место, цель, организация и проведение.
4. Виды письменного учета знаний и умений по химии. Длительные и кратковременные письменные работы.
5. Факультативы по химии, их цель, значение, организация, тематика.
6. Формирование первоначальных химических понятий в 8 классе.
7. Беседа, как метод обучения химии и его применение.
8. Организационные формы обучения химии. Общая характеристика.
9. Формирование понятий об основных классах неорганических соединений, последовательность и методика их изучения.
10. Методика формирования понятий о ковалентной связи, план изучения.
11. Методические подходы к изучению периодического закона. Методика изучения основных закономерностей изменения свойств элементов и их соединений в свете теории строения атомов.
12. Урок как главная организационная форма обучения химии.
13. Методика изучения темы «Гидролиз солей».
14. Теория строения органических веществ, его значение.
15. Основные этапы формирования и развития понятий о валентности. Формирование понятий о степени окисления.
16. Развитие представлений учащихся об электронном и пространственном строении молекул органических веществ при изучении непредельных углеводородов.
17. Развитие представлений учащихся об электронном и пространственном строении молекул органических веществ при изучении предельных углеводородов.
18. Методика изучения пространственного строения метана.
19. Методика изучения оксидов, последовательность изучения.
20. Методика обучения химии как наука и учебный предмет в ВУЗе.
21. Рассказ, как метод обучения, его структура.
22. Содержание, построение и теоретические основы школьного курса химии.
23. Демонстрационный эксперимент в системе обучения химии, его место, в структуре урока.
24. Методы устной проверки и оценки знаний и умений учащихся.
25. Проблемность в обучении химии, примеры.
26. Методика изучения теории электролитической диссоциации, методические подходы к раскрытию механизма диссоциации.
27. Методика изучения химических свойств амфотерных соединений.
28. Закон сохранения массы веществ, использование его при составлении уравнений химических реакций.
29. Методика изучения изомерии и номенклатуры органических соединений.
30. Формирование и развитие понятий о взаимном влиянии атомов в молекулах органических веществ.
31. Методика изучения кислот, последовательность изучения.
32. Методика изучения оснований, последовательность изучения.
33. Методика изучения солей, последовательность изучения.
34. Методика определения степени окисления атомов в сложных веществах.
35. Построение и содержание курса органической химии.
36. Методика изучения металлов. Ознакомление учащихся с рядом напряжений металлов и предупреждение формального его использования.
37. Лекция как метод обучения.
38. Проблемное изучение реакции обмена.
39. Изучения строения этилового спирта.
40. Изучение строения глюкозы.
41. Изучение изомерии и номенклатуры непредельных углеводородов.
42. Фронтальная контролирующая беседа.
43. Закон постоянства состава вещества, доказательства.
44. Комбинированные (смешанные) уроки по химии, структура.
45. Тестовый контроль знаний учащихся.
46. Технология составления закрытых тестовых заданий.
47. Технология составления открытых тестовых заданий.
48. Тестовые задания на соответствия, технология составления.
49. Тестовые задания на последовательность, технология составления.
50. Методика изучения изомерии и номенклатура алканов.
Зав.кафедрой химии,
д.п.н., профессор _______________ Ахметов Н.К.