Основные свойства углеводородных газов. Плотность и относительная плотность. Относительная плотность газа по воздуху. Вязкость газов и газовых смесей. Теплоемкость (изобарная, изохорная).
К основным параметрам газа относятся:
Плотность газа  (кг/м3) – масса единицы объема, равная отношению молекулярной массы
(кг/м3) – масса единицы объема, равная отношению молекулярной массы 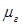 газа к объему моля:
газа к объему моля: 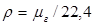 . Сумма молекулярных масс атомов, образующих молекулу, называется молекулярной массой вещества. Плотность газа зависит от давления и температуры. Поэтому данные о плотности должны сопровождаться указанием условий (давление и температура). Плотность воздуха при стандартных условиях равна 1,206 кг/м3, при нормальных условиях – 1,293 кг/м3. Плотность газа при стандартных или при нормальных условиях принимают в качестве его физической характеристики.
. Сумма молекулярных масс атомов, образующих молекулу, называется молекулярной массой вещества. Плотность газа зависит от давления и температуры. Поэтому данные о плотности должны сопровождаться указанием условий (давление и температура). Плотность воздуха при стандартных условиях равна 1,206 кг/м3, при нормальных условиях – 1,293 кг/м3. Плотность газа при стандартных или при нормальных условиях принимают в качестве его физической характеристики.
Есть параметр, характеризующий физическую природу газа. К таким параметрам относятся также плотность газа  (при стандартных или нормальных условиях) и относительная плотность по воздуху
(при стандартных или нормальных условиях) и относительная плотность по воздуху 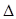 .
. 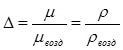
Удельный объем  (м3/кг) – объем единицы массы газа, величина, обратная плотности
(м3/кг) – объем единицы массы газа, величина, обратная плотности 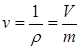 , (2.1)где
, (2.1)где 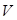 – объем газа;
– объем газа; 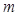 – масса газа.
– масса газа.
В расчетах используют относительную плотность природного газа по воздуху 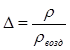 . (2.2)
. (2.2)
Линейная скорость  (м/с) газа определяется как объемный расход газа
(м/с) газа определяется как объемный расход газа  в условиях потока через единицу поперечного сечения потока
в условиях потока через единицу поперечного сечения потока 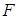 :
: 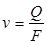 .
.
Массовая скорость 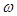
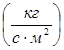 – массовый расход
– массовый расход  газа через единицу поперечного сечения потока
газа через единицу поперечного сечения потока 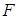 :
: 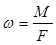 .
.
Давление 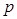 равно пределу отношения нормальной составляющей силы
равно пределу отношения нормальной составляющей силы 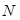 к площади
к площади 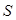 , на которую действует сила, т. е.
, на которую действует сила, т. е. 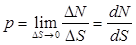 . (2.3)
. (2.3)
При равномерном распределении сил 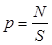 .
.
Абсолютное давление газов 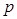 представляет собой давление газов на стенки трубопроводов и сосудов.
представляет собой давление газов на стенки трубопроводов и сосудов.
Избыточное давление газов 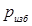 или давление вакуума
или давление вакуума 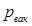 – разность между абсолютным давлением газа и барометрическим
– разность между абсолютным давлением газа и барометрическим 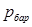 :
: 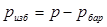 или разность между барометрическим давлением и абсолютным:
или разность между барометрическим давлением и абсолютным: 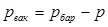 .
.
В гидравлических расчетах газопроводов используют абсолютное давление.
Вязкость газа – свойство, являющееся причиной внутреннего трения, а следовательно, и сопротивления при движении в трубопроводе. Динамическая вязкость газа 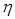
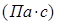 определяется главным образом количеством движения, переносимым молекулами при переходе их из одного слоя в другой.
определяется главным образом количеством движения, переносимым молекулами при переходе их из одного слоя в другой. 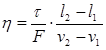 , (2.4)где
, (2.4)где 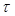 – тангенциальная сила внутреннего трения;
– тангенциальная сила внутреннего трения; 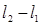 – расстояние между бесконечно тонкими слоями среды, движущимися со скоростями
– расстояние между бесконечно тонкими слоями среды, движущимися со скоростями 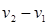 .
.
При увеличении температуры возрастает скорость движения молекул и, следовательно, переносимое количество движения. Поэтому при повышении температуры вязкость возрастает. Зависимость динамической вязкости 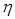 от температуры
от температуры  описывается формулой Сатерленда
описывается формулой Сатерленда 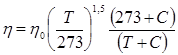 , (2.5)
, (2.5)
где 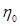 – вязкость при 273 К;
– вязкость при 273 К; 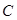 – постоянный коэффициент, зависящий от свойств газа (приложение 3).
– постоянный коэффициент, зависящий от свойств газа (приложение 3).
При гидравлических расчетах используют также кинематическую вязкость (м2/с) 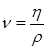 :
: 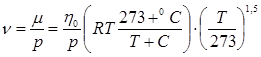 , (2.6)
, (2.6)
где 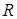 – газовая постоянная.
– газовая постоянная.
Вязкость идеальных газов не зависит от давления. Вязкость реальных газов при увеличении давления возрастает.
Термодинамические свойства газов:
Теплоемкость системы 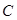 (
(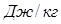 ), – отношение количества теплоты
), – отношение количества теплоты  , поглощенной газом в определенном термодинамическом процессе, к приращению температуры
, поглощенной газом в определенном термодинамическом процессе, к приращению температуры 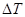 :
: 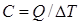 .
.
Отношение теплоемкости 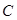 однородного тела к его массе
однородного тела к его массе 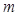 называется удельной массовой теплоемкостью
называется удельной массовой теплоемкостью 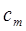
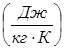 , т. е.
, т. е. 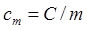 .
.
Теплоемкость реальных газов зависит от состава газа, температуры и давления.
Теплоемкость (массовая удельная) есть количество тепла, необходимое для нагревания единицы массы газа на один градус: 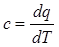 ; размерность
; размерность 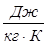 .
.
Теплоемкость зависит от природы газа и от происходящего процесса. Если газ нагревается изохорически, то подводимое тепло 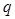 идет на увеличение внутренней энергии
идет на увеличение внутренней энергии 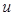 : теплоемкость при постоянном объеме
: теплоемкость при постоянном объеме 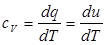 .(2.7)Если же газ нагревается изобарически, то подводимое тепло идет также и на совершение работы. Теплоемкость при постоянном давлении
.(2.7)Если же газ нагревается изобарически, то подводимое тепло идет также и на совершение работы. Теплоемкость при постоянном давлении 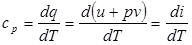 .(2.8) Функция
.(2.8) Функция 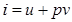 называется энтальпией (от греч. enthálpō – нагреваю). Если в данном выражении для
называется энтальпией (от греч. enthálpō – нагреваю). Если в данном выражении для 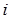 заменить
заменить 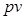 на
на 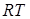 (уравнение Клайперона) и затем продиффиринцировать
(уравнение Клайперона) и затем продиффиринцировать 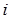 по
по  , получится формула Майера:
, получится формула Майера: 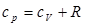 , (2.9) связывающая между собой
, (2.9) связывающая между собой 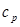 и
и 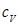 .
.
Теплопроводность определяется количеством теплоты  , проходящей через стенку площадью
, проходящей через стенку площадью  и толщиной
и толщиной 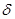 за промежуток времени
за промежуток времени 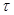 при разности температур по обе стороны стенки (
при разности температур по обе стороны стенки (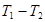 ):
): 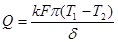 ,(2.10)где
,(2.10)где  – коэффициент теплопроводности,
– коэффициент теплопроводности, 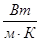 Теплота сгорания (теплотворная способность) – тепло, выделенное при сгорании единицы объема (или массы) газа в определенных условиях. Теплота сгорания определяется количеством тепла, выделившегося при охлаждении продуктов сгорания до 273 К и при конденсации образовавшейся влаги.
Теплота сгорания (теплотворная способность) – тепло, выделенное при сгорании единицы объема (или массы) газа в определенных условиях. Теплота сгорания определяется количеством тепла, выделившегося при охлаждении продуктов сгорания до 273 К и при конденсации образовавшейся влаги.
Смеси газов. Критические параметры. Газовая постоянная. Уравнение состояния реальных газов. Ван-дер-Ваальсовы силы. Коэффициент сжимаемости.
Газовые смеси: Любой природный газ – это смесь газов. Состав смеси может быть выражен в объемных, мольных и массовых долях. Объемная, мольная и массовая концентрации 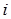 -гo компонента в смеси будут соответственно
-гo компонента в смеси будут соответственно 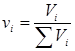 ;
; 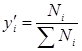 ;
; 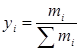 . (2.12)
. (2.12)
где 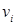 – объем
– объем 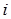 -гo компонента;
-гo компонента; 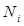 – число молей в объеме
– число молей в объеме 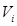 ;
; 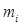 – масса
– масса 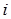 -го компонента. Учитывая, что
-го компонента. Учитывая, что 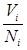 , т.е. объем одного моля, согласно закону Авогадро, для всех газов одинаковый, из выражений для
, т.е. объем одного моля, согласно закону Авогадро, для всех газов одинаковый, из выражений для 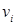 и
и 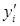 находим, что
находим, что 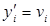 , т.е. мольные и объемные концентрации совпадают. Связь между мольной (объемной) и массовой концентрациями найдем из очевидных равенств:
, т.е. мольные и объемные концентрации совпадают. Связь между мольной (объемной) и массовой концентрациями найдем из очевидных равенств:
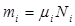 и
и 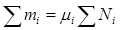 , (2.13)
, (2.13)
где 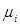 – молекулярная масса
– молекулярная масса 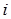 -гo компонента;
-гo компонента; 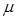 – молекулярная масса газовой смеси. Разделив первое равенство на второе, получим:
– молекулярная масса газовой смеси. Разделив первое равенство на второе, получим: 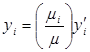 .(2.14)
.(2.14)
Отсюда, если учесть, что 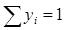 , получается формула для определения молекулярной массы газовой смеси:
, получается формула для определения молекулярной массы газовой смеси: 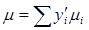 (2.15) или, поскольку
(2.15) или, поскольку 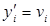 ,
, 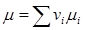 .
.
Моль единица количества вещества СИ, обозначается моль. В 1 моле содержится столько молекул (атомов, ионов и т.д.) сколько атомов содержится в 0,012 кг 12С (углерода атомной массы 12), т.е. 6,022·1023 моль –1.
По величине 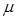 можно найти плотность газовой смеси. Из (2.12 и 2.13) следует, что
можно найти плотность газовой смеси. Из (2.12 и 2.13) следует, что 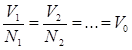 , (2.16)
, (2.16)
т.е. объем одного моля при одинаковых давлениях и температурах для всех газов одинаковый. Известно, что при 760 мм.рт.ст. и 0 °К: 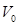 =22,42 м3/кмоль. Таким образом, плотность газовой смеси при нормальных условиях
=22,42 м3/кмоль. Таким образом, плотность газовой смеси при нормальных условиях 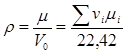 , кг/м3. (2.17) Теплоемкость
, кг/м3. (2.17) Теплоемкость 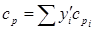
Динамическая вязкость газовой смеси 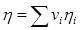 (2.18)
(2.18)
Критические параметры: Состояние газа определяется зависимостью между давлением 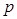 , объемом
, объемом 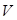 и температурой
и температурой 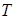 . Графически эта зависимость может быть изображена семейством изотерм (рисунок. 2.6).
. Графически эта зависимость может быть изображена семейством изотерм (рисунок. 2.6).
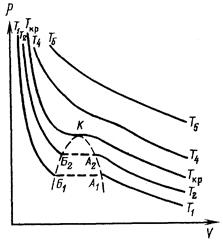
Рисунок 2.6. График
зависимости между
давлением 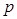 , объемом
, объемом 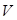
и температурой 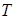 .
.
Линии ТА (T1A1, Т2А2 и т. д.) показывают изотермическое сжатие в газовой фазе. По достижении объема 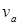 начинается конденсация. Горизонтальные участки A1Б1, A2Б2 характеризуют двухфазное состояние. В точках Б1, Б2 конденсация заканчивается; очень крутые ветви Б1Т1, Б2Т2 относятся к жидкой фазе. С увеличением температуры участок двухфазного состояния сокращается. Температура Ткр, при которой линии A1Б1 и А2Б2 сливаются в точку К, называется критической. Давление рк р, объем Vкр и плотность ρкр, соответствующие точке К, тоже называются критическими. Когда газ при постоянной температуре Ткр будет сжат до объема Vкр (при этом давление будет равно ркр), его плотность достигнет плотности жидкости. Газ нельзя будет отличить от жидкости. Однородность вещества при этом не нарушится. Но малейшее уменьшение температуры вызовет расслоение на жидкую и газовую фазы. При температуре выше критической газ не переходит в жидкость ни при каких давлениях.
начинается конденсация. Горизонтальные участки A1Б1, A2Б2 характеризуют двухфазное состояние. В точках Б1, Б2 конденсация заканчивается; очень крутые ветви Б1Т1, Б2Т2 относятся к жидкой фазе. С увеличением температуры участок двухфазного состояния сокращается. Температура Ткр, при которой линии A1Б1 и А2Б2 сливаются в точку К, называется критической. Давление рк р, объем Vкр и плотность ρкр, соответствующие точке К, тоже называются критическими. Когда газ при постоянной температуре Ткр будет сжат до объема Vкр (при этом давление будет равно ркр), его плотность достигнет плотности жидкости. Газ нельзя будет отличить от жидкости. Однородность вещества при этом не нарушится. Но малейшее уменьшение температуры вызовет расслоение на жидкую и газовую фазы. При температуре выше критической газ не переходит в жидкость ни при каких давлениях.
Критической температурой называют такую температуру, выше которой при любом давлении нельзя сконденсировать, пар (перевести в жидкое состояние).
Критическим давлением называют такое давление, выше которого нельзя испарить жидкость при любом повышении температуры.
Коэффициент сжимаемости: Законы идеального газа не дают существенных ошибок лишь при небольших давлениях. При давлениях и температурах, обычных для магистральных газопроводов, заметное влияние на зависимость между 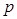 ,
,  и
и 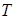 оказывают Ван-дер-Ваальсовы силы: природный газ сжимается больше, чем это следует для идеального газа (силы притяжения между молекулами превосходят силы отталкивания). Эффект «сверхсжимаемости» усиливается при понижении температуры. В таких случаях уравнение состояния должно учитывать реальное поведение газа.
оказывают Ван-дер-Ваальсовы силы: природный газ сжимается больше, чем это следует для идеального газа (силы притяжения между молекулами превосходят силы отталкивания). Эффект «сверхсжимаемости» усиливается при понижении температуры. В таких случаях уравнение состояния должно учитывать реальное поведение газа.
Существует очень много уравнений состояния для реальных газов. Но использование их при расчетах газопроводов почти всегда приводит к весьма громоздким выкладкам. Поэтому обычно пользуются скорректированным уравнением Клапейрона: 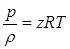 (2.24) в котором отклонения от законов идеального газа учитываются множителем
(2.24) в котором отклонения от законов идеального газа учитываются множителем 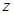 , называемым коэффициентом сжимаемости (или сверхсжимаемости, это точнее). Коэффициент
, называемым коэффициентом сжимаемости (или сверхсжимаемости, это точнее). Коэффициент 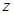 зависит от давления и температуры. При обычных для магистральных газопроводов условиях
зависит от давления и температуры. При обычных для магистральных газопроводов условиях 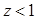 (сверхсжимаемость). Коэффициент сжимаемости зависит от состава газа: чем газ тяжелее, тем
(сверхсжимаемость). Коэффициент сжимаемости зависит от состава газа: чем газ тяжелее, тем 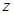 меньше. Однако если
меньше. Однако если 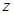 взять в зависимости от
взять в зависимости от 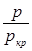 и
и 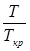 , то влияние состава газа исчезает (закон соответственных состояний). Безразмерные давление и температура
, то влияние состава газа исчезает (закон соответственных состояний). Безразмерные давление и температура 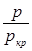 и
и 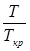 называются приведенными (
называются приведенными (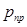 и
и 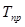 ). Для смеси газов они берутся по отношению к средним критическим давлению и температуре, которые определяются по формулам
). Для смеси газов они берутся по отношению к средним критическим давлению и температуре, которые определяются по формулам 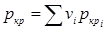 и
и 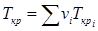 .(2.25)
.(2.25)
Коэффициент сжимаемости газа любого состава можно определять по графику 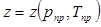 . В нормах технологического проектирования рекомендована следующая формула:
. В нормах технологического проектирования рекомендована следующая формула: 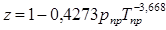 (2.26)
(2.26)
Уравнение состояния: Аналитическая зависимость между р, V и Т (уравнение состояния) наиболее простой вид имеет для идеального газа, т. е. для газа, подчиняющегося законам Гей-Люссака и Бойля-Мариотта. Представим себе некоторое количество газа при состоянии 1 и такое же количество газа при состоянии 2 (рисунок 2.7, точки 1 и 2).
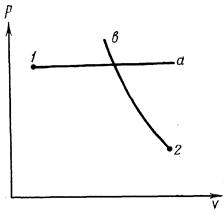
Рисунок 2.7. График изобарического 1-а и изотермического 2-b процессов.
Газ, находящийся в состоянии 1, начнем нагревать, сохраняя давление p1 неизменным. Газ будет расширяться и, согласно закону Гей-Люссака, его объем при температуре Т2 будет 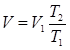 . Газ, находящийся в состоянии 2, будем сжимать при постоянной температуре Т2. Когда давление окажется равным p1, в соответствии с законом Бойля-Мариотта будем иметь
. Газ, находящийся в состоянии 2, будем сжимать при постоянной температуре Т2. Когда давление окажется равным p1, в соответствии с законом Бойля-Мариотта будем иметь 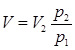 . Поскольку в обоих случаях V – одна и та же величина (на рис. 5.2 она соответствует точке пересечения изобары 1-а и изотермы 2-в), получим
. Поскольку в обоих случаях V – одна и та же величина (на рис. 5.2 она соответствует точке пересечения изобары 1-а и изотермы 2-в), получим 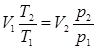 и далее
и далее 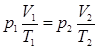 или
или 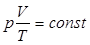 . Постоянная величина зависит от количества газа, содержащегося в объеме
. Постоянная величина зависит от количества газа, содержащегося в объеме 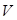 , и от его физической природы. Если взять один моль газа, то, поскольку объем его V для всех газов один и тот же, одинаковой для всех газов будет и величина
, и от его физической природы. Если взять один моль газа, то, поскольку объем его V для всех газов один и тот же, одинаковой для всех газов будет и величина 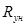 . Это – универсальная газовая постоянная. Так получается уравнение состояния для одного моля идеального газа (уравнение Клапейрона, позволяющее определять плотность газа при известных давлениях и температуре )
. Это – универсальная газовая постоянная. Так получается уравнение состояния для одного моля идеального газа (уравнение Клапейрона, позволяющее определять плотность газа при известных давлениях и температуре ) 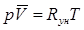 (2.21)
(2.21)
Физический смысл универсальной газовой постоянной 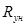 – работа изобарического расширения одного моля газа при нагревании его на один градус.
– работа изобарического расширения одного моля газа при нагревании его на один градус.
Подставив в (2.14) значения 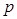 ,
, 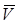 и Т, соответствующие нормальным условиям, т.е.
и Т, соответствующие нормальным условиям, т.е. 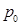 = 101 325 Па,
= 101 325 Па, 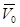 = 22,4135 м3/кмоль и
= 22,4135 м3/кмоль и  = 273,15 К, получим, что
= 273,15 К, получим, что 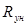 =8314
=8314 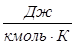 .
.
Если разделить (2.14) на молекулярную массу 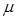 , то получим уравнение состояния для единицы массы газа. Поскольку
, то получим уравнение состояния для единицы массы газа. Поскольку 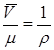 , это уравнение будет иметь вид
, это уравнение будет иметь вид 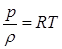 (2.22) где
(2.22) где 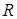 – газовая постоянная для единицы массы газа,
– газовая постоянная для единицы массы газа, 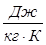 .
.
Физический смысл 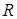 аналогичен физическому смыслу
аналогичен физическому смыслу 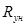 . В отличие от
. В отличие от 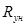 численное значение
численное значение 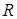 зависит от состава газа. Таким образом, наряду с молекулярной массой
зависит от состава газа. Таким образом, наряду с молекулярной массой 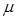 газовая постоянная
газовая постоянная 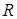 есть параметр, характеризующий физическую природу газа. К таким параметрам относятся также плотность газа
есть параметр, характеризующий физическую природу газа. К таким параметрам относятся также плотность газа  (при стандартных или нормальных условиях) и относительная плотность по воздуху
(при стандартных или нормальных условиях) и относительная плотность по воздуху 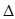 .
.
Молекулярную массу определяют, как уже было сказано, по составу газа: 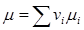 ; остальные упомянутые параметры – по формулам
; остальные упомянутые параметры – по формулам 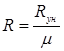 ;
; 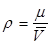 ;
; 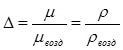 .
.