Лабораторная работа № 26
Уравнение состояния идеального газа
Цель работы:
Экспериментальное изучение законов идеального газа на примере воздуха. Исследование изотермического, изохорного и изобарного процессов. Определение универсальной газовой постоянной, температурных коэффициентов давления и объёмного расширения.
Оборудование:
Установка, включающая в себя газовый шприц в стеклянном корпусе, нагреватель, датчик давления, датчик температуры, блок управления Cobra-3, компьютер.
Продолжительность работы – 4 часа.
Теоретическая часть
Опыт показывает, что в состоянии термодинамического равновесия объём  , давление
, давление 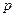 , температура
, температура  любых газов, а также однородных и изотропных тел в других агрегатных состояниях находятся в функциональной зависимости. Эта зависимость называется уравнением состояния. В условиях равновесия уравнение состояния связано с макроскопической системой в целом, и его можно записывать в интегральной форме. Уравнение состояния нельзя вывести теоретически исходя только из общих принципов термодинамики. Его получают либо эмпирически из опыта, либо используя методы статистической физики.
любых газов, а также однородных и изотропных тел в других агрегатных состояниях находятся в функциональной зависимости. Эта зависимость называется уравнением состояния. В условиях равновесия уравнение состояния связано с макроскопической системой в целом, и его можно записывать в интегральной форме. Уравнение состояния нельзя вывести теоретически исходя только из общих принципов термодинамики. Его получают либо эмпирически из опыта, либо используя методы статистической физики.
Многие газы и их смеси, находящиеся при давлении близком к нормальному[1], обладают свойствами идеального газа. Идеальным называется газ, уравнение состояния которого имеет вид
 , (1)
, (1)
где  – число молей газа[2],
– число молей газа[2],  Дж/(моль*К) – универсальная газовая постоянная. Уравнение (1) называют уравнением Клайперона-Менделеева. Все другие газы называются реальными.
Дж/(моль*К) – универсальная газовая постоянная. Уравнение (1) называют уравнением Клайперона-Менделеева. Все другие газы называются реальными.
Константа  имеет следующий смысл. Согласно закону Авогадро в одинаковых объёмах идеальных газов при одинаковых температурах и давлении содержится одно и то же число молекул[3]. То есть для одного количества разных идеальных газов, находящихся при одинаковой температуре, произведение
имеет следующий смысл. Согласно закону Авогадро в одинаковых объёмах идеальных газов при одинаковых температурах и давлении содержится одно и то же число молекул[3]. То есть для одного количества разных идеальных газов, находящихся при одинаковой температуре, произведение  будет одинаковым. Константа
будет одинаковым. Константа  – это число, которое определяется для одного моля соотношением
– это число, которое определяется для одного моля соотношением
 . (2)
. (2)
Ввиду закона Авогадро  является одинаковой для разных идеальных газов. Идеальный газ – это модель, используемая для описания различных газов при определённых условиях. Любой газ, находящийся в условиях, близких к нормальным, а также газ при низких давлениях или высоких температурах, близок по своим свойствам к идеальному газу.
является одинаковой для разных идеальных газов. Идеальный газ – это модель, используемая для описания различных газов при определённых условиях. Любой газ, находящийся в условиях, близких к нормальным, а также газ при низких давлениях или высоких температурах, близок по своим свойствам к идеальному газу.
Иная форма уравнения состояния идеального газа (1) может быть представлена, как
 , (3)
, (3)
где  – концентрация его молекул,
– концентрация его молекул,  Дж/К – постоянная Больцмана. Из (3) следует, что давление идеального газа не зависит от его природы и однозначно определяется температурой и концентрацией.
Дж/К – постоянная Больцмана. Из (3) следует, что давление идеального газа не зависит от его природы и однозначно определяется температурой и концентрацией.
Сопоставив уравнение (3) с основным уравнением молекулярно-кинетической теории
 , (4)
, (4)
где  – средняя кинетическая энергия поступательного движения молекулы,
– средняя кинетическая энергия поступательного движения молекулы,  – масса молекулы,
– масса молекулы,  – среднее значение квадрата её скорости, получим для идеального газа выражение зависимости
– среднее значение квадрата её скорости, получим для идеального газа выражение зависимости  от термодинамической температуры:
от термодинамической температуры:
 . (5)
. (5)
Тепловой формой движения материи называют хаотическое движение молекул макроскопических систем. Уравнение (5) показывает, что температура характеризует это движение. Температура – это одна из макроскопических характеристик внутреннего состояния термодинамической системы. Температура зависит только от внутреннего состояния. Величина  – это кинетическая энергия хаотического, теплового движения молекулы. Её значение будет тем больше, чем больше температура газа.
– это кинетическая энергия хаотического, теплового движения молекулы. Её значение будет тем больше, чем больше температура газа.
С помощью, например, изменения внешних условий можно макросистему перевести в другое равновесное состояние. Переход из одного состояния в другое всегда связан с нарушением равновесия. Если внешние условия изменяются так медленно, что система проходит через последовательность состояний равновесия, то этот процесс называют квазиравновесным (почти равновесным). Для описания мгновенного состояния системы, совершающей квазиравновесный процесс, требуется столько же параметров, сколько и для макроскопического описания равновесного состояния. То есть уравнения состояния (1) и (3) можно использовать для анализа всего квазиравновесного процесса.
Процесс, при протекании которого один из параметров состояния остаётся постоянным, называется изопроцессом: изотермический при  , изохорный при
, изохорный при  и изобарный при
и изобарный при  . Уравнения (1), (3), (4), (5) позволяют объяснить, что будет происходить в этих процессах. При изотермическом расширении кинетическая энергия молекул не изменяется. Однако, в результате уменьшения концентрации молекул давление будет уменьшается. В процессе изохорного нагревания газу передаётся энергия окружающими телами. Энергия
. Уравнения (1), (3), (4), (5) позволяют объяснить, что будет происходить в этих процессах. При изотермическом расширении кинетическая энергия молекул не изменяется. Однако, в результате уменьшения концентрации молекул давление будет уменьшается. В процессе изохорного нагревания газу передаётся энергия окружающими телами. Энергия  увеличивается. Поскольку объём газа остаётся постоянным, то концентрация молекул также не будет меняться. Поэтому, согласно (4), при изохорном нагревании давление будет расти. При изобарном нагревании расширение газа происходит при непрерывном увеличении температуры. При этом кинетическая энергия
увеличивается. Поскольку объём газа остаётся постоянным, то концентрация молекул также не будет меняться. Поэтому, согласно (4), при изохорном нагревании давление будет расти. При изобарном нагревании расширение газа происходит при непрерывном увеличении температуры. При этом кинетическая энергия  возрастает. Однако, концентрация молекул уменьшается вследствие увеличения объёма, в результате давление остаётся постоянным.
возрастает. Однако, концентрация молекул уменьшается вследствие увеличения объёма, в результате давление остаётся постоянным.
В изохорном процессе давление есть функция только температуры  . Такой процесс характеризуется температурным коэффициентом давления:
. Такой процесс характеризуется температурным коэффициентом давления:
 , (6)
, (6)

|
| Рис. 1. Экспериментальная установка для проведения изопроцессов. |
где  – давление при нормальных условиях, а индекс
– давление при нормальных условиях, а индекс  у производной показывает, что она берется при
у производной показывает, что она берется при  . Величина
. Величина  численно равна относительному изменению давления при изменении температуры на один градус в условиях неизменного объёма. Аналогично, в изобарном процессе объём есть функция только температуры
численно равна относительному изменению давления при изменении температуры на один градус в условиях неизменного объёма. Аналогично, в изобарном процессе объём есть функция только температуры  . Такой процесс характеризуется температурным коэффициентом объёмного расширения:
. Такой процесс характеризуется температурным коэффициентом объёмного расширения:
 , (7)
, (7)
который численно равен относительному изменению объёма при изменении температуры на один градус в условиях неизменного давления,  – объем
– объем  молей газа при нормальных условиях. Обе величины
молей газа при нормальных условиях. Обе величины  и
и  измеряются в градусах в минус первой степени. Экспериментально установлено, что для идеальных газов
измеряются в градусах в минус первой степени. Экспериментально установлено, что для идеальных газов
 . (8)
. (8)
Физический закон равенства  и
и  для идеальных газов (8) называют законом Гей-Люссака.
для идеальных газов (8) называют законом Гей-Люссака.
Описание установки
Экспериментальная установка для проведения изопроцессов показана на рис. 1. Объектом исследования является воздух внутри газового шприца 1 объёмом 100 мл. Объём воздуха ограничен поршнем 2. Шприц находится внутри стеклянного корпуса 3. Пространство между шприцом и стенками корпуса заполняют водой. Температуру воды можно изменять с помощью нагревателя 4, расположенного под нижней частью стеклянного корпуса 3. При нагреве воду перемешивают магнитной мешалкой 5, обеспечивая таким образом равномерный прогрев воздуха в шприце. Давление воздуха контролирует датчик 6. Датчик давления 6 соединён со шприцом посредством короткой трубки-переходника. В специальное отверстие в верхней части корпуса 3 помещают полупроводниковый датчик температуры 7. Нижняя часть датчика 7 должна быть погружена в воду. Датчик давления 6 подключают ко входу S1, а датчик температуры 7 ко входу S2 электронного блока Cobra-3 (8). Блок 8 является универсальным интерфейсом для контроля, измерения и обработки результатов эксперимента. Это устройство через информационный кабель 9 передаёт в компьютер показания датчиков.
Изотермический процесс проводится при комнатной температуре. В этом исследовании вручную изменяют объём воздуха в шприце, перемещая поршень 2. Значение объёма  можно определить по шкале, нанесённой на шприц. Текущее значение давления
можно определить по шкале, нанесённой на шприц. Текущее значение давления  измеряется датчиком 6.
измеряется датчиком 6.
При изохорном процессе нагревают воду, находящуюся в стеклянном корпусе 3. Если скорость нагрева не велика, температура воздуха в шприце равна температуре воды. При нагревании поршень будет перемещаться, чтобы выровнялись давления воздуха снаружи и внутри шприца. После повышения температуры на заданную величину поршень нужно вернуть в исходное положение и, удерживая его, зафиксировать значения давления и температуры.
При изобарном процессе измеряется зависимость объёма воздуха от температуры при атмосферном давлении. Для этого в процессе нагревания в шприце вручную устанавливается объём, который требует программа в очередном цикле измерений. Значение температуры сохраняется в тот момент, когда датчик давления фиксирует равенство давления воздуха внутри шприца атмосферному давлению.
Экспериментальная часть
Подготовка к работе.
1. До начала любого изопроцесса необходимо настроить программу «Measure »:
1.1. Убедитесь, что экспериментальная установка соответствует рис. 1. Проверьте, чтобы датчик температуры был частично погружён в воду. Если это не так, позовите инженера.
1.2. Включите компьютер. Запустите программу «Measure ».
1.3. Выберите «Прибор » −> «Кобра3 Идеальный газ ». Появится окно, показанное на рис. 2а.
1.4. При изотермическом процессе проверьте соответствие окна на экране монитора рисунку 2а. При необходимости измените настройки[4].
1.5. Во вкладке «Начало/Конец » выберите «нажатием клавиши ».
1.6. Во вкладке «Другие установки » (рис. 2б) определяется характер и объём информации, которая будет выводиться на экран в процессе эксперимента. При установке флажка в поле «Цифр. дисплей 1 »(рис. 2б) появится окно «Параметры дисплея » (рис. 3а). Если флажок уже установлен, необходимо его снять и снова поставить. Выберите «Давление р » в качестве канала для «Цифр. дисплея 1 » (рис. 3а). Аналогично настройте «Цифр. дисплей 2 » для вывода «Температуры Т » и «Цифр. дисплей 3 » для вывода «Объёма V ». Отметьте флажком поле «Диаграмма 1 » (рис. 2б). На экране появится окно настройки графиков, которые будут выводиться в процессе эксперимента (рис. 3б). Установите пределы  ,
,  и «ось х » в соответствии с рис. 3б и подтвердите выбор, нажав кнопку «Да ».
и «ось х » в соответствии с рис. 3б и подтвердите выбор, нажав кнопку «Да ».
1.7. Во вкладке «Калибровать » необходимо откалибровать датчики давления и температуры по значениям лабораторного барометра и термометра. Для калибровки датчика давления определите по лабораторному барометру атмосферное давление  . Введите в соответствующее поле
. Введите в соответствующее поле
| 
|
| а | б |
| Рис. 2. Окна вкладок «Каналы» (а) при изотермическом процессе и «Другие установки» (б) для настройки программы «Measure». |

| 
|
| а | б |
| Рис. 3. Окна настроек «Цифр. дисплея» (а) и «Диаграммы» (б). |
вкладки «Калибровать » значение  в гектопаскалях (1 гПа = 1 hPa = 100 Па). Вручную, плавно перемещая поршень, установите такой объём шприца, чтобы давление воздуха в нём стало примерно равно атмосферному. Нажмите кнопку «Калибровать ». Для калибровки датчика температуры достаньте датчик 7 из стеклянного корпуса 3 (рис. 1). Дождитесь, чтобы температура датчика сравнялась с комнатной. Определите комнатную температуру
в гектопаскалях (1 гПа = 1 hPa = 100 Па). Вручную, плавно перемещая поршень, установите такой объём шприца, чтобы давление воздуха в нём стало примерно равно атмосферному. Нажмите кнопку «Калибровать ». Для калибровки датчика температуры достаньте датчик 7 из стеклянного корпуса 3 (рис. 1). Дождитесь, чтобы температура датчика сравнялась с комнатной. Определите комнатную температуру  по лабораторному термометру и введите её значение в градусах Кельвина в соответствующее поле вкладки «Калибровать ». Нажмите кнопку «Калибровать ». Поместите датчик 7 обратно в стеклянный корпус 3.
по лабораторному термометру и введите её значение в градусах Кельвина в соответствующее поле вкладки «Калибровать ». Нажмите кнопку «Калибровать ». Поместите датчик 7 обратно в стеклянный корпус 3.
1.8. Нажмите «Далее » (рис. 2). На экране появится окно контроля параметров воздуха в процессе эксперимента (рис. 4).
2. Определение погрешности измерения объёма, давления и температуры.
Погрешность объёма определяется толщиной риски на поршне шприца. Рекомендуется считать, что  мл. Погрешность давления и температуры зависит как от погрешности
мл. Погрешность давления и температуры зависит как от погрешности
 
| 
|
| Рис. 4. Окно измерений вначале проведения эксперимента. | Рис. 5. Окно «Управление каналами». |
калибровочных значений  ,
,  , так и от погрешности соответствующих датчиков. Убедитесь, что погрешности калибровочных значений давления и температуры равны
, так и от погрешности соответствующих датчиков. Убедитесь, что погрешности калибровочных значений давления и температуры равны  гПа и
гПа и  К. По данным производителя погрешность датчиков
К. По данным производителя погрешность датчиков  гПа и
гПа и  К[5]. В итоге
К[5]. В итоге  гПа, и
гПа, и  К. Запишите значения
К. Запишите значения  ,
,  и
и  в тетрадь.
в тетрадь.
3. Определение числа молей воздуха в шприце.
При проведении эксперимента количество воздуха в шприце остается неизменным. В соответствии с уравнением (2) макропараметры текущего состояния  молей идеального газа (
молей идеального газа ( ) и состояния того же количества газа, находящегося в нормальных условиях (
) и состояния того же количества газа, находящегося в нормальных условиях ( ) (см. примечания 1 и 3 на стр. 1), связаны между собой уравнением:
) (см. примечания 1 и 3 на стр. 1), связаны между собой уравнением:
 ,
,
Следовательно, число молей воздуха равно
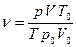 .
.
Определите по шкале, нанесённой на шприц, текущее значение объёма воздуха, а по показаниям соответствующих датчиков значения 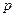 и
и  . Рассчитайте число молей воздуха. Зная
. Рассчитайте число молей воздуха. Зная  ,
,  и
и  определите
определите  – погрешность числа молей. Все вычисления необходимо проводить в международной системе единиц (СИ). Например, 1 мл = 10-3 л = 10-6 м3.
– погрешность числа молей. Все вычисления необходимо проводить в международной системе единиц (СИ). Например, 1 мл = 10-3 л = 10-6 м3.
Упражнение 1. Изотермический процесс.
1. Выполните все пункты раздела «Подготовка к работе» (см. выше).
2. Проведение изотермического процесса.
2.1. В окне «Объём V » отображается значение объёма, при котором надо сделать первое измерение. Переместите вращательным движением поршень шприца, чтобы установить соответствующий объём. Сделайте первое измерение: удерживая поршень, в окне«Измерение » нажмите на кнопку «Сохранить значение ». Программа «Measure» запомнит текущие показания датчиков давления и температуры, а также объём.
2.2. В окне «Объём V » появится значение объёма, при котором нужно провести следующее измерение. Переместите поршень шприца вправо до этого объёма. Давление воздуха в шприце изменится. Измерьте новые давление и температуру, нажав кнопку «Сохранить значение ».
2.3. Постепенно увеличивайте объём воздуха в шприце. Сохраняйте результаты измерения, нажимая кнопку «Сохранить значение ». Измеренные значения макропараметров автоматически будут отображаться на графике в соответствующем окне в зависимости от номера измерения. Сделайте 10÷15 измерений. По окончании отпустите поршень.
2.4. В окне «Измерения » нажмите кнопку «Закрыть ». На экране появится окно с графиками зависимостей  от номера измерений.
от номера измерений.
3. Определение универсальной газовой постоянной.
Как следует из уравнения состояния идеального газа (1), в изотермическом процессе давление будет линейно зависеть от величины  :
:
 ,
,
где  − угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту
− угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту  можно найти универсальную газовую постоянную
можно найти универсальную газовую постоянную  .
.
По экспериментально измеренным значениям давления и объёма постройте в программе «Measure» график  . Выберите пункт меню «Измерение » −> «Управление каналами » (рис. 5).Щелчком мыши выберете поле («ось x »; «Адресат »). Затем в поле («ось y »; «Источник ») выделите мышью
. Выберите пункт меню «Измерение » −> «Управление каналами » (рис. 5).Щелчком мыши выберете поле («ось x »; «Адресат »). Затем в поле («ось y »; «Источник ») выделите мышью  и нажмите кнопку «→ ». В результате величина
и нажмите кнопку «→ ». В результате величина  станет аргументом будущего графика. Далее в поле («ось y »; «Источник ») выделите «Давление
станет аргументом будущего графика. Далее в поле («ось y »; «Источник ») выделите «Давление 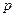 » и кнопкой «→ » определите давление как ординату создаваемого графика. Нажмите «Да », появится служебное окно, снова нажмите «Да », на экране отобразится график зависимости
» и кнопкой «→ » определите давление как ординату создаваемого графика. Нажмите «Да », появится служебное окно, снова нажмите «Да », на экране отобразится график зависимости  (рис. 6).
(рис. 6).
По умолчанию программа «Measure» исследуемый график в промежутке между измеренными точками интерполирует линейной функцией. Поэтому график  на экране монитора будет представлять ломаную линию (рис. 6.). Отобразите на экране экспериментально измеренные точки. На панели инструментов нажмите кнопку Параметры дисплея (рис. 6). В открывшемся окне, в пункте Символы, выберите символ ●и нажмите «Да ». На графике местоположения этого символа будет соответствовать измеренным значениям
на экране монитора будет представлять ломаную линию (рис. 6.). Отобразите на экране экспериментально измеренные точки. На панели инструментов нажмите кнопку Параметры дисплея (рис. 6). В открывшемся окне, в пункте Символы, выберите символ ●и нажмите «Да ». На графике местоположения этого символа будет соответствовать измеренным значениям 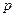 и
и  .
.
В программе «Measure» реализована возможность аппроксимации дискретного множества измеренных величин линейной функцией. На панели инструментов нажмите кнопку Регрессия. На экране появится аппроксимирующая прямая и её уравнение (рис. 6). Передвигая мышью символ «■», выберите наиболее подходящую область аппроксимации. Запишите получившееся уравнение в тетрадь.
Определите  Па*м3. Угловой коэффициент
Па*м3. Угловой коэффициент  можно найти, построив на
можно найти, построив на

  
 
| ||||||||
Рис. 6. Зависимости 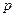 от от  и аппроксимирующая прямая. и аппроксимирующая прямая.
|
миллиметровой бумаге график  . Однако, для «полуавтоматического» расчёта
. Однако, для «полуавтоматического» расчёта  возможно воспользоваться методикой, описанной в приложении к данной работе.
возможно воспользоваться методикой, описанной в приложении к данной работе.
Сравните  с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная
с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная  , определите универсальную газовую постоянную. При расчёте
, определите универсальную газовую постоянную. При расчёте 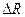 учтите не только
учтите не только  , но также погрешности числа молей
, но также погрешности числа молей  и температуры
и температуры  .
.
Упражнение 2. Изохорный процесс[6].
1. Настройка программы «Measure »:
1.1. Закройте и запустите заново программу «Measure». В открывшемся окне, в пункте меню «Прибор », выберите«Кобра3 Идеальный газ ».
1.2. Должно появиться окно вкладки «Каналы » для настройки конкретного процесса (рис. 2а). При проведении изохорного процесса изменяются давление и температура. Объём необходимо поддерживать постоянным. Поэтому в поле «V » −> «Источник » выберете «постоян. ». Задайте «Постоян. объём » равным 50 мл.
1.3. Нажмите «Далее ». Программа «Measure» настроена для проведения изохорного процесса.
2. Проведение изохорного процесса.
2.1. Сделайте первое измерение: перемещая вращательным движением поршень шприца, доводите объем в шприце до 50 миллилитров, в окне «Измерение » нажмите на кнопку «Сохранить значение ».
2.2. Включите нагреватель (рис. 1)[7]. В процессе нагрева не забывайте перемешивать воду в стеклянном корпусе с помощью магнитной мешалки.
2.3. После каждого увеличения температуры на  К доводите объем в шприце до 50 миллилитров, перемещая поршень вращательным движением. Сохраняйте результаты измерения давления и температуры, нажимая кнопку «Сохранить значения ».
К доводите объем в шприце до 50 миллилитров, перемещая поршень вращательным движением. Сохраняйте результаты измерения давления и температуры, нажимая кнопку «Сохранить значения ».
2.4. При температуре порядка 360 К выключите нагреватель.
2.5. В окне «Измерения »нажмите кнопку «Закрыть ». На экране появится окно с графиками зависимостей  от номера измерения.
от номера измерения.
3. Определение универсальной газовой постоянной и температурного коэффициента давления.
Как следует из уравнения состояния идеального газа (1), в изохорном процессе давление будет линейно зависеть от температуры:
 ,
,
где  − угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту
− угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту  можно найти универсальную газовую постоянную
можно найти универсальную газовую постоянную  и температурный коэффициент давления
и температурный коэффициент давления  .
.
Используя программу «Measure» постройте график зависимости 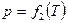 по методике, приведённой в упражнении 1. Отобразите на экране экспериментальные точки. На панели инструментов нажмите кнопку Регрессия. На экране появится аппроксимирующая прямая, а также её уравнение. Запишите уравнение в тетрадь. Определите
по методике, приведённой в упражнении 1. Отобразите на экране экспериментальные точки. На панели инструментов нажмите кнопку Регрессия. На экране появится аппроксимирующая прямая, а также её уравнение. Запишите уравнение в тетрадь. Определите  Па/К.
Па/К.
Сравните  с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная
с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная  , определите универсальную газовую постоянную и погрешность этой величины. Сравните значение универсальной газовой постоянной, полученной в первом и втором упражнениях.
, определите универсальную газовую постоянную и погрешность этой величины. Сравните значение универсальной газовой постоянной, полученной в первом и втором упражнениях.
Из (1) и (6) следует, что температурный коэффициент давления  связан с
связан с  соотношением
соотношением  , где
, где  Па (см. примечание 1 на стр. 1). Рассчитайте
Па (см. примечание 1 на стр. 1). Рассчитайте  и сравните его со значением, приведенным в теоретической части (8).
и сравните его со значением, приведенным в теоретической части (8).
Упражнение 3. Изобарный процесс.
1. Настройка программы «Measure »:
1.1. Закройте и запустите заново программу «Measure». В открывшемся окне, в пункте меню «Прибор », выберите«Кобра3 Идеальный газ ».
1.2. Должно появиться окно вкладки «Каналы » для настройки конкретного процесса (рис. 2а). При проведении изобарного процесса давление постоянно, изменяются объём и температура. Проверьте соответствие окна на экране монитора рисунку 2а. Настройки должны быть такие же как при проведении изотермического процесса, исключая величину «Начального объема ». Для определения этого значения установите такой объём, чтобы давление воздуха в шприце стало примерно равно атмосферному. Определите значение получившегося объёма и зафиксируйте эту величину в поле «Начальный объём » (рис. 2а).
1.3. Нажмите «Далее ». Программа «Measure» настроена для проведения изобарного процесса.
2. Проведение изобарного процесса.
2.1 Сделайте первое измерение: в окне «Измерение » нажмите на кнопку «Сохранить значение ». Программа «Measure» сохранит текущие значения параметров  и
и  . В окне «Объём V » появится следующее значения объёма, при котором нужно провести очередное измерение.
. В окне «Объём V » появится следующее значения объёма, при котором нужно провести очередное измерение.
2.2. Запишите в тетрадь показание датчика давления.
2.3. Включите нагреватель[8]. В процессе эксперимента не забывайте перемешивать воду в стеклянном корпусе с помощью магнитной мешалки. Вручную перемещая поршень, установите величину объёма равную значению, заданному в окне «Объём V ».
2.4. Нажмите кнопку «Сохранить значение », когда показание датчика давления станет равно требуемой величине (т.е. величине, записанной в тетрадь в пункте 2.2). Возможно, что перед этим потребуется дополнительная регулировка положения поршня.
2.5. Следя за увеличением объёма воздуха в шприце, сохраняйте результаты измерения. Результаты измерений автоматически будут отображаться на графике в соответствующем окне.
2.6. После достижения температуры 360 К выключите нагреватель.
2.7. В окне «Измерения » нажмите кнопку «Закрыть ». На экране появится окно с графиками зависимостей  от номера измерения.
от номера измерения.
3. Определение универсальной газовой постоянной и температурного коэффициента объёмного расширения.
Как следует из уравнения состояния идеального газа (1), в изобарном процессе объём будет линейно зависеть от температуры:
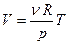 ,
,
где  − угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту
− угловой коэффициент приведённой линейной функции. По известному угловому коэффициенту  можно найти универсальную газовую постоянную
можно найти универсальную газовую постоянную  и температурный коэффициент объёмного расширения
и температурный коэффициент объёмного расширения  .
.
Как и в первом упражнении, постройте в программе «Measure» график зависимости 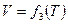 . Отобразите на экране экспериментальные точки. На панели инструментов нажмите кнопку «Регрессия ». На экране появится аппроксимирующая прямая, а также её уравнение. Запишите уравнение в тетрадь. Определите
. Отобразите на экране экспериментальные точки. На панели инструментов нажмите кнопку «Регрессия ». На экране появится аппроксимирующая прямая, а также её уравнение. Запишите уравнение в тетрадь. Определите  м3/К.
м3/К.
Сравните  с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная
с угловым коэффициентом аппроксимирующей прямой, которую построила программа «Measure». Зная  , определите универсальную газовую постоянную и погрешность этой величины. Сравните значение универсальной газовой постоянной, полученной в первом и третьем упражнениях.
, определите универсальную газовую постоянную и погрешность этой величины. Сравните значение универсальной газовой постоянной, полученной в первом и третьем упражнениях.
Из (1) и (7) следует, что температурный коэффициент объёмного расширения  связан с
связан с  уравнением
уравнением  , где
, где  м3 (см.примечание 3 на стр. 1) – объём воздуха в шприце при нормальных условиях. Рассчитайте
м3 (см.примечание 3 на стр. 1) – объём воздуха в шприце при нормальных условиях. Рассчитайте  , и сравните его с теоретическим значением, определенным в формуле (8).
, и сравните его с теоретическим значением, определенным в формуле (8).
Подготовка к работе
1. Физические понятия, величины, законы, знание которых необходимо для успешного выполнения работы:
ü макроскопические и микроскопические параметры;
ü давление, основное уравнение молекулярно-кинетической теории;
ü тепловое движение атомов и молекул, температура, измерение температуры;
ü количество вещества, закон Авогадро;
ü состояние термодинамической системы, уравнение состояния;
ü термодинамическое равновесие, квазиравновесный и неравновесный процесс;
ü идеальный газ, уравнение Менделеева-Клапейрона;
ü изопроцессы;
ü реальный газ, уравнение Ван-дер-Ваальса.
2. Покажите в рабочей тетради как связаны друг с другом уравнения (1) и (3).
3. Расчетное задание.
ü Рассчитайте число молей воздуха  , если известно, что
, если известно, что  мл,
мл,  Па,
Па,  К, где
К, где  – номер бригады,
– номер бригады,  – номер студента по алфавиту в бригаде.
– номер студента по алфавиту в бригаде.
ü В объёме  мл при температуре
мл при температуре  К находится
К находится  молей азота. Значение
молей азота. Значение  возьмите из предыдущего расчёта. Считая азот в заданных условиях идеальным газом, определите его давление
возьмите из предыдущего расчёта. Считая азот в заданных условиях идеальным газом, определите его давление  . Также определите реальное давление азота
. Также определите реальное давление азота  . Для расчёта
. Для расчёта  воспользуйтесь уравнением состояния Ван-дер-Ваальса:
воспользуйтесь уравнением состояния Ван-дер-Ваальса:
 ,
,
где  и
и  – постоянные Ван-дер-Ваальса. Для азота они равны
– постоянные Ван-дер-Ваальса. Для азота они равны  Па*м6/моль2 и
Па*м6/моль2 и  м3/моль. Определите по формуле
м3/моль. Определите по формуле  относительную погрешность давления, допущенную в предположении, что азот – это идеальный газ.
относительную погрешность давления, допущенную в предположении, что азот – это идеальный газ.
Примечание. Пункты 2, 3 выполните письменно при подготовке к лабораторной работе.
Литература
1. Савельев И.В. Курс общей физики: в 5 кн.: кн. 3. Молекулярная физика и термодинамика. – М.:АСТ: Астрель, 2007. – §§ Введение, 1.1, 1.3, 1.7, 1.8, 1.13, 2.5.
2. Иродов И.Е. Физика макросистем. Основные законы / И.Е.Иродов. – 3-е изд., стереотипное. – М.: БИНОМ. Лаборатория знаний, 2006. – §§ Введение, 1.1, 1.3, 1.7.
3. Сивухин Д.В. Общий курс физики. Учеб. пособие: Для вузов. В 5 т. Т.II. Термодинамика и молекулярная физика. – 4-е изд., стереот. – М.: ФИЗМАТЛИТ; Изд-во МФТИ, 2003. – §§ Введение, 1, 3, 4, §§ 7-9, 31, 97, 98.
Приложение
Определение углового коэффициента линейной зависимости