I. Типы лихорадок по характеру температурной кривой
1. Постоянная лихорадка (febris continua) − суточные колебания температуры не превышают 1 °С. Встречается при крупозной пневмонии, брюшном и сыпном тифе.
2. Послабляющая лихорадка (febris remittens) − суточные колебания температуры в пределах 1–2 °С. Встречается при бронхопневмонии, туберкулезе, экссудативном плеврите.
3. Перемежающаяся лихорадка (febris intermittens) − характеризуется кратковременными, но значительными (3–4 °С) подъемами температуры, сочетающимися с периодами нормальной или пониженной температуры тела. Встречается при малярии.
4. Изнуряющая лихорадка (febris hectica) − суточные колебания температуры составляют 3–5 °С. Встречается при сепсисе, туберкулезе.
5. Неправильная лихорадка (febris athypica) − суточные колебания температуры различны и незакономерны. Встречаются при сепсисе, туберкулезе.
6. Извращенная лихорадка (febris inversus) − подъем температуры утром, снижение вечером. Встречается при сепсисе, туберкулезе, бруцеллезе.
7. Возвратная лихорадка (febris recurrens) − чередование лихорадочных приступов в течение 5−7 дней с периодами нормальной температуры (апирексии) такой же длительности. Встречается при возвратном тифе.
На характер температурной кривой влияют биологические особенности возбудителя, например, цикличность его развития. Весьма характерна в этом отношении температурная кривая при малярии. При этом заболевании температура быстро повышается и удерживается на высоте 40 °С и выше в период от 30−60 минут до 2−3 часов, после чего столь же быстро падает до исходного уровня и даже ниже его. Если приступы лихорадки повторяются через два дня на третий, то такая лихорадка носит название трехдневной (febris tertiana), если эти приступы лихорадки возникают через три дня на четвёртый − четырехдневной (febris quartana), если эти приступы ежедневны, то лихорадка называется каждодневной (febris quotidiana). При возвратном тифе (febris reccurrens) спирохета Обеймейера фагоцитируется макрофагами и размножается в них. По мере накопления в клетках, спирохеты прорывают барьер мононуклеарных фагоцитов и выходят в кровь. Этому соответствует приступ лихорадки, продолжающийся 5−7 дней, после чего температура критически снижается и наступает период апирексии такой же длительности. При повторении приступов их продолжительность с каждым разом уменьшается, в то время как длительность периодов апирексии, наоборот, − возрастает.
II. Типы лихорадок по длительности повышения
Температуры тела
− кратковременная или эфемерная (от нескольких часов до 2−3 суток);
− острая (до 2-х недель);
− подострая (до 6-ти недель);
− хроническая (свыше 6-ти недель).
III. Типы лихорадок в зависимости от степени повышения
Температуры тела
1. Субфебрильная (до 38 °С);
– низкая (до 37,5 °С);
– высокая (от 37,6 °С до 38 °С); если субфебрильная лихорадка продолжается более 2–4 недель, её принято называть состоянием «субфебрилитета». Иногда субфебрилитет относят к «лихорадке невыясненной этиологии».
2. Фебрильная (более 38 °С);
− умеренная (до 39 °С);
− высокая (до 41 °С);
− гиперпиретическая (свыше 41 °С).
Температурный лист №1. Лихорадка постоянного типа (febris continua) с постепенным подъемом и литическим падением температуры, по длительности − острая (14 дней), по степени повышения температуры тела − фебрильная высокая (от 39 °С до 40 °С). Характерна для брюшного и сыпного тифа.
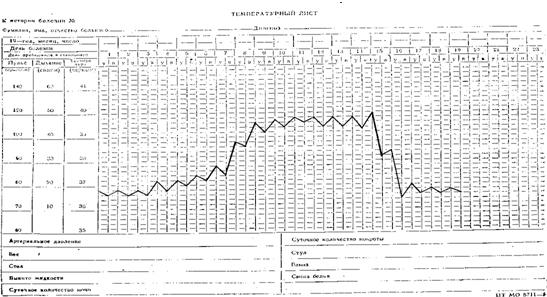
|
| Лихорадка постоянного типа |
Температурный лист №2. Лихорадка послабляющего типа (febris remittens) с острым подъемом и литическим падением температуры, по длительности − острая (13 дней), по степени повышения температуры тела − фебрильная высокая (от 39 0С до 40,8 0С). Встречается при бронхопневмонии, туберкулезе, экссудативном плеврите.
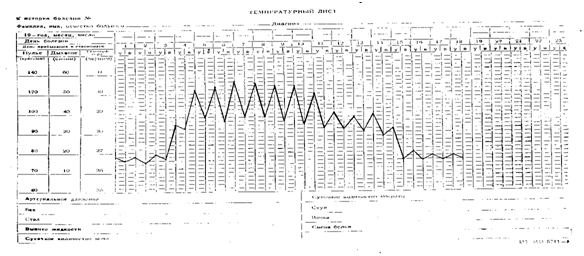
|
| Лихорадка послабляющего типа |
Температурный лист №3
а) Лихорадка перемежающегося типа, трехдневная (febris intermittens tertiana) с острым подъемом и критическим падением, по длительности − острая (11 дней), по степени повышения температуры тела − фебрильная высокая. Лихорадочные приступы возникают через день. Характерна для малярии.
б) Лихорадка перемежающегося типа, ежедневная (febris intermittens quotidiana). Отличается от предыдущего типа наличием ежедневных лихорадочных приступов. По степени повышения температуры тела − фебрильная гиперпиретическая (выше 41 0С).
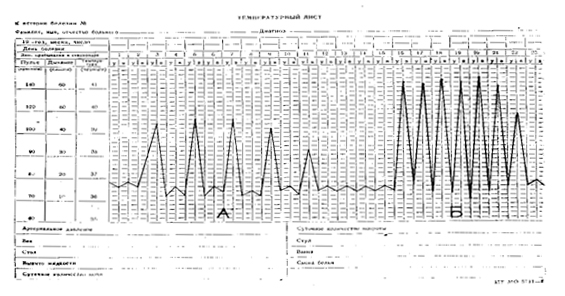
|
| а) Лихорадка перемежающегося типа, трехдневная б) Лихорадка перемежающегося типа, ежедневная |
Температурный лист №4. Лихорадка перемежающегося типа четырехдневная (febris intermittens quartana) с острым подъемом и критическим падением температуры, по длительности − подострая (15 дней), по степени повышения температуры тела − фебрильная высокая. Лихорадочные приступы перемежаются двумя днями нормальной или субнормальной температуры тела. Встречается при малярии.
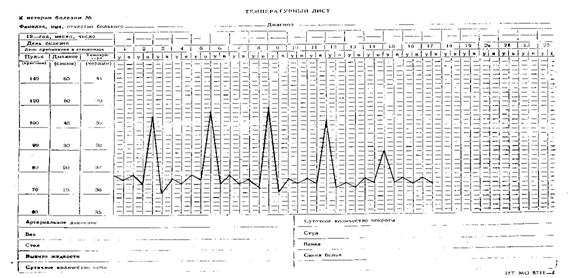
|
| Лихорадка перемежающегося типа, четырехдневная |
Температурный лист №5. Изнуряющая лихорадка (febris hectica) с острым подъемом и литическим падением температуры, подострая, фебрильная, гиперпиретическая. Встречается при сепсисе, туберкулезе.
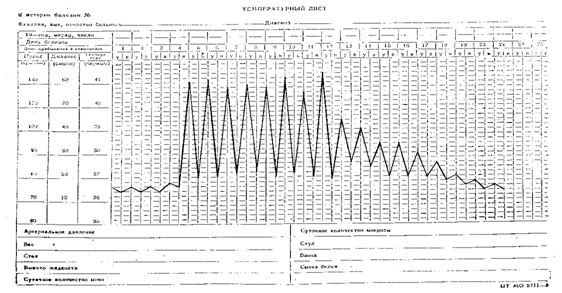
|
| Изнуряющая лихорадка |
Температурный лист №6. Неправильный тип подострой лихорадки (febris athyрica). Встречается при сепсисе, туберкулезе.
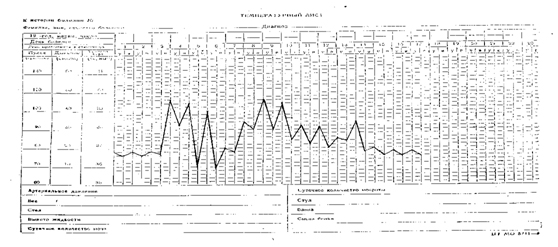
|
| Неправильный тип лихорадки |
Температурный лист №7. Извращенный тип (febris inversus) подострой фебрильной высокой лихорадки с острым подъемом и литическим падением температуры. Встречается при сепсисе, туберкулезе, бруцеллезе
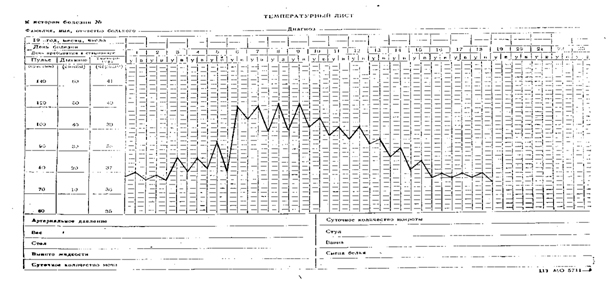
|
| Извращенный тип лихорадки |
Температурный лист №8. Возвратная лихорадка (febris recurrens), подострая, фебрильная умеренная. Встречается при возвратном тифе.
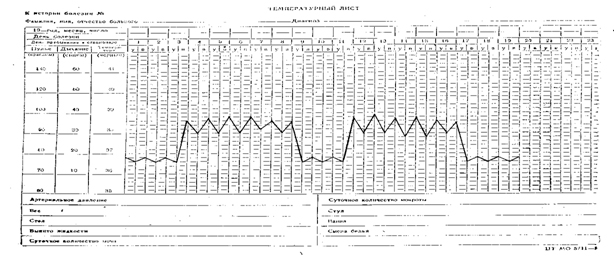
|
| Возвратная лихорадка |
Сахарный диабет − гетерогенная группа заболеваний, характеризующихся нарушением образования и/или действия инсулина и связанной с этим гипергликемией. Диагностическими признаками сахарного диабета являются: полидипсия, полиурия, гиперфагия, кожный зуд, гнойничковые заболевания кожи, мышечная слабость. Лабораторные критерии − случайное обнаружение уровня глюкозы более 11,1 ммоль/л или гликемии натощак более 7,0 ммоль/л, положительный тест на углеводную нагрузку.
Классификация сахарного диабета: 1. Сахарный диабет 1-го типа; 2. Сахарный диабет 2-го типа; 3. Формы сахарного диабета, которые развиваются на фоне других форм патологии, например, при патологии поджелудочной железы, во время беременности (гестационный сахарный диабет), индуцированный приемом некоторых лекарственных средств, при наследственных формах патологии, ассоциирующихся с высоким риском развития сахарного диабета, при эндокринопатиях, после перенесенных инфекционных заболеваний).
Этиология и патогенез сахарного диабета 1-го типа. Сахарный диабет 1-го типа - органоспецифическое аутоиммунное заболевание, при котором происходит разрушение β-клеток островков Лангерганса поджелудочной железы аутореактивными Т-лимфоцитами. Особая роль в патогенезе принадлежит наследственной предрасположенности и воздействию на организм экзогенных патогенных факторов, таких как пренатальное программирование, перенесенные вирусные инфекции, вакцинация, раннее вскармливание коровьим молоком, введение продуктов, содержащих глютен и др. При этом развивается абсолютный дефицит инсулина, что сопровождается нарушением поступления глюкозы в клетки инсулинзависимых органов и тканей (жировая ткань, мышцы, печень) и стойким повышением уровня глюкозы в крови.
Этиология и патогенез сахарного диабета 2-го типа. 1. Инсулинорезистентность (механизмы: уменьшение количества рецепторов к инсулину, снижение сродства рецепторов к инсулину, дефект пострецепторных механизмов действия инсулина). 2. Синтез биологически менее активной молекулы инсулина. 3. Образование прочной связи инсулина с белками плазмы крови без последующей диссоциации. 4. Избыточная продукция контринсулярных гормонов.
Основная причина инсулинорезистентности – ожирение. Важнейшие патогенетические механизмы инсулинорезистентности при ожирении: развитие воспаления низкой интенсивности, дисфункция митохондрий, стресс эндоплазматического ретикулума, окислительный стресс, «глюколипотоксичность», блокада PPAR-γ-рецепторов (рецепторы, активирующие пролиферацию пероксисом).
Осложнения сахарного диабета. К острым осложнениям относят гипергликемическую кому (кетоацидотическую, лактацидемическую, гиперосмолярную) и гипогликемическую кому.
Механизм кетоацидотической комы: абсолютный дефицит инсулина → уменьшение транспорта глюкозы в клетки → увеличение образования контринсулярных гормонов → стимуляция глюконеогенеза → активация липолиза и окисления жирных кислот в печени до кетоновых тел (ацетон, ß-оксимасляная кислота, ацетоуксусная кислота). Триггерами могут быть инфекционные заболевания, стресс, беременность, травмы, хирургические вмешательства. Кетоацидоз сопровождается дыханием Куссмауля, кетонурией, запахом ацетона изо рта, рвотой, спутанностью сознания, слабостью, обезвоживанием на фоне полиурии и полидипсии.
Лактацидемическая кома возникает при гипоксии любой этиологии, при передозировке метформина, а также при воспалении, так как при увеличении продукции активных форм кислорода в лейкоцитах глюкоза метаболизируется до лактата. При этом рН крови снижается до 7,2 или даже менее, а концентрация лактата в крови может составлять более 5,0 ммоль/л.
Гиперосмолярная кома (у пациентов с СД2) возникает при высоких концентрациях глюкозы в крови (30-50 ммоль/л), выраженной дегидратации, а также при нарушении функции почек. Механизм: вырабатываемый поджелудочной железой инсулин предотвращает усиленный липолиз, следовательно, и кетогенез, но не обеспечивает утилизацию глюкозы клетками инсулинзависимых органов и тканей.
Гипогликемическая кома может наступить при передозировке инсулина, нарушении диеты, физических и эмоциональных нагрузках, приеме алкоголя. Основной патогенетический механизм – острое энергетическое голодание нейронов ЦНС. Характерно острое начало: слабость, ощущение голода, профузный пот, расширение зрачков, тремор с переходом в генерализованные судороги, потеря сознания, развитие внутриклеточного отека нейронов.
Хронические осложнения сахарного диабета: 1. Макроангиопатия. 2. Микроангиопатия. 3. Полинейропатия. 4. Иммунодефицит. 5. Нефропатии.
Механизмы хронических осложнений сахарного диабета: 1. Гликозилирование белков; 2. Нарушение внутриклеточного метаболизма глюкозы (превращение глюкозы в сорбитол и фруктозу); 3. Активация протеинкиназы С; 4. Дисфункция эндотелия.
Гипогликемия − уменьшение содержания глюкозы в крови менее 3,3 ммоль/л. Гипогликемия нередко возникает при гиперпродукции инсулина, уменьшении образования АКТГ, СТГ, глюкокортикоидов, тироксина, катехоламинов, а также при печеночной недостаточности, пищевом голодании, тяжелой физической нагрузке. Врожденные формы гипогликемии являются характерными проявлениями гликогенозов − наследственных ферментопатий, при которых нарушается образование глюкозы из гликогена, например, при дефиците глюкозо-6-фосфатазы (болезнь Гирке), фосфорилазы печени и мышц.
Пищевое голодание – это полное или частичное ограничение приема пищи. Различают полное, неполное и частичное голодание. Абсолютное полное голодание характеризуется исключением из рациона воды.
Причины голодания: внешние (отсутствие пищи) и внутренние (заболевания ЖКТ, отсутствие аппетита). Факторы, влияющие на длительность и исходы голодания: внешние (температура окружающей среды, влажность, двигательная активность), внутренние (пол, возраст, конституция, сопутствующие заболевания, интенсивность основного обмена).
Периоды полного пищевого голодания. Первый период (1-2 дня): в этот период основной обмен повышен, энергетические потребности удовлетворяются за счет эндогенного запаса углеводов (дыхательный коэффициент (ДК) − 1,0), ограничен синтез белка, возникает отрицательный азотистый баланс. Второй период (30-50 дней): происходит окисление преимущественно жиров, понижается основной обмен, интенсивность белкового обмена, падает активность эндокринных желез, происходит потеря веса внутренних органов за счет жировой ткани. ДК равен 0,7. Третий период (2-3 дня, необратимая стадия): резкое усиление распада белков в качестве энергетического материала. ДК равен 0,8. Усиливается выведение с мочой азота, калия и фосфора. Развивается полиорганная недостаточность. В этот период может происходить спонтанная секреция желудочного сока, компоненты которого используются с энергетическими целями. Развиваются гипоонкотические отеки.
Ожирение – форма патологии, характеризующаяся увеличением массы тела человека за счет жировой ткани. При ожирении увеличивается содержание триглицеридов, холестерина, липопротеидов очень низкой и низкой плотности и уменьшается концентрация липопротеинов высокой плотности в крови. Ожирение можно разделить на алиментарно-конституционное, церебральное, эндокринное. По месту распределения жировой ткани в организме различают андроидное и гиноидное ожирение.
Сфинголипидозы – врожденные нарушения метаболизма липидов, главным образом сфинголипидов, входящих в состав клеточных мембран головного мозга и других органов. Нарушения обусловлены отсутствием лизосомальных ферментов, катализирующих процессы распада сфинголипидов.
Дислипопротеинемии − состояния, характеризующиеся изменением содержания липопротеидов в плазме крови. Ι тип − гиперхиломикронемия; II тип − гипербеталипротеинемия; III тип – дисбеталипопротеинемия; IV тип ДЛП − семейная триглицеридемия; V тип − гиперхиломикронемия и гиперпребеталипопротеинемия.
Метаболический синдром. Диагностические критерии метаболического синдрома у европейцев: абдоминальное ожирение (окружность талии у женщин > 88 см, у мужчин > 102 см); гипертриглицеридемия (> 1,5 г/л); снижение содержания ЛПВП в крови (у женщин <0,4 г/л, у мужчин <0,5 г/л); повышение АД >130/85 мм рт. ст. или ранее выявленная артериальная гипертензия, даже если АД поддерживается на более низком уровне с помощью лекарственной терапии; гликемия натощак >6,1 ммоль/л.Наличие у пациента 3 из 5 вышеперечисленных критериев позволяет диагностировать у него метаболический синдром. Следствия метаболического синдрома: развитие атеросклероза, ишемической болезни сердца, инфаркта миокрада.
Нарушения обмена белков могут быть экзогенного и эндогенного происхождения. К экзогенным причинам относят дефицит поступления незаменимых аминокислот с пищей. К эндогенным причинам можно отнести нарушение расщепления и всасывания белков в ЖКТ, замедление поступления аминокислот из крови в органы, нарушение синтеза белков в тканях, нарушение обмена аминокислот, изменение скорости распада белков, а также патология обезвреживания конечных продуктов азотистого обмена.
Подагра − гетерогенная группа наследственных и приобретенных болезней нарушения обмена пуриновых оснований, общими признаками которых являются: 1. Увеличение содержания мочевой кислоты (метаболита пуриновых оснований) в крови; 2. Возникновение повторных приступов воспаления суставов (артриты), вызванного кристаллами натриевой соли мочевой кислоты. 3. Поражение почек. Первичная подагра возникает из-за нарушения метаболизма мочевых кислот в организме, а также вследствие уменьшения выделения почками мочевой кислоты и одновременно ее гиперпродукцией. Вторичная подагра может возникать как осложнение, например, при хронической гемолитической анемии, лейкемии, хронических заболеваниях почек, приеме аспирина, применении никотиновой кислоты, алкоголизме.
Механизмы развития гиповитаминозов и их следствия. По механизму возникновения различают экзогенные (недостаток в пище) и эндогенные (нарушение всасывания и синтеза витаминов) гиповитаминозы. Дефицит витамина А сопровождается гемералопией, ксерофтальмией, гиперкератозом кожи. Дефицит витамина Д приводит к развитию рахита. Дефицит витамина К характеризуется повышенной кровоточивостью из-за подавления синтеза витамин К-зависимых факторов свертывания. Дефицит витамина Е сопровождается нарушением репродуктивной функции, нарушением белкового, жирового и углеводного обменов, увеличением потребности клеток в кислороде, снижением активности антиоксидантной системы. Дефицит витамина В1 (болезнь бери-бери) проявляется поражением нервной системы, вялостью, развитием параличей, дегенерацией миелина. Дефицит витамина С (цинга) характеризуется кровоточивостью, опуханием десен, выпадением зубов, торможением синтеза белка, падением активности ферментов, гипофункцией надпочечников. Недостаток витамина В6 сопровождается поражением нервной системы, нарушением обмена аминокислот. Дефицит витамина РР характеризуется развитием пеллагры (дерматит, диарея, деменция). Дефицит витамина В12 проявляется мегалобластной анемией, нарушением миелинизации нервных волокон и неврологической симптоматикой (фуникулярный миелоз).
Отек − накопление жидкости в тканях и полостях тела.
Виды отеков по этиологии: застойный, токсический, аллергический, голодный, воспалительный, лимфогенный, сердечный, почечный (нефротический и нефритический), эндокринный.
Виды отеков по патогенезу: механические, гипоонкотические, мембраногенные, гиперосмолярные, лимфогенные, гидростатические, простые и сложные.
Застойный отек развивается при венозной гиперемии. Он обусловлен повышением гидростатического давления в венозных частях капилляров и венулах.
Токсический отек возникает при повреждении токсическими веществами сосудистой стенки с увеличением ее проницаемости.
Аллергический отек развивается при некоторых аллергических реакциях вследствие повышенной проницаемости сосудистой стенки под действием медиаторов аллергии.
Голодный отек развивается вследствие снижения онкотического давления плазмы крови в условиях гипопротеинемии.
Воспалительный отек развивается в очаге воспаления из-за: (1) повышения гидростатического давления в микрососудах (капиллярах и венулах); (2) повышения их проницаемости, (3) повышения онкотического давления в тканях.
Лимфогенный отек возникает при нарушении оттока лимфы от тканей.
Сердечный отек развивается при сердечной недостаточности. Механизмы: 1) повышение гидростатического давления в венозной части капилляров из-за венозной гиперемии; 2) активация РААС вследствие гипоперфузии почек; 3) повышение проницаемости микроциркуляторного русла в условиях гипоксии; 4) снижение онкотического давления крови из-за нарушения белок-синтезирующей функции печени при длительно существующем венозном застое в ней.
Нефритический отек возникает при воспалительных поражениях почек. Основной механизм развития нефритического отека: задержка Na+ и воды в организме вследствие активации системы РААС.
Нефротический отек является следствием уменьшения онкотического давления плазмы крови из-за выраженной протеинурии (преимущественно альбуминурии).
Эндокринный отек возникает при гипофункции и гиперфункции щитовидной железы. Ведущий механизм отека при гипофункции щитовидной железы − повышение онкотического давления в тканях из-за увеличения содержания в них гиалуроновой кислоты и хондроитинсульфата. При гиперфункции щитовидной железы наблюдается претибиальный и периорбитальный отек вследствие инфильтрации тканей активированными Т-лимфоцитами.
Регуляция КОС в организме осуществляется 3 механизмами: буферными системами крови, изменением легочной вентиляции, изменением фильтрационной и реабсорбционной функций почек.
Виды нарушения КОС: метаболический ацидоз, газовый (респираторный) ацидоз, метаболический алкалоз, газовый алкалоз, сочетанные нарушения.
Причинами развития метаболического ацидоза являютсяразличные формы патологии, сопровождающиеся накопленеим нелетучих кислот (лактата, кетоновых тел) или потерей оснований (при диарее): сахарный диабет; пищевое голодание; гипоксия; почечная и печеночная недостаточность, отравление антифризом, этанолом, передозировка ацетилсалициловой кислоты, злокачественные новообразования, лихорадка, гликогенозы, воспалительные процессы, обширные ожоги, передозировка метформина при лечении сахарного диабета 2-го типа вследствие активации анаэробного гликолиза. При этом снижаются все основные показатели, характеризующие КОС: рН, [НСО3-], рСО2. Компенсаторные изменения: гипервентиляция легких приводит к увеличению выделения СО2, уменьшению содержания в крови угольной кислоты.
Причиной развития газового ацидоза является гиповентиляция легких, сопровождающаяся накоплением в организме летучей угольной кислоты. Характер изменений параметров КОС при газовом ацидозе: уменьшение рН, увеличение рСО2 и [НСО3-]. При компенсации в почках усиливается секреция ионов водорода, реабсорбция бикарбонатов, аммониогенез.
Причины развития метаболического алкалоза: неукротимая рвота, сопровождающаяся потерей соляной кислоты, передозировка оснований. Характерно увеличение рН, [НСО3-], рСО2. В порядке адаптации уменьшается вентиляция легких, снижается выделение СО2. При метаболическом алкалозе компенсаторно происходит усиление гликолиза, что приводит к увеличению образования кислых продуктов: пирувата и лактата.
Газовый алкалоз возникает при гипервентиляции легких, например, при горной болезни, гемической гипоксии, истерии, и т.д. В результате адаптации при газовом алкалозе в почках уменьшается секреция ионов водорода, реабсорбция бикарбонатов. Возникают метаболические изменения, аналогичные тем, которые имеют место при метаболическом алкалозе (усиление гликолиза, увеличение образования пирувата и лактата). Характер изменений параметров КОС при газовом алкалозе: увеличение рН, уменьшение [НСО3-], рСО2.
Изменения в организме при нарушении КОС. Ацидоз приводит к угнетению центральной нервной системы, развитию комы. При алкалозе возможно возникновение судорог, подавление активности дыхательного центра, нарушение мозгового кровообращения из-за спазма мозговых сосудов.
Аллергия, или реакция гиперчувствительности, – иммунопатологический процесс, возникающий в сенсибилизированном организме в ответ на действие веществ антигенной природы, сопровождающийся активацией клеток иммунной системы и выделением медиаторов аллергии, повреждающих ткани организма.
Классификация аллергических реакций. По Джеллу и Кумбсу, аллергические реакции делят на 4 типа: 1-го типа − реагиновые (анафилактические, опосредованные Ig класса Е, реакции немедленного типа), 2-го типа − цитотоксические (цитолитические), опосредованные Ig классов М и G), 3-го типа − иммунокомплексные, опосредованные Ig классов М, G1, А. 4-го типа − клеточно-опосредованные, опосредованы Т-лимфоцитами CD4+ или CD8+, гиперчувствительность замедленного типа.
Патогенез аллергических реакций. Выделяют 3 стадии развития аллергической реакции: иммунную, патохимическую и патофизиологическую. Иммунная стадия развивается в сенсибилизированном организме. Сенсибилизация − это иммунологически опосредованное повышение чувствительности организма к антигенам (аллергенам) экзогенного или эндогенного происхождения, в результате чего образуются клетки памяти и/или антигенспецифические антитела. В первую стадию при повторном контакте с аллергеном в сенсибилизированном организме аллерген взаимодействует с антителами и/или сенсибилизированными лимфоцитами с развитием патохимической стадии, которая заключается в образовании медиаторов аллергии и их высвобождении в ткань или кровь, в том числе, и путем дегрануляции базофилов. Патофизиологическая стадия характеризуется структурными и функциональными изменениями органов и тканей под действием медиаторов аллергии. К этим изменениям относят: вазомоторные реакции, повышение сосудистой проницаемости, спастические сокращения гладкомышечных клеток бронхиол и кишечника, раздражение нервных рецепторов и т.д.
Медиаторы аллергии (воспаления) делят на первичные (запасаются в гранулах тучных клеткок − биогенные амины, хемотаксичекие факторы, ферменты: химаза, триптаза, протеогликаны) и вторичные (синтезируются в процессе активации тучных клеток – лейкотриены С4, Д4, Е4, В4, простагландин Д2, фактор активации тромбоцитов и цитокины.
Аллергические реакции первого типа бывают в виде системной реакции, местной реакции и атопии. Атопия − наследственная форма аллергии, предрасположенность к необычным реакциям на действие обычных антигенов из-за способности таких людей на обычные антигены отвечать выработкой иммуноглобулинов Е (IgE), вместо, например, иммуноглобулинов G, в результате преобладания у таких индивидуумов Th2. Клинические проявления атопии: сезонный аллергический ринит, атопичекская бронхиальная астма, пищевая аллергия и др. Примером системной реакции является анафилактический шок.Патогенез: под действием медиаторов аллергии происходит резкое падение артериального давления, спазм бронхиол, увеличение секреции слизи в бронхах, спазм гладкомышечных клеток ЖКТ. Снижение АД связано с вазодилатацией периферических сосудов, падением ОПСС, перераспределением крови, увеличением сосудистой проницаемости, падением ОЦК, снижением венозного возврата крови. При этом наблюдается нарушение микроциркуляции, смешанная гипоксия (дыхательная и циркуляторная), что может привести к полиорганнной недостаточности и смерти.
Гипосенсибилизация. Специфическая − снижение чувствительности организма к аллергену путем введения пациенту в малых дозах того аллергена, к которому имеется повышенная чувствительность (гипосенсибилизация по Безредко). При этом снижается количество Th2 (следовательно, уменьшается образование IgE), увеличивается − Th1 и Т-регуляторов. Неспецифическая гипосенсибилизация − блокада выделения и инактивация биологически активных соединений (глюкокортикоиды); защита клеток от биологически активных веществ (антигистаминные препараты), стабилизаторы мембран тучных клеток, а также коррекция функциональных нарушений в органах и системах (например, введение спазмолититков уменьшает степень сужения бронхиол и гладкой мускулатуры кишечника, матки и т.д.).
Аллергические реакции второго типа вызываются IgG и M, направленными против антигенов на поверхности клеток и межклеточного вещества. Выделяют 3 варианта аллергических реакций 2 типа: 1) комплементзависимые реакции, 2) реакции, вызываемые цитотоксическими клетками, 3) реакции, обусловленные образованием антирецепторных антител. Комплементзависимые реакции могут осуществлятся по механизму прямого лизиса клетки через формирование мембраноатакующего комплекса, либо через опсонизацию и фагоцитоз клетки фагоцитами. Клинические примеры: гемотрансфузионный шок, резус-конфликт, аутоиммунная гемолитическая анемия, болезнь Грейвса, миастения гравис.
Аллергические реакции 3-го типа опосредованы образованием иммунных комплексов (АГ+АТ), повреждающих ткани через активацию системы комплента или других систем. В норме образовавшиеся иммунные комплексы (ИК) удаляются из организма в печени и селезенке. Патогенность ИК зависит от их физико-химических свойств, скорости их образования и элиминации. Иммунные комплексы откладываются, чаще всего, в базальной мембране стенки сосудов и клубочках почек, активируют систему комплемента и запускают воспаление. Иммуннокомплексная болезнь может быть острой системной (например, сывороточная болезнь после внутривенного введения чужеродной сыворотки) и локальной (феномен Артюса, отложение ИК и воспаление в месте введения аллергена) и хронической (например, при системной красной волчанке).
Аллергические реакции 4-го типа обусловлены специфически сенсибилизированными Т-лимфоцитами (Th1, Th2, Th17, цитотоксическими Т-лимфоцитами). Классическая реакция гиперчувствительности замедленного типа, опосредована СD4+ Т-лимфоцитами, которые продуцируют ИФН-γ, ИЛ-2,3, ФНО, при этом происходит активация макрофагов, лейкоцитов, образование провоспалительных цитокинов и воспаление. Цитотоксические реакции опосредованы CD8+ лимфоцитами. Примеры: контактный дерматит, туберкулиновая реакция, реакция отторжения трансплантата.
Реакция отторжения трансплантата - реакция отторжения чужеродной ткани донора вследствие развития иммунного ответа против HLA-антигенов, которая осуществляется Т-лимфоцитами и антителами.
Реакция трансплантат против хозяина развивается при пересадке тканей, содержащих иммунокомпетентные клетки, реципиенту с подавленной функцией иммунной системы. Характеризуется активацией лимфоцитов реципиента против клеток донора. Болезнь разивается при пересадке костного мозга, печени, после переливания донорской крови.
Аутоиммунные болезни – форма иммунопатологии, связанная с потерей иммунологической толерантности (терпимости) к собственным антигенам и характеризующаяся повреждением собственных органов и тканей аутореактивными Т-лимфоцитами и иммунными комплексами.
Классификация аутоиммунных заболеваний: органоспецифические (тироидит Хашимото, аутоимунный гастрит, аутоиммунная гемолитическая анемия, аутоиммунный гломерулонефрит, миастения Гравис, орхит), органонеспецифические (системная красная волчанка, синдром Шегрена, синдром Рейтера), промежуточные (синдром Гудпасчера).
Иммунологическая толерантность – состояние, при котором в организме не развивается иммунный ответ на собственные антигены. Различают центральный и периферический механизмы формирования иммунной толерантности. Центральный механизм осуществляется в тимусе (Т-лимфоциты) и костном мозге (В-лимфоциты), при этом происходит клональная делеция (апоптоз) аутореактивных Т- и В-лимфоцитов. Периферический механизм имеет место в периферических лимфоидных тканях и обеспечивается 1) клональной делецией аутореактивных Т-лимфоцитов путем их апоптоза; 2) клональной анергией; 3) подавлением аутореактивных Т-лимфоцитов Т-регуляторами.
Патогенез аутоиммунных заболеваний: 1) Нарушение формирования Т-клеточной анергии; 2) Отсутствие гибели аутореактивных Т-лимфоцитов при ах активации путем Fas-индуцированного апоптоза; 3) Недостаточная функция Т-регуляторов; 4) Молекулярная мимикрия; 5) Поликлональная активация лимфоцитов под влиянием микроорганизмов и их продуктов; 6) Нарушение «анатомической скрытости» антигенов при увеличении проницаемости или повреждении гистогематических барьеров; 7) Нарушение «молекулярной скрытости» антигенов при экспозиции скрытых эпитопов белка.
Механизмы повреждения тканей при аутоиммунных заболеваниях осуществляются по типу аллергических реакций ΙΙ, ΙΙΙ и ΙV типов.
Иммунодефицитные состояния – группа заболеваний, связанных с нарушением иммунного ответа и функций нейтрофилов, макрофагов, NK-клеток и системы комплемента. Иммунодефициты могут быть врожденными (первичными), приобретенными и ятрогенными (вторичными).
Первичные иммунодефициты могут быть обусловлены изменением как клеточного, так и гуморального иммунитета.Например, первичные иммунодефициты, связанные с недостаточностью антителообразования (агаммаглобулинемия; селективный дефицит IgA; снижение Ig G). Т-клеточные иммунодефициты(синдром Ди-Джорджи; Nude-сидром; атаксия-телеангиэктазия; дефицит молекул ΙΙ класса на антигенпредставляющих клетках; дефицит тирозиновой киназы и т.д. Тяжелые комбинированные иммунодефициты ( мутация гена, кодирующего γ-цепь рецептора для ИЛ-2,4,7,9,15, мутация аденозиндезаминазы с последующим апоптозом Т-лимфоцитов из-за накопления в них 2-дезоксиаденозина. Дефицит системы комплемента или другие иммунодефицитные синдромы: Вискотта-Олдрича, дефицит рецептора для ИЛ-12, который стимулирует продукцию γ-ИФ Т-лимфоцитами, и NK-клетками и т.д.
Вторичные иммунодефициты обусловлены заболеваниями, сопровождающимися подавлением системы иммунитета (злокачественные новообразования, сахарный диабет, нефротический синдром, печеночная недостаточность, состояние после спленэктомии и т.д.), а также неблагоприятными факторами внешней среды, нарушением питания, приемом лекарственных препаратов (глюкокортикоидов, цитостатиков и др.).
Синдром приобретенного иммунодефицита – вторичный иммунодефицит, вызванный ретровирусами иммунодефицита человека. Патогенез СПИДа. Первая стадия сопровождаетсяпроникновением вируса в организм, взаимодействием вирусного протеина gp120 с CD4+ молекулой Т-лимфоцитов, внедрением вируса в клетку. Далее обратная транскриптаза на основе вирусной РНК синтезирует вирусную ДНК, которая перемещается в ядро и встраивается в геном клетки. Вторая стадия хронической персистенции длится до появления клинических признаков (5-10 лет). Уровень СD4+Т-лимфоцитов в крови в эту стадию снижается, наблюдается лимфаденопатия, тромбоцитопения. 3 стадия (стадия кризиса) характеризуется снижением иммунной защиты организма, увеличением содержания вируса в крови, длительная лихорадка, слабость, диарея, кахексия, резкое снижение CD4+ Т-лимфоцитов, развиваются оппортунистические инфекции, вторичные опухоли (саркома Капоши).
Опухолевый рост – типовой патологический процесс, характеризующийся беспредельным размножением трансформированных под действием канцерогенных факторов клеток. Гистологически опухоль состоит из паренхимы (пролиферирующие опухолевые клетки) и стромы (соединительная ткань и сосуды).
Доброкачественные опухоли оказывают локальные эффекты на органы и ткани без генерализованной реакции организма, состоят из дифференцированных клеток, обладают медленным ростом, не инфильтрируют окружающие ткани и не метастазируют.
Злокачественные опухоли оказывают местное и системное действие на организм, состоят как из дифференцированных, так и недифференцированных клеток, которые обладают клеточным, тканевым, функциональным и биохимическим атипизмом. Злокачественные клетки теряют способность к дифферинцировке, обладают способностью к быстрому росту, инвазии и метастазированию. Метастазы – новые очаги той же самой опухоли, которые находятся на расстоянии от первичного очага. Пути распространения