ИОНООБМЕННЫЕ СВОЙСТВА КРИСТАЛЛОВ
Цель работы: Ознакомиться с явлением ионного обмена. Изучить особенности структуры полисурьмяной кристаллической кислоты, как соединения обладающего ионообменными свойствами. Методом титрования суспензии определить ионообменную емкость полисурьмяной кристаллической кислоты.
Явление ионного обмена
При соприкосновении двух различных несмешивающихся фаз может происходить взаимное перераспределение компонентов. В результате состав фаз изменяется, они обогащаются одними и обедняются другими компонентами. При этом возможны два случая:
а) компоненты второй фазы переходят в объем первой фазы – абсорбция (объемное поглощение).
б) компоненты второй фазы не переходят в объем первой фазы, а удерживаются на межфазной границе раздела – адсорбция.
Фазу, поглощающую компонент, называют сорбентом. Сорбируемое же вещество называют сорбатом. Различают два типа сорбции: физическую сорбцию и хемосорбцию. Хемосорбцией называют поглощение с образованием химических соединений при участии химических сил и в результате химической реакции. Физическая сорбция объясняется воздействием сил межмолекулярного взаимодействия.
При наличии на поверхности или в объеме сорбента заряженных сорбционных мест (зарядов), образовавшихся в результате частичной диссоциации сорбента при взаимодействии со средой, на них происходит сорбция противоположно заряженных частиц – ионов – это явление и называется ионным обменом. В самом общем смысле под ионным обменом понимают реакции обмена ионами между различными веществами – электролитами. В более узком смысле под ионным обменом подразумевают обмен образующимися при диссоциации электролитов ионами между фазами гетерогенной системы, по крайней мере, одна из которых обладает особыми свойствами и называется «ионит».
Ионит – это вещество или совокупность веществ, обладающих следующими свойствами:
- он образует отдельную фазу гетерогенной (неоднородной) системы;
- по крайней мере, одно из образующих эту фазу веществ способно диссоциировать на ионы и является электролитом;
- по крайней мере, одна из разновидностей ионов в ионите по различным причинам содержится только в фазе ионита, не может ее покинуть и перейти границу раздела.
Эти ионы называются фиксированными ионами. Фиксированными ионами могут быть катионы, анионы и вместе и те и другие. Фаза ионита макроскопически электронейтральна и в условиях равновесия не содержит свободного электрического заряда.
Наряду с фиксированными ионами ионит содержит эквивалентное им по заряду количество ионов противоположного знака – противоионов, или обменных ионов. Противоионы свободно переходят из ионита в другие фазы через межфазовую границу в обмен на эквивалентное количество других ионов того же знака, поступающих из внешней среды.
В зависимости от того, какие ионы способны обменивать иониты с внешней средой, последние можно разделить на:
Катиониты – иониты с закрепленными анионами, обменивающиеся с внешней средой катионами.
Аниониты – иониты с закрепленными катионами, обменивающиеся с внешней средой анионами.
Амфолиты – иониты, содержащие закрепленные катионогенные и анионогенные группы и в определенных условиях выступающие либо как катиониты, либо как аниониты.
Емкость обмена – количественная характеристика ионитов, характеризующая суммарное количество противоионов, приходящихся на единицу массы сухого ионита. Для катионитов под емкостью обмена понимается емкость по катионам, для анионитов – по анионам. Чаще всего емкость обмена выражается в мг-экв на грамм сухого ионита. Для сильнокислотных и сильноосновных ионитов их емкость не зависит от природы и концентрации и в широком интервале pH от кислотности насыщающего раствора.
Как и для любого химического процесса, для реакции ионного обмена может быть записано уравнение химической реакции. Для этого надо знать химические формулы участвующих в обмене веществ – электролитов. Предполагают, что ионит в целом можно рассматривать как некоторое суммарное объединение одинаковых по совокупности, усредненных высокомолекулярных фрагментов, содержащих только один закрепленный ион (пренебрегая неоднородностью фазы ионита, обусловленной в строении и длине цепных фрагментов макромолекул и др. возможными причинами неоднородности). Распределение ионов между ионитом и внешним раствором зависит от химического состава, температуры и давления. Чаще всего оно изучается при постоянной температуре и постоянном давлении. Функцию зависимости состава ионита от состава внешнего раствора называют изотермой – изобарой или кратко изотермой ионного обмена.
С ионным обменом связаны многие процессы с участием мыл, поверхностно-активных веществ, красителей, биополимеров – белков, ферментов, нуклеиновых кислот, нуклеопротеидов, липидов, с функционированием разнообразных биологических структур и мембран. Строго говоря, к ионному обмену относится и обмен ионами между простыми электролитами, но по традиции его рассматривают теория растворов и химия комплексных соединений.
Современные ионообменные технологии позволяют легко получать в килограммовых количествах чистые редкоземельные элементы, выделение трансурановых элементов, в том числе с коротким временем распада, содержащиеся в облученном сырье в ничтожных количествах, скоростной анализ аминокислотного состава белков. Одним из соединений, обладающих ионообменными свойствами является полисурьмяная кристаллическая кислота (ПСКК), которая имеет структуру типа пирохлора (рис.6.1)..
Структура полисурьмяной кристаллической кислоты.
Кубическая структура типа пирохлора соответствует общей химической формуле А2В2Х6Х’. Катионы В, как и в перовските, расположены в октаэдрах, сочлененных вершинами. Катионы А занимают положения с восьмерной координацией, отвечающие структуре гексагональной бипирамиды. В этом случае можно различать два типа тетраэдрически координированных анионов: анионы Х - ближайшими соседями, которыми являются два аниона А и два аниона В, и анионы Х’ с четырьмя катионами А в качестве ближайших соседей. Анионы Х’ локализованы в вершине и основании гексагональных бипирамид, соединенных вершинами. Удаление иона Х’ не изменяет характера октаэдрических полостей, но при этом возникает анизотропный центр А, вследствие чего появляется сильное электростатическое отталкивание между катионами А, находящимися по обе стороны созданной анионной вакансии. Если бы фактор толерантности сохранился в пределах 0,7< t <1,0, то вряд ли дефектная структура пирохлора А2В2Х6ÿ могла бы конкурировать со структурой перовскита. Тем не менее, известно несколько соединений типа АВХ3 с дефектной структурой пирохлора. Все они (за одним исключением) содержат ионы с легко поляризующимся атомным остовом со строением 6s2 (Tl+, Pb(II), Bi(III). Этим исключением служит AgSbO3, в котором есть cильно ковалентные связи Sb−О и кислотный ион Ag+ . Необходимо различать два типа сильно ковалентных связей В − Х: связи, включающие d- орбитали катионов, и связи, в образовании которых эти орбитали не участвуют. В случае В=Sb катион Sb(V) не имеет d-орбиталей, и ковалентная связь возникает только при помощи связывающих s-орбиталей. В структуре дефектного пирохлора угол связи Sb–O−Sb приближается к 120°, что заведомо меньше 180°, характерного для угла связи Х−В−Х в структуре перовскита.
Предполагается, что для образования структуры дефектного пирохлора
 |
необходимо присутствие сильно поляризующего катиона Мe+, вызывающего предельную поляризацию атомного остова. В этом случае смещение электронных плотностей на анионные вакансии эффективно экранирует катионы Мe+ друг от друга.
Согласно полиэдрической модели, структура пирохлора (пространственная группа симметрии Fd3m) может быть получена из структуры флюорита изъятием 1/8 анионов, поэтому октаэдр в этой модели имеет неправильную форму - несколько уплощенным, так как он получен “срезанием“ двух вершин куба, находящихся на одной телесной диагонали куба, перпендикулярно оси [100]. Элементарная ячейка состоит из 16 октаэдрических и 16 кубических полиэдров (рис. 6.1). В центре первых находятся катионы В. Они скоординированы шестью анионами Х. Октаэдры чередуются в направлении типа [100], а трехмерный каркас формируется в направлении типа [110]. Каждый анион Х принадлежит двум октаэдрам, которые связаны между собой вершинами таким образом, что в первой координационной сфере катионы В окружены шестью анионами Х, при этом полный состав октаэдра [ВХ3] и его избыточный электрический заряд равен -1. Cемейство правильных точек, помещенных в центры октаэдров [ВХ3], принято называть 16 с -, в вершинах октаэдров - 48 f -позициями. Эта группа ионов образует каркас структуры пирохлора. Компенсирующий заряд кубического полиэдра должен составлять +1, центры кубов обозначены как 16 d -, а их вершины - 8 b -позициями. Каждый анион Х¢ в кубических позициях 8 b также делится на 2 полиэдра. Поэтому суммарный заряд катионов А равен +32. Химическая формула А2В2Х6Х’ в пересчете на элементарную ячейку 16 d 16 c 48 f 8 b оказывается А16В16Х48Х’8 - 8 формульных единиц. Если представить ВХ6 - октаэдры правильной формы, то описание этой структуры может быть иным. Октаэдры, обобщая свои вершины, образуют каркас, который поэтапно собран из “качающихся” перовскитовых цепочек, простирающихся в двух взаимно перпендикулярных направлениях по диагоналям любой грани куба.
Цепочки укладываются “поленницей”, взаимно перекрываясь теми участками, которые стянуты до размера ширины цепи, то есть до ребра площадки октаэдра. В месте их контакта анионы Х2- образуют конфигурацию октаэдра такого же размера, что и ВХ6 октаэдры, но пустого.
 |
Вдоль тройной оси структуры выделяется сеточный мотив из октаэдров с тригональными и гексагональными петлями. Тригональные петли стягиваются тоже октаэдрами, но иной ориентации, а в гексагональных - располагаются катионы А (в центре) и Х- анионы (выше и ниже), группы АХ2 вдоль каждой из тройных осей блокируются октаэдрами смежных двухэтажных фрагментов. Таким образом, в каждом из шестичленных окон находится по два катиона А, связанных с парой анионов Х, поделённых пополам. Следовательно, группа АХ2 оказывается заключённой в ромбоэдрическую полость.
В рамках описанных структур могут быть получены ряд соединений с различной степенью дефектности, обладающих ионообменными свойствами.
Исходя из структурной формулы идеального пирохлора А2В2O6O¢ или, в пересчете на элементарную ячейку, А16В16O48O8¢ ПСКК представляет собой фазу переменного состава Sb2O5·nH2O (2£n£3), крайними членами которой являются Р1- фаза (n = 2) и ПСКК состава Sb2O5·3H2O. В пересчете на элементарную ячейку состав Р1- фазы – Sb16O40·16H2O. Поэтому ее структурная формула: Н16Sb16O48·8H2O.
Состав Р1- фазы удовлетворяет кристаллохимическим особенностям структуры типа пирохлора и позволяет проанализировать расположение протонных группировок и ионов кислорода и сурьмы по правильным системам точек данной структуры. Пирохлорный каркас у Р1-фазы образован бесконечными цепочками из связанных по вершинам [Sb(V)О6]- октаэдров (рис.6.1.), в которых Sb(V) - ионы занимают 16 с, а О2-– ионы – 48 f правильные системы точек пространственной группы симметрии Fd3m. В структуре типа пирохлора существует только один варьируемый параметр х атомов кислорода в 48 f - позициях типа (х, 1/8, 1/8). Если х >0,3125, то [Sb(V)О6]- - октаэдр сжат в направлении тройной оси [111], а если х <0,3125, – то вытянут в этом направлении.
Цепочки из октаэдров образуют туннели с большими полостями тетраэдрической симметрии. Каждая элементарная ячейка содержит четыре полости. Окна в полостях образованы гексагонами из атомов кислорода, средняя плоскость которых попеременно параллельна плоскостям (111) и (11 1) (рис.6. 1). Туннели в структуре ПСКК формируют искаженные гексагональные сетки, которые параллельны всем направлениям типа [110] кристалла. Атомы, не входящие в каркас (А и О¢) в соединениях со структурой идеального пирохлора, занимают 16 d -позиции (в центре окон) и 8 b -позиции (центры полостей), соответственно, а в соединениях со структурой дефектного пирохлора эти атомы могут смещаться в 32 е - или 96 h -позиции.
Из сопоставления структурных формул идеального пирохлора и Р1- фазы (Н16Sb16O48·8H2O) можно предположить, что молекулы воды располагаются в полостях, занимая 8 b - позиции, и образуют сетку водородных связей с атомами кислорода, расположенными в 48 f - позициях. Протоны в Р1- фазе, которые компенсируют отрицательный заряд каркаса обладают трансляционной диффузионной подвижностью и могут участвовать в ионном обмене.
В ПСКК состава Sb2O5·nH2O c ростом n в интервале 2 £ n £ 3 происходит взаимодействие одиночных протонов с молекулами воды и относительная доля ионов оксония Н3О+ увеличивается. Анализ расположения протонсодержащих группировок в структуре ПСКК показывает, что наиболее вероятным является заполнение молекулами воды 8 b -позиций и статистическое распределение Н3О+- ионов по 16 d -позициям пространственной группы симметрии Fd3m. Исходя из изложенного, структурная формула ПСКК с максимальной степенью гидратации имеет вид: [Н32-8n(Н3О)8n-16]Sb16O48·8H2O, что соответствует брутто - составу Sb2O5·3H2O.
Наличие заряженных протонсодержащих группировок в ПСКК позволяет в растворах гидроокисей проводить их замещение на ионы щелочных металлов. При этом ионный обмен протекает по следующей реакции:
H2Sb2O6·2H2O + (2a)Me(OH)n ® Me2aH2-2aSb2O6·2H2O + 2aH2O.(6.1)
Из данных по титрованию суспензий ПСКК растворами щелочей с учетом данных холостого опыта можно определить ионообменную емкость, а согласно соотношению (6.1) - степень ионного обмена a.
6.2. Экспериментальное определение ионообменной емкости методом потенциометрического титрования.


 Потенциометрическое титрование. Концентрацию определенного компонента раствора можно контролировать потенциометрически, если подобрать электрод, потенциал которого определяется реакцией на этот компонент. Проводя титрование анализируемого компонента, потенциометрически определяют конечную точку титрования по резкому изменению потенциала электрода в точке эквивалентности.
Потенциометрическое титрование. Концентрацию определенного компонента раствора можно контролировать потенциометрически, если подобрать электрод, потенциал которого определяется реакцией на этот компонент. Проводя титрование анализируемого компонента, потенциометрически определяют конечную точку титрования по резкому изменению потенциала электрода в точке эквивалентности.
Зависимость потенциала индикаторного электрода Е, относительно электрода сравнения, от объема титранта, представляет собой интегральную кривую титрования. Дифференциальную кривую титрования, позволяющую более точно определить точку эквивалентности, получают, строя зависимость отношения изменения потенциала  , к объему добавленного титранта
, к объему добавленного титранта 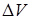 , его количество уменьшают по мере приближения к точке эквивалентности. Дифференциальная кривая более точно определяет точку эквивалентности.
, его количество уменьшают по мере приближения к точке эквивалентности. Дифференциальная кривая более точно определяет точку эквивалентности.
РН - метрия
Потенциометрия лежит в основе наиболее точных и удобных методов определения pH. Для измерения pH можно использовать различные электроды, обратимые относительно ионов H+(Н3О+). ЭДС элемента, составленного из такого электрода и электрода сравнения, равна:
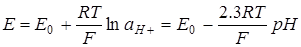 , (6.2)
, (6.2)
где E0 –ЭДС элемента при 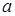 Н+=1, зависящая от электрода сравнения, а также и от характера электродных реакций. Для измерения pH используют различные электроды: водородный, хингидронный, стеклянный.
Н+=1, зависящая от электрода сравнения, а также и от характера электродных реакций. Для измерения pH используют различные электроды: водородный, хингидронный, стеклянный.
Отметим, что ”абсолютных” значений pH не существует, вследствие того, что невозможно определить коэффициенты активности отдельно взятых ионов и наличия диффузионных скачков потенциала. В настоящее время разработаны методы, позволяющие определять pH c достаточно высокой точностью, в основе которых лежит использование стандартных растворов с известными значениями pH. Пусть индикаторный на ионы H+ электрод погружен в раствор с известным pH(pH0) и ЭДС такого элемента – Е1. После замены этого раствора на раствор с неизвестным pH(pHx) ЭДС элемента равняется Е2, тогда:
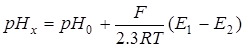 . (6.3)
. (6.3)
Для точного определения pHx раствора нужно в начале провести его предварительную оценку, а затем измерить со стандартным раствором с pHo, как можно меньше отличающимся от pH исследуемого раствора.
Рядом преимуществ по сравнению с другими индикаторными электродами обладает стеклянный электрод. Так в случае его использования нет необходимости вводить в исследуемый раствор дополнительно какие-либо вещества. Как, например, водород в случае водородного электрода, хингидрон- в случае хингидронного. Для стеклянного электрода не опасны окислители, восстановители и поверхностно-активные вещества; потенциал устанавливается сравнительно быстро. Этим следует объяснить наиболее широкое распространение стеклянного электрода при определении pH.
По принципу действия стеклянный электрод относится к мембранным электродам. Разность потенциалов, возникающая по обе стороны мембраны, является функцией отношения активностей ионов H+ в растворах по одну (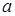 1) и по другую (
1) и по другую (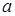 2) сторону мембраны:
2) сторону мембраны:
Eст.э = Еасо +  , (6.4)
, (6.4)
где 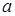 1,
1, 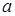 2-активности ионов H+ по обе стороны от мембраны; Eас -потенциал асимметрии. Если концентрация H+ c одной стороны остается постоянной, то
2-активности ионов H+ по обе стороны от мембраны; Eас -потенциал асимметрии. Если концентрация H+ c одной стороны остается постоянной, то
Eст.э = Ест.эо +  , (6.5)
, (6.5)
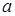 -активность ионов Н+ со стороны мембраны, контактирующей с исследуемым раствором; Е
-активность ионов Н+ со стороны мембраны, контактирующей с исследуемым раствором; Е 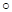 ст.э - стандартный для данного стеклянного электрода потенциал.
ст.э - стандартный для данного стеклянного электрода потенциал.
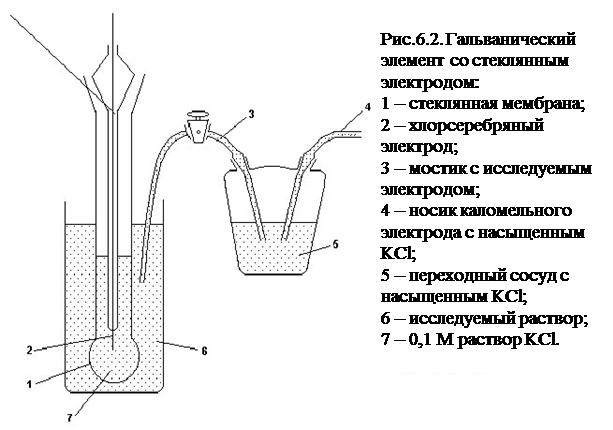
Типичная электрохимическая цепь для измерений со стеклянным электродом представлена на рис. 6.2.



 Стеклянный электрод представляет собой стеклянный тонкостенный шарик, заполненный стандартным раствором, в который погружен электрод, долговременно сохраняющий потенциал в этом растворе. Общая ЭДС как функция pH, очевидно, будет описываться соотношением (6.5). Специфика работы со стеклянным электродом определяется высоким сопротивлением стеклянной мембраны. Отсюда необходимость использования катодных вольтметров с очень высоким входным сопротивлением. Линейная зависимость (6.5) для стеклянного электрода выполняется до pH не более 12. Из-за микротоков утечки заряда коэффициент наклона кривой E -pH может быть несколько завышен.
Стеклянный электрод представляет собой стеклянный тонкостенный шарик, заполненный стандартным раствором, в который погружен электрод, долговременно сохраняющий потенциал в этом растворе. Общая ЭДС как функция pH, очевидно, будет описываться соотношением (6.5). Специфика работы со стеклянным электродом определяется высоким сопротивлением стеклянной мембраны. Отсюда необходимость использования катодных вольтметров с очень высоким входным сопротивлением. Линейная зависимость (6.5) для стеклянного электрода выполняется до pH не более 12. Из-за микротоков утечки заряда коэффициент наклона кривой E -pH может быть несколько завышен.
Для изготовления стеклянных мембран используются специальные сорта стекла, например состава 22% Na2O; 0,6% CaO, 72% SiO2.
Уравнение (6.5) является основой для pH–метрии со стеклянным электродом.