Анятие № 8 23.10-27.10 Тема: «Гетерогенные процессы и равновесия. Химизм формирования костной,зубной тканей, конкрементов»,
«Окислительно-восстановительные реакции. Количественная характеристика ОВР. Электродные потенциалы. Определение направления ОВР».
. Учебно-целевые вопросы
1.Растворимость веществ, единицы количественного выражения растворимости.
2.Растворы насыщенные, ненасыщенные пересыщенные. Суть гетерогенного равновесия, основное условие его существования. Константа гетерогенного равновесия, её применение.
3.Изолированные и совмещённые гетерогенные равновесия. Условия смещения гетерогенного равновесия.
4.Гетерогенные равновесия в живом организме, химизм образования костной, зубной ткани. Изоморфизм. Понятие о химизме патологических гетерогенных процессов, их возможной коррекции.
5.Степень окисления атомов. Характеристика окислителей и восстановителей.
6.Классификация ОВР. Составление уравнений ОВР и п одбор коэффициентов:метод электронного баланса, ионно-электронный метод(метод полуреакций).
7. Механизм возникновения электродного и редокс-потенциалов. Уравнения Нернста и Нернста-Петерса. Сравнительная сила окислителей и восстановителей..Стандартный потенциал.
8.Окислительно-восстановительные равновесия. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов.
Задачи и упражнения для самостоятельного решения
Разберите обучающие упражнения, задачи и тесты:
1)Литвинова Т.Н. Задачник по общей химии с медико-биологической направленностью: учебное пособие для студентов медицинских вузов.-3-е изд. перераб. Гриф УМО МЗ и СР//-М.:ООО «Изд. Оникс»:ООО «Издательство «Мир и образование», 2007-224с.-(Высшее образование) (можно любого издания)
№№36-43. Стр. 94-98.
2) Учение о растворах. Протолитические и гетерогенные равновесия Учебно-методическое пособие. Гриф УМО МЗ и СР. Т.Н. Литвинова, Е.Г. Кириллова. Краснодар. ООО «редакция газеты «Всякая всячина», 2009-157с. №№1-12. Стр.123-128. №1-5. Стр.129-130.
Решите задачи:
Т.Н. Литвинова. Задачник по общей химии с медико-биологической направленностью. М.: ООО «Издательство Мир и Образование», 2007.-224с. №№89,90,91,93,100,102, стр.121-123 или любого года издания.
Упражнения и задачи для самостоятельного решения
1. Определите, какие из перечисленных веществ проявляют: а) только окислительные свойства; б) только восстановительные свойства; в) окислительно-восстановительную двойственность: KMnO4, NH3, HCl, K2Cr2O7, H2S, PH3, H2SO4, HNO3, Na2S2O3, H2, S, SnCl2, PbO2.
2. Закончите уравнения реакций. Подберите коэффициенты методом полуреакций или электронным методом. Определите, к какому типу относится каждая из реакций:
SO2 + Br2 + H2O ® …;
HNO2 + PbO2 + H2SO4 ® PbSO4 + …;
SO2 + HBrO3 + H2O ® H2SO4 + Br2;
H2O2 ® H2O + O2;
S + NaOH ® Na2S + Na2SO3 + H2O;
NaCrO2 + Br2 + NaOH ® Na2CrO4 + NaBr + …;
SO2 + KMnO4 + KOH ® K2SO4 + MnO2 + …;
Cl2 + KOH ® KCl + KClO3 + …;
KMnO4  K2MnO4 + MnO2 + O2;
K2MnO4 + MnO2 + O2;
AgNO3 ® Ag + NO2 + O2;
KNO2 + K2Cr2O7 + H2SO4 ® Cr2(SO4)3 + …;
H2C2O4 + KMnO4 + H2SO4 ® CO2 + …;
Ba + HNO3 ® NH4NO3 + …;
Ag + HNO3 ® AgNO3 + NO + …;
KNO2 + HClO3 ® KNO3 + HCl;
KI + KNO2 + H2SO4 ® I2 + NO + …;
3.Рассчитайте электродные потенциалы магния в растворе его соли при концентрациях иона Mg+2, равной 0,1; 0,01 и 0,001 моль/л.
(Ответ: –2,39 В; –2,42 В; –2,45 В).
4.Вычислите потенциал системы Fe3+/Fe2+при следующих активностях: а (Fe3+)=0,1 моль/л, а (Fe2+) = 5×10–3 моль/л. (Ответ:  = 0,847 В).
= 0,847 В).
5..Имеется окислительно-восстановительная пара [Fe(CN)6]3–+  Û[Fe(CN)6]4–. При каком соотношении концентраций окисленной и восстановленной форм потенциал этой системы будет равен 0,28 В? (Ответ: 0,044).
Û[Fe(CN)6]4–. При каком соотношении концентраций окисленной и восстановленной форм потенциал этой системы будет равен 0,28 В? (Ответ: 0,044).
6.Установите, в каком направлении возможно самопроизвольное протекания реакции 2NaCl + Fe2(SO4)3 = 2FeSO4 + Cl2 + Na2SO4, если 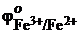 =0,77 В;
=0,77 В; 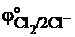 = 1,36В.
= 1,36В.
7.Может ли перманганат калия окислить в кислой среде хлорид олова SnCl2 при стандартных условиях, если  = +1,51 В;
= +1,51 В; 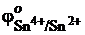 =+0,15 В.
=+0,15 В.
Занятие №9 30.10-03.11
1.Защита модуля: «Растворы. Протолитические и гетерогенные равно- весия. Окислительно-восстановительные процессы»
Цели занятия: закрепить знания, проверить и скорректировать усвоение вопросов: коллигативные свойства растворов; протолитические равновесия; теории кислот и оснований; буферные растворы, буферные системы организма; гетерогенные равновесия,окислительно-восстановительные процессы.
2.Модуль «Строение атома. Химическая связь».
Темы занятий модуля.
1.Строение атома..Периодический закон. Периодическая система элементов Д.И. Менделеева.
2 Химическая связь. Типы и механизм образования химической связи. Свойства химической связи..Комплексные соединения..Лигандообменные процессы.
.Защита модуля. Вопросы к контрольной работе для студентов I курса фармацевтического факультета по теме
«Учение о растворах. Протолитические и гетерогенные равновесия»
фармацевтический факультет, I курс 2015-2016
1) Какие свойства растворов называют коллигативными? Перечислите их. Чем отличаются свойства растворов электролитов и неэлектролитов?
2) I закон Рауля. Относительное понижение давления насыщенного пара над раствором. Поясните причины данного явления.
3) Законы Рауля (формулировка и математическое выражение). Сопоставьте температуры кипения и замерзания раствора и растворителя. Ответ поясните.
4) Диффузия, осмос, осмотическое давление, причины их возникновения. Понятие о полупроницаемых мембранах.Закон Вант Гоффа. Осмотическое давление крови плазмозамещающих растворов, осмолярность.
5) С чем связано для клетки состояние тургора, плазмолиза, гемолиза? Растворы изотонические, гипертонические и гипотонические, их применение в медицинской практике. Осмос в биологиии и медицине. Понятие об «осмотическом шоке» и «осмотическом конфликте».
6) Понятие об электролитах, примеры. Слабые электролиты и их особенности. Константа электролитической диссоциации как константа равновесия. От каких факторов и как зависит эта величина? Математическая связь между константой и степенью диссоциации (формулировка закона разведения Оствальда) Классификация слабых электролитов по величине константы диссоциации.
7) Особенности растворов сильных электролитов (суть теории Дебая и Хюккеля). Понятие о активной концентрации и коэффициенте активности. Математическая зависимость между активной и аналитической (общей) концентрациями. Какие значения может принимать коэффициент активности? Ионная сила растворов электролитов. Значение электролитов для жи-
вых организмов.
8) Протолитическая теория кислот и оснований (дайте определения, приведите примеры, напишите уравнения соответствующих реакций). Типы протолитических реакций., примеры. Укажите кислотно-основные сопряжённые пары: ClO– + H2OHClO +OH–; НРО 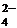 +H2OРО
+H2OРО 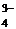 +Н3О+; Н2РО
+Н3О+; Н2РО 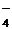 + H2O НРО
+ H2O НРО 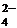 +Н3О+; Н2РО
+Н3О+; Н2РО  + H2O Н3РО4 + ОН–
+ H2O Н3РО4 + ОН–
9)Автопротолиз воды. Ионное произведение воды. Водородный показатель, шкала кислотности. рН биологических жидкостей. Значение постоянства рН в организме человека.
10)Гидролиз как протолитическая реакция. Степень и константа гидролиза. Какие факторы и как влияют на степень и константу гидролиза?
11)Теория кислот и оснований Льюиса (дать определения, привести примеры с соответствующими уравнениями реакций). Суть теории Пирсона (принцип ЖМКО).В приведенных примерах укажите жесткие и мягкие кислоты и основания: Н+, Na+, Mg2+, Ag+, Cu+, Hg2+, H2O, OH–, ROH, F–, Cl–, RS–, H–, I–
12)Гетерогенные процессы и равновесия. Условия существования гетерогенных равновесий. Константа гетерогенного равновесия, её значение. Взаимосвязь между растворимостью и константой растворимости для различных типов электролитов.
13)Изолированные и конкурирующие гетерогенные процессы. Поясните на примере конкуренции за общий анион и общий катион. В какой последовательности будут выпадать осадки, если к раствору, содержащему анионы СО32-, РО43- , SO42- постепенно приливать раствор нитрата кальция?
14)Смещение гетерогенного равновесия. Условия образования и растворения осадков. Последовательность осаждения ионов. Поясните какой из осадков образуется в первую очередь, если к раствору, содержащему ионы кальция, стронция и бария в равных концентрациях, прибавляют по каплям раствор сульфата натрия?
15)Примеры гетерогенных равновесий в организме человека (формирование костной, зубной ткани). Явление изоморфизма.
ЗАДАЧИ
1)Чему равно давление насыщенного пара при 100оС над раствором мочевины СО(NH2)2 с массовой долей 10%, если давление насыщенного пара воды при данной температуре равно 1,013×105 Па?
2) Хлорид цинка массой 1,7 г растворили в 0,25 кг воды. Полученный раствор замерзает при –0,24оС. Вычислите изотонический коэффициент хлорида цинка в этом растворе.
3) Рассчитайте температуры кипения и замерзания физиологического раствора (w = 0,86%; i =1,95)
4) Рассчитайте температуры кипения и замерзания 20%-ного раствора сахарозы (пл. 1,08 г/мл).
5) Опишите поведение эритроцитов при 310 К в растворе глюкозы с w = 20%, пл. =1,08г/мл, если осмотическое давление крови равно 780 кПа.
6)Опишите поведение эритроцитов при 310 К в растворе хлорида натрия с w = 0,5%, пл. =1, i =1,9, если осмотическое давление крови равно 780 кПа.
7) Вычислите осмотическое давление 0,02М раствора нитрата кальция (i = 2,6) при t = 37оС. Каким по отношению к плазме крови будет этот раствор?
8) Осмотическое давление крови в норме 740-780 кПа. Вычислите осмолярность крови.
9) Вычислите ионную силу 0,001М раствора CaCl2, коэффициент активности и активность ионов.
10) Водный раствор сульфата меди с массовой долей 1% назначают в малых дозах для улучшении кроветворной функции. Вычислите активность ионов меди в таком растворе (ρ=1,009 г/мл).
11) Содержание соляной кислоты в желудочном соке колеблется в пределах от 0,07 до 0,15%. Рассчитайте пределы изменения рН желудочного сока (плотность раствора 1 г/мл).
12) Вычислите значение рН раствора, полученного сливанием 100 мл 0,1 н. раствора КОН и 50 мл 0,1 н. раствора HCl.
13) Определите рН 0,1М раствора NH3·Н2О (a = 1,3%).
14) рК молочной кислоты 3,86. Рассчитайте степень диссоциации ее в 0,01М растворе. Какие факторы и как влияют на величину степени диссоциации?
15)Какова концентрация уксусной кислоты в растворе, если рK = 4,76, а рН раствора 5,2?
16)Напишите уравнения совместного гидролиза в молекулярном и ионном видах:
CuSO4 + Na2CO3 + H2O ®
17) Напишите уравнения совместного гидролиза в молекулярном и ионном видах:
Cr2(SO4)3 + Na2S + H2O ®.
18)Напишите в молекулярном и ионном видах уравнения ступенчатого гидролиза соли Na3PO4. Рассчитайте константу, степень гидролиза и рН 0,01М раствора Na3PO4 (гидролиз по I ступени).
19) Рассчитайте константу, степень гидролиза и рН 0,1М раствора HCOONa. Напишите в молекулярном и ионном видах уравнение гидролиза этой соли. Каким образом можно усилить гидролиз этой соли?
20) Рассчитайте константу, степень гидролиза и рН 0,1М раствора Na2HPO4 (по I ступени). Напишите уравнения гидролиза в молекулярном и ионном видах.
21)Напишите уравнения ступенчатого гидролиза соли NH4Cl в молекулярном и ионном видах. Рассчитайте константу гидролиза, степень гидролиза и рН 0,1М раствора NH4Cl.
22) Вычислите концентрацию ионов свинца (моль/л) в насыщенном растворе хлорида свинца (K s(PbСl2) = 1,6×10-5).
23) Растворимость Mg(OH)2 в воде равна 1,8×10-4 моль/л. Вычислите Ks(Mg(OH)2). Как изменится количество осадка при добавлении к надосадочной жидкости: а) MgCl2; б) NaOH; в) HCl; г) KCl. Ответ поясните.
24) В каком объеме насыщенного раствора AgCl содержится серебро в виде ионов массой 0,0002 г. K s(AgCl) = 1,78×10-10. Каким образом можно увеличить полноту осаждения ионов Ag+ и Cl–. Ответ поясните.
25) Вычислите массу серебра, содержащегося в виде ионов в насыщенном водном растворе цианида серебра объемом 500 мл. Как изменится масса осадка при добавлении к надосадочной жидкости растворов AgNO3, KNO3, KCN? Ответ поясните.
26)Определите, образуется ли осадок при смешении равных объемов 0,1М растворов BaCl2 и Na2SO4. Как изменится количество осадка при добавлении к надосадочной жидкости раствора KNO3? Ответ поясните.
27) Подберите ионно-электронным методом коэффициенты в уравнениях ОВР. Укажите окислитель, восстановитель; процессы окисления, восстановления. Рассчитайте молярные массы эквивалентов окислителя и восстановителя:
KMnO4 + Na2SO3 + KOH ® Na2SO4 + K2MnO4 + H2O
Ba + HNO3(разб.) ® Ba(NO3)2 + NH4NO3 + H2O
KMnO4 + H2O2 + H2O ® O2 + MnO2 + KOH
KMnO4 + KNO2 + H2O ® MnO2 + КNO3 + KOH
Zn + H2SO4(конц.) ® ZnSO4 + H2S + H2O
NO2 + KOH ® KNO3 + KNO2 + H2O
K2Cr2O7 + H2O2 + H2SO4 ® Cr2(SO4)3 + K2SO4 + O2 + H2O
Cl2 + KOH  KCl + KClO3 + H2O
KCl + KClO3 + H2O
KMnO4 + H2O2 + H2SO4 ® O2 + MnSO4 + K2SO4 + H2O
Cu + H2SO4(конц.) ® SO2 + CuSO4 + H2O
KMnO4 + HCl(конц.) ® KCl + MnCl2 + Cl2 + H2O
FeSO4 + KMnO4 + H2SO4 ® Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
C + H2SO4 ® CO2 + SO2 + H2O
Na2SO3 + KMnO4 + H2O ® Na2SO4 +MnO2 + KOH
28) Определите направление самопроизвольно протекающей реакции, вычислите ЭДС(ответ поясните):
SnCl2 + HNO2 + HCl SnCl4 + NO + H2O, jo(Sn4+/Sn2+)=+0,15 В; jo(HNO2/NO)=+1,0 В.
FeCl3 + KI ® I2 + KCl + FeCl2, jo(Fe3+/Fe2+) = +0,77 В; jo(I2/2I–) = +0,54 В.
SnCl4 + H2S SnCl2 + S + HCl, jo(Sn4+/Sn2+) = +0,15 В; jo(S/H2S) = +0,14 В.
FeCl3 +КF F2 + KCl + FeCl2, jo(Fe3+/Fe2+) = +0,77 В, jo(F2/2F–) = +2,87 В..
Н3РО4 + HI = H3PO3 + I2 + H2O, если jo(H3РО4/Н3РО3) = –0,28 В; jo(I2/2I–) = +0,54В..
29) Будет ли металлическая медь растворяться в разбавленной серной кислоте, если jo(Cu+2/Cu) =+0,337 В; jo(2H+/H2) = 0 В? Ответ поясните.
30) Может ли FeCl3 окислить H2S до элементарной серы согласно уравнению реак-ции:FeCl3 + H2S ® FeCl2 + S + HCl, если jo(Fe3+/Fe2+) = +0,77 В; jo(S/H2S) = +0,14 В. Ответ поясните.