Урок 52 Лекция
Цель: научиться уравнивать коэффициенты при составлении уравнений окислительно-восстановительных реакций используя метод электронного баланса.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителями, равно числу электронов, присоединяемых окислителями. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично, оттягиваются к одному из атомов, условно говорят только об отдаче или присоединении электронов.
Метод электронного баланса основан на сравнении степеней окисления в исходных и конечных веществах, когда известны все исходные вещества и продукты реакции. Этот метод используют при расстановке коэффициентов. И данным методом действительно удобно пользоваться и в неорганической и органической химии, конечно, если даны полные схемы реакций.
Алгоритм составления уравнений ОВР методом электронного баланса.
1. Записать схему реакции:
KMnO4 + Na2SO3 + H2O → MnO2↓ + Na2SO4 + KOH
2. Определить, атомы, каких элементов изменяют степень окисления: (для данного уравнения – это марганец и сера)
KMn+7O4 + Na2S+4O3 + H2O → Mn+4O2↓ + Na2S+6O4 + KOH
3. Составить электронные уравнения процессов окисления и восстановления:
Mn+7 + 3ē = Mn+4
S+4 - 2ē = S+6
4. Умножить полученные электронные уравнения на наименьшие множители для установления баланса по электронам: (для данного уравнения он равен 6)
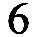 s TI/BTsMwEETvSPyDtUjcqE3apiTEqUqlijMtl96ceEki4nWI3Tb8fZcTPY5mNPOmWE+uF2ccQ+dJ w/NMgUCqve2o0fB52D29gAjRkDW9J9TwiwHW5f1dYXLrL/SB531sBJdQyI2GNsYhlzLULToTZn5A Yu/Lj85ElmMj7WguXO56mSiVSmc64oXWDLhtsf7en5yGw7tTUxW7LdLPSm2Ob8uUjkutHx+mzSuI iFP8D8MfPqNDyUyVP5ENoteQZPMFRzWs+AH7SbbIQFQa0mwOsizk7YHyCgAA//8DAFBLAQItABQA BgAIAAAAIQC2gziS/gAAAOEBAAATAAAAAAAAAAAAAAAAAAAAAABbQ29udGVudF9UeXBlc10ueG1s UEsBAi0AFAAGAAgAAAAhADj9If/WAAAAlAEAAAsAAAAAAAAAAAAAAAAALwEAAF9yZWxzLy5yZWxz UEsBAi0AFAAGAAgAAAAhAEz9o6ztAQAA5QMAAA4AAAAAAAAAAAAAAAAALgIAAGRycy9lMm9Eb2Mu eG1sUEsBAi0AFAAGAAgAAAAhAGhzSp3cAAAACAEAAA8AAAAAAAAAAAAAAAAARwQAAGRycy9kb3du cmV2LnhtbFBLBQYAAAAABAAEAPMAAABQBQAAAAA= " strokecolor="black [3200]" strokeweight=".5pt"> Mn+7 + 3ē = Mn+4 2
s TI/BTsMwEETvSPyDtUjcqE3apiTEqUqlijMtl96ceEki4nWI3Tb8fZcTPY5mNPOmWE+uF2ccQ+dJ w/NMgUCqve2o0fB52D29gAjRkDW9J9TwiwHW5f1dYXLrL/SB531sBJdQyI2GNsYhlzLULToTZn5A Yu/Lj85ElmMj7WguXO56mSiVSmc64oXWDLhtsf7en5yGw7tTUxW7LdLPSm2Ob8uUjkutHx+mzSuI iFP8D8MfPqNDyUyVP5ENoteQZPMFRzWs+AH7SbbIQFQa0mwOsizk7YHyCgAA//8DAFBLAQItABQA BgAIAAAAIQC2gziS/gAAAOEBAAATAAAAAAAAAAAAAAAAAAAAAABbQ29udGVudF9UeXBlc10ueG1s UEsBAi0AFAAGAAgAAAAhADj9If/WAAAAlAEAAAsAAAAAAAAAAAAAAAAALwEAAF9yZWxzLy5yZWxz UEsBAi0AFAAGAAgAAAAhAEz9o6ztAQAA5QMAAA4AAAAAAAAAAAAAAAAALgIAAGRycy9lMm9Eb2Mu eG1sUEsBAi0AFAAGAAgAAAAhAGhzSp3cAAAACAEAAA8AAAAAAAAAAAAAAAAARwQAAGRycy9kb3du cmV2LnhtbFBLBQYAAAAABAAEAPMAAABQBQAAAAA= " strokecolor="black [3200]" strokeweight=".5pt"> Mn+7 + 3ē = Mn+4 2
S+4 - 2ē = S+6 3
5. Перенести множители из электронных уравнений в молекулярное уравнение реакции:
2 KMnO4 + 3 Na2SO3 + H2O → 2 MnO2↓ + 3 Na2SO4 + 2 KOH
6. Проверить выполнение закона сохранения массы (число атомов каждого элемента в левой и правой части уравнения должно быть одинаковым) и, если требуется, ввести новые или изменить полученные коэффициенты:
Перманганата калия KMnO4 обладает высокой окислительной способностью.
Кроме перманганата калия окислительной способностью обладают и другие вещества.
1) H2SO4 (разбавленная), окислитель Н+1
Продукт восстановления металлом, стоящим в ряду напряжения до водорода, – Н2.
Например,
H2SO4 (разб.) + Zn —> ZnSO4 + H2  ,
,
H2SO4 (разб.) + Cu  не реагирует.
не реагирует.
2) H2SO4 (концентрированная), окислитель S+6
В зависимости от активности металла продукты восстановления концентрированной H2SO4 разные: H2S; S; SO2. Продукт восстановления зависит также и от концентрации кислоты
3) HNO3, окислитель N+5
Концентрированная HNO3 пассивирует такие металлы, как Fe, Cr, Al, что связано c образованием на поверхности этих металлов тонкой, но очень плотной оксидной пленки.
Au и Pt не реагируют с HNO3, но эти металлы растворяются в «царской водке» – смеси концентрированных соляной и азотной кислот в соотношении 3: 1.
Например:
Au + 3HCl (конц.) + HNO3 (конц.) = AuCl3 + NO + 2H2O.
4) К2Сr2O7 в кислой среде восстанавливается до Cr3+
в нейтральной среде до Сr2O3
в щелочной среде до CrO42-
Выполните тест
1. Какой из неметаллов является сильным окислителем? (1 балл)
1) фтор 2) сера 3) кислород 4) кремний
2. В каком из перечисленных соединений атом серы находится в степени окисления +6
(1 балл)
1) FeSO3 2) S 3) SO2 4) К2SO4
3. Степень окисления серы в сульфате натрия равна (1 балл)
1)+6 2)+4 3)0 4)-2
4. В каком из приведенных реакций атом хлора выступает в роли восстановителя (2 балла)
1) Cu + Cl2 = CuCl2
2) HCl + NaOH = NaCl + H2O
3) HCl + MnO2= MnCl2 + Cl2 + H2O
4) Cl2 + H2= HCl
5. Выберите уравнение реакции, в котором элемент углерод является окислителем. (2 балла)
1) 2С + O2 = 2CO
2) CO2 + 2Mg = 2MgO + C
3) CH4 + 2O2 = CO2 + 2H2O
4) C + 2H2SO4 = CO2 + 2H2O + 2SO2
6. Используя метод электронного баланса уравняйте коэффициенты в уравнении реакции:
(3 балла)
PbS + H2O2 → PbSO4 + H2O
Определите окислитель и восстановитель.
Критерии оценивания:
Баллов «5»
Баллов «4»
Баллов «3»