1.Цель работы: научиться решать окислительно-восстановительные реакции.
2.Общие сведения:
Все химические реакции делятся на два типа: реакции, протекающие с изменением степени окисления и протекающие без изменения степени окисления:
Реакции, протекающие с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными:
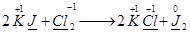
Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из предпочтения, что молекула состоит только из ионов.
Степень окисления может иметь отрицательное, положительное, или нулевое значение, которое ставится над символом элемента, в простых веществах равна нулю. Ее можно определить, исходя из положения элемента в периодической системе Менделеева.
В молекулах сложных веществ неизвестную степень окисления элемента определяют, исходя из электроотрицательности молекулы, используя правило: алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в сложном ионе - заряду иона.
2.1. Окисление. Восстановление.
В окислительно-восстановительных реакциях происходит переход электронов от одних атомов или ионов к другим. При этом протекают два взаимосвязанных процесса: окисление и восстановление.
Окисление - процесс отдачи электронов молекулой, атомом или ионом. Степень окисления при этом повышается.
 ;
; 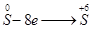 ;
; 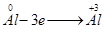
Вещества, в состав которых входят атомы элементов в высшей степени окисления, способные только понижать её, принимая электроны, являются окисли-
телями. В процессе реакции окислители восстанавливаются.
Например: 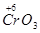 ,
, 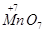 ,
,  .
.
Вещества, в состав которых входят атомы элементов в низшей степени окисления, способные только повышать её, отдавая электроны, являются восстановителями. В процессе реакции восстановители окисляются.
Например: 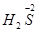 ,
, 
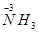 .
.
Вещества, в состав которых входят атомы элементов с промежуточной степенью окисления, способные как повышать, так и понижать её, могут быть окислителями и восстановителями, в зависимости от условий протекания реакции и природы вещества, с которым они взаимодействуют.
Например:  ,
, 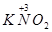 ,
,  .
.
Окислительная и восстановительная способность элементов связана со строением атомов и положением их в периодической системе Д. И. Менделеева.
В пределах каждого периода с возрастанием заряда ядра атома восстановительные свойства элементов ослабевают, а окислительные - усиливаются. При переходе сверху вниз, в пределах главных подгрупп, восстановительные свойства элементов усиливаются, окислительные - ослабевают.
Наиболее сильные восстановители в свободном состоянии являются щелочные, щелочноземельные металлы и водород. Наиболее сильные окислители - галогены и кислород.
4. Контрольные вопросы.
1. Как изменяется степень окисления окислителя и восстановителя?
Степень окисления окислителя понизится (так как к нему добавятся чужие электроны). Степень окисления восстановителя повысится (так как он отдает электроны).
2. Чем является перманганат калия в окислительно-восстановительных реакциях?
Перманганат калия в окислительно-восстановительных реакциях является окислителем.
3. Приведите примеры веществ, являющихся только восстановителями, только окислителями и таких, которые могут быть и окислителями восстановителями.
а) восстановители: H2S; MnSO4; NH3
б) окислители: CrO3; MgCl2; Mn2O7
в) и окислители и восстановители: H2SО4; KNO2
4. Какие из приведённых веществ могут быть только окислителями?
NH3, K2Cr2O7, HNO3, HNO2, K2Cr2O4, и почему?
Только окислителями могут быть HNO3 и K2Cr2O4, так как в них атомы хрома и азота имеют максимальную степень окисления.
5.Определите окислитель и восстановитель в следующих превращениях:
а) NO2+H2O = HNO3+HNO3
N - 1 e- → N (восстановитель)
N + e- → N (окислитель)
В данном случае NO2 является окислителем и восстановителем.
б) HNO2 = HNO3+NO+H2O
N (+3) - 2e=N (+5) |1 (восстановитель)
N (+3) + 1e=N (+2) |2 (окислитель)
В данном случае НNO2- является окислителем и восстановителем.