ЛЕЧЕБНЫЕ БАКТЕРИЙНЫЕ ПРЕПАРАТЫ(ПРОБИОТИКИ)
Пробиотики – живые микробные добавки, оказывающие благоприятные действия на организм человека и животного путем улучшения кишечного микробного баланса.
Пробиотики перспективны в качестве профилактических средств в сопутствующей терапии, но не являются лечебным средством. Применение пробиотиков может оказывать противоинфекционные, иммуномодуляторные воздействия на организм, повышать барьерные функции организма, препятствующие проникновению в него бактерий, вирусов, вредных веществ, стимулировать моторику и экскреторные функции кишечника.
Введенные с препаратами пробиотические штаммы взаимодействуют с сообществом бактерий кишечника и выделяют метаболиты, влияющие на организм хозяина.
Поколения пробиотиков:
1) Монокомпонентные препараты, содержащие 1 штамм бактерий (бифидумбактерин)
2) Самоэлиминирующиеся антагонисты: Bacillus (бактисубтил)
3) Комбинированные препараты, состоящие из нескольких штаммов бактерий или включающие добавки, усиливающие их действие (аципол)
4) Иммобилизованные на сорбенте живые бактерии (бифидумбактерин форте)
Самоэлиминирующиеся антагонисты – бактерии, являющиеся неспецифичными жителями ЖКТ, быстро выводятся из организма.
Наиболее перспективными являются комбинированные препараты, входящие в комплексный пробиотик штамма бактерий дополняют друг друга. Часто комплексы пробиотиков комбинируют с пребиотическими веществами.
Сорбированные пробиотики содержат бактерии, иммобилизованные на частицах твердого сорбента. За счет химических и электростатических сил взаимодействие таких форм со стенкой кишечника выше.
Наиболее часто используются природные сорбенты (угли, цианиды, кремнезёмы). Они обладают хорошей сорбционной и ионообменной способностью, имеют сильно развитый поверхностный каркас с порами разного диаметра и способны взаимодействовать с различными веществами и клетками пробиотика.
Микробная масса живых пробиотических бактерий, иммобилизованная на сорбенте, лучше выживает и быстрее заселяет кишечник. Такая форма препарата позволяет повысить защиту бифидо- и лактобактерий при прохождении через желудок, где обычные препараты, содержащие лиофильно высушенные клетки пробиотиков, теряют более 90% активности.
Препараты пробиотиков получают из производственных штаммов соответствующих бактерий, которые культивируются в ферментаторах с соблюдением стерильности. После накопления биомассы происходит ее отделение и лиофильное высушивание. Далее препарат подвергается стандартизации на эффективность и безвредность.
При получении иммобилизованных культур сначала проводят заселение сорбента, а потом подвергают лиофильной сушке.
В наст.время развивается представление о кишечной микробиоте как о самостоятельном органе, который в виде биопленки покрывает стенки кишечника. Биопленка – прочная система, препятствующая внедрению чужеродных штаммов. Коллективный иммунитет биопленки не позволяет в полной мере осуществить коррекцию с помощью препаратов живых культур пробиотиков, поскольку промышленные штаммы вследствие биологической несовместимости не могут войти компонентом в биопленку. Тем не менее введенные с препаратом пробиотические штаммы, выделяя метаболиты, вступают во взаимодействие с кишечной микрофлорой и выступают как антагонисты паразитов, простейших, гельминтов и транзиторных бактерий.
ПРЕБИОТИКИ
Пребиотики – препараты немикробного происхождения, способные оказывать позитивный эффект на организм человека или животного через селективную стимуляцию роста или усиление метаболической активности нормальной флоры кишечника.
В зависимости от химического строения пребиотики классифицируются на олигосахариды, гемицеллюлозы и т.д.
В 1957 году впервые были описаны свойства лактулозы как пребиотика, т.е. вещества с ярко выраженным бифидогенным эффектом.
Для того, чтобы вещество можно было охарактеризовать как пребиотик, оно не должно гидролизоваться ферментами и всасываться в верхних отделах ЖКТ, являться селективным субстратом для бактерий, обладать способностью изменять баланс кишечной микрофлоры в сторону, благоприятную для организма хозяина и индуцировать полезные эффекты на уровне организма.
Пребиотики производятся в промышленном масштабе. Исследования показали, что фруктоолигосахариды подвергаются избирательной ферментации большим числом штаммов бифидобактерий. Рост бифидобактерий на этих субстратах подавляет размножение патогенной микрофлоры. Этот эффект объясняется образованием в результате жизнедеятельности бифидобактерий молочной кислоты и созданием кислой среды, происходит секреция веществ, ингибирующих рост шигелл, сальмонелл и т.д.
Все пребиотики можно разделить по критериям:
1) Происхождение (натуральное вещество или полученное химической или другой модификацией природных компонентов)
2) Свойство и воздействие на организм человека или животного.
Пребиотики природного происхождения производятся из пищевого сырья. Они могут быть экстрагированы (галактоолигосахариды соевых бобов). Часть природных пребиотиков получают биотехнологическим путем. Так, ксилоолигосахариды получают путем частичного ферментативного гидролиза ксилонов пшеничных, овсяных, ржаных отрубей с использованием фермента эндоксиланазы из aspergillus arizae.
К пребиотикам неприродного происхождения относится лактулоза – изомер лактозы из молочной сыворотки, полидекстроза – вещество, получаемое термической поликонденсацией глюкозы.
Полидекстроза – пищевая добавка Е1200, она отнесена к добавкам, для которых нет суточной дозировки.
Лактулоза была открыта в 1920г. при изучении физических свойств углеводов и их структур конфигурации. Тогда из лактозы путем обработки ее щелочными растворами была получена лактулоза. Молекула лактулозы состоит из остатков галактозы и фруктозы, соединенных гликозидной связью. Этот синтетический дисахарид не встречается в природе. Лактулоза не всасывается в тонком кишечнике, а в толстом гидролизуется ферментами микрофлоры до моносахаридов, а затем до органических кислот, способствуя снижению pH. Одновременно снижается образование аммиака, повышается осмотическое давление кишечника, подавляется рост патогенной микрофлоры, которая является особо активной в производстве аммиака. Служит источником энергии для сахаролитических бактерий, которые используют аммиак для синтеза бактериального протеина.
БАКТЕРИОФАГИ
Бактериофаг – ультрамикроскопический объект корпускулярной природы, обладающий основными свойствами вирусов. Будучи вирусом бактерий бактериофаг способен репродуцироваться исключительно внутри бактериальной клетки. Во внеклеточном состоянии он неактивен.
В состав бактериофага входит нуклеиновая кислота, несущая в своей структуре наследственную информацию бактериофага и белок, защищающий нуклеиновую кислоту от внешних воздействий и обеспечивающий проникновение бактериофага внутрь бактерий.
Взаимодействие бактериофага с микробной культурой может проходить 2 путями:
1 путь присущ вирулентным фагам: А) Взаимодействие с поверхностью бактериальной клетки. Б) Проникновение нуклеиновой кислоты бактериофага внутрь бактерии. В) Синтез компонентов потомства бактериофага внутри клетки. Г) Лизис зараженных клеток и выход в среду большого количества вновь сформировавшихся фаговых частиц потомства бактериофага.
2 путь присущ умеренным фагам: Формирование между бактериофагом и клеткой хозяина симбиотических взаимоотношений. Взаимодействие бактериофага с бактериями не сопровождается лизисом бактериальных клеток. При этом большинство бактерий приобретает способность сохранять внутриклеточно и передавать из поколения в поколение бактериофаг без проявления его активности.
Действие фагов основывается на их специфичности, т.е. каждый бактериофаг способен размножаться только в определенном типе хозяина. На этом свойстве бактериофагов основано их использование для диагностики, профилактики и терапии ряда бактериальных инфекций.
При получении препаратов бактериофагов используют специальные производственные штаммы и соответствующие культуры бактерий. В жидкой питательной среде выращивают культуру, затем заражают её взвесью фага. Лизированную фагом культуру отделяют фильтрованием через бактериальные фильтры. К фильтрату добавляют консерванты. Препараты бактериофагов могут быть в виде прозрачных жидкостей или сухих таблеток.
В настоящее время производят: а) поливалентный дезинтерийный бактериофаг – смесь фильтратов фаголизатов шигелл Зонне, Флекснера. б) поливалентный сальмонеллезный жидкий бактериофаг. в) стафилококковый фаг.
ИНТЕРФЕРОНЫ
Интерфероны – индуцибельные белки, способные продуцироваться в любой ядерной клетке позвоночника. Они относятся факторам неспецифической резистентности, поддерживающего гомеостаз организма. Система интерферонов обладает регуляторной
функцией в организме, так как способна модифицировать различные биохимические процессы.
Повышенный интерес к интерферонам появился после того, как были опубликованы сообщения об успешном лечении некоторых форм злокачественных новообразований интерферона. До этого интерферон считался только антивирусным веществом. известно 3 основных действия интерферона: -антивирусная; -иммуномодифицирующая; - антипролиферативная. Описан также и радиопротективный эффект интерферона.
Система интерферона была открыта в 1957г. С тех пор в следствии фундаментальных исследований накоплен материал о свойствах интерферона, механизм его индукции, регуляции процессов.
Образование интерферонов осуществляется клетками позвоночника в ответ на воздействие индуцирующих факторов-индукторов интерферона.
Все известные в настоящие время индукторы разделены на 2 группы: природные и синтетические. К природным индукторам относится: вирусы (ДНК и РНК животных, насекомых, растений, бактерий); различные бактерии, простейшие, продукты жизнедеятельности микроорганизмов- эндотоксинов; продукты клеток (природный полифенол). К синтетическим относятся: низкомолекулярные соединения(основные красители, циклогексимид и тд); полимерные молекулы(полифосфаты).
На уровень продукции интерферона влияет: 1. Характер индуктора 2.тип продуцирующих интерферон клеток 3. Условия культивирования клеток.
Основой механизмом регуляции продукции интерферонов является генетическая. Первый этап регуляции осуществляется на уровне транскрипции, т.е. индуктор связывает репрессор и начинает траскребироваться матричной РНК интерферона.2 этап осуществляется на посттраскрипцеонном уровне, белок синтезирующий системы рибосом транслирует м-РНК интерферона и образуется интерферон.
Наиболее мощными продуцентами интерферона человека являются лейкоциты и макрофаги. Поэтому не смотря на то что под действием интерферона- индуктора способностью продуцировать интерферон обладают почти все ядерные клетки организма для практического получения препарата используют лишь некоторые конкретные клеточные системы.
В зависимости от клеток продуцентов интерфероны человека подразделяют на 3 группы:
1.α интерферон, продуцируемый лейкоцитами человека
2.β интерферон, продуцируемый диплоидными фибропластами
3.γ интерферон, продуцируемый Т-лимфоцитами человека
Каждый из интерферонов отличается своими особенностями, очищенный α-И. Является белком и имеет молекулярную массу от 16-23 тыс. дальтон. β-И это гликопротеид с молекулярной массой 20тыс. дальтон. γ-И гликопротеид 20-25 тыс. дальтон.
Выраженная гомологичность структуры всех интерферонов свидетельствует о возможности развития из одного предшественника.
Будучи естественными факторами защиты интерферонов усилено продуцентом при любой вирусной инфекции. Недостаточная интерферон -продукция приводит к тяжелому протеканию заболевания. Поэтому готовые препараты интерферонов применяется для лечения или стимуляции образования эндогенного интерферона в случае вирусных инфекций.
Получены положит-е результаты при использовании а-интерферонов при лечении онкологических больных. Применение в-интерферонов для этих целей дало менее выраженный результат.
Далее выяснилось, что различные формы злокачественных опухолей требуют лечения разными дозами разных интерферонов. Далее клинические исследования показали, что γ-И обладают наиболее сильными противоопухолевыми действиями, чем α и β интерфероны. Кроме того γ-И способен усиливать антивирусное и противоопухолевое действие β и α.
Получение α-И.
Способность лейкоцитов человека продуцировать интерферон была показана вскоре после открытия системы интерферона Айзексом и немного позже Грейсером.
Оптимальная методика для получения интерферонов в культуре лейкоцитов человека была разработана Кантеллом с соавторством Литодика заключается в следующем: Из крови доноров выделяют лейкоцитарную массу и подвергают культивированию в суспензии. Для этого используют специальную среду с добавлением 4% γ глобулиновой сыворотки.
К лейкоцитам в концентрации (5-10)*106клеток/мл в качестве индуктора добавляют вирус Сендаль в дозе 100-200гемаглютимирующих единиц на мл. среды.
Полученный интерферон отделяют от культуральной среды путем центрифугирования в течение 15 минут при 1000 оборотов в мин.
Очистку интерферона проводят методом хроматографии и др. способами.
Получение β-И.
Еще в 60-е годы было показано, что интерферон, продуцируемый кожно-мышечными фибробластами, по своим свойствам отличается от лейкоцитарного интерферона. В настоящее время для получения бета-интерферона используют диплоидные клетки человека. Супериндукцию осуществляют различными воздействиями. Среди них УФ излучение, воздействие нейтрально красным и тд.
Клетку продуценты выращ-т в виде монослойных культур.
Главной проблемой является увеличение поверхности используемой для роста клеток. С этой целью применяют различные варианты микроносителей.
Получение γ-И.
Гамма-интерферон является продуктом Т-лимфоцитов человека. Активизация т-лимфоцитов может быть вызвана __
Для получения больших количеств гамма-интерферона из периферической крови выделяют Т-лимфоциты и обрабатывают митогеном или антилимфоцитарной сывороткой. Культуры инкубируют в среде с человеческим альбумином. Интерферон выделяют из культуральной среды.
Недостатком является низкий выход целевого продукта (менее 1мгр. На 1 л. Донорской крови).
Интерфероны человека полученные путем генной инженерии.
1-ый ген интерферона был выявлен __
Класс α-И состоит из нескольких белков и число генов кодирующих эти белки 20. Β и γ представлены индивидуальными белками, которым соответствует 1 ген. Было предпринято несколько попыток соединить интерферон с комбинированными свойствами, использую тот факт, что гены семейства интерферона гомологичны, но различны по степени и специфичности своей активности. Теоретически это можно достичь соединив части последовательности генов различных интерферонов, что в свою очередь приведет к образованию гибридного белка с иными свойствами по сравнению с каждым из исходных белков.
Рекомбинантный интерферон получен генно-инженерным методом путем культивирования бактериальных штаммов, содержащих в своем генетическом аппарате ген интерферона человека. Для этого необходимо:
1. Ввести ген этого белка в векторно-бактериальную ДНК, присоединить к этому гену бактериальный регулятор. Элементы __ его транскрипцию и транскрипцию бактерии.
2. Создать условия для культивирования м-ов.
3. Разрушить прокариотическую клетку, очистить интерферон
4. лиофильно высушить препарат
Существуют методы получения интерферонов в результате экспрессии генов в клетках млекопитающих.
ИНСУЛИН
Инсулин является полипептидным гормоном. Общая характеристика функции инсулина состоит в том, что в мышцах, печени и жировой ткани он усиливает анаболитические и ингибирует катаболитические процессы. В частности, инсулин повышает скорость синтеза гликогена, жирных кислот, белков, а также стимулирует гликолиз. Важное значение имеет стимуляция проникновения глюкозы, ряда других сахаров, а также аминокислот в клетки мышц и жировой ткани. Способствуя входу глюкозы в указанные клетки, гормон снижает ее содержание в крови (так называемый гипогликемический эффект). в организме человека инсулин синтезируется в b-клетках островков Лангерганса поджелудочной железы. Поджелудочная железа, по сути дела, представляет собой два разных органа, объединенных в единую морфологическую структуру. Основная масса клеток поджелудочной железы выполняет экзокринную функцию, секретируя в просвет двенадцатиперстной кишки ферменты и ионы, необходимые для процессов пищеварения. Эндокринная часть железы состоит из 1 - 2 миллионов островков Лангерганса, на долю которых приходится 1 - 2 % всей массы поджелудочной железы. Островковый аппарат поджелудочной железы секретирует, по крайней мере четыре гормона: инсулин, глюкагон, соматостатин и панкреатический полипептид. Причем, каждый тип клеток ответственен за синтез только одного типа гормона.

Эти гормоны высвобождаются в панкреатическую вену, впадающую в воротную вену, что имеет очень важное значение, поскольку для инсулина и глюкагона печень служит главной мишенью. Основная роль этих двух гормонов сводится к регуляции углеводного обмена, однако они оказывают влияние и на многие другие процессы. Соматостатин впервые был идентифицирован в гипоталамусе как гормон, подавляющий секрецию гормона роста. Однако в поджелудочной железе его концентрация выше, чем в гипоталамусе. Этот гормон участвует также в локальной регуляции секреции инсулина и глюкагона. Панкреатический полипептид влияет на желудочно-кишечную секрецию.
История открытия
В 1889 году Меринг (Mering) и Миньковский (Minkowski) путем удаления поджелудочной железы получили экспериментальный диабет у собаки с развитием гликозурии, ацетонурии, гипергликемии, нарастающей слабости и резкого истощения, приводившего к гибели животного. В 1892 году Миньковский, пересаживая собаке ее собственную поджелудочную железу под кожу, задерживал у нее развитие диабета, симптомы которого быстро появлялись после удаления трансплантата. Вскоре было установлено, что инсулин, содержащийся в островках поджелудочной железы крупного рогатого скота и свиней, активен и у человека. В январе 1922 года инсулин впервые был применен для лечения больных сахарным диабетом. Бычий и свиной инсулин можно легко получать в больших количествах, что является важнейшим условием для успешного биохимического исследования. Именно инсулин оказался первым белком с доказанной гормональной активностью, первым белком, полученном в кристаллическом виде, первым белком, у которого была установлена аминокислотная последовательность. первым белком, синтезированным химическими методами.Именно для инсулина впервые было показано, что молекула может синтезироваться в виде более крупного предшественника. Кроме того, инсулин оказался первым белком, полученным для коммерческих целей с использованием технологии рекомбинантных ДНК.
Строение
Молекула инсулина - полипептид, состоящий из двух цепей А и В; цепи инсулина ковалентно связаны между собой двумя дисульфидными связями А7-В7 и А20-В19. Также в молекуле инсулина имеется еще одна дисульфидная связь у А-цепи: А6-А11. Локализация всех трех дисульфидных мостиков постоянна, а А- и В-цепи у представителей большинства видов имеют по 21 и 30 аминокислотных остатков соответственно. В обеих цепях во многих положениях встречаются аминокислотные замены, не оказывающие влияния на биологическую активность гормона, однако наиболее распространенными являются замены по 8, 9 и 10 положению А-цепи. Из этого следует, что данный участок скорее всего не имеет критического значения для биологической активности инсулина.
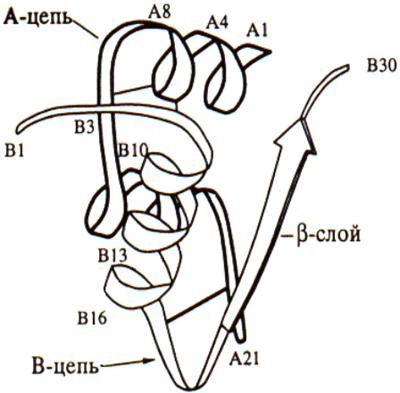
Однако некоторые участки и области молекулы обладают высокой консервативностью. К ним относятся:
1. положения трех дисульфидных мостиков;
2. гидрофобные остатки в С-концевом участке В-цепи;
3. С- и N-концевые участки А-цепи.
Использование химических модификаций и замен отдельных аминокислотных остатков в этих участках помогли идентифицировать структуру активного центра инсулина. Расположенный на С-конце В-цепи гидрофобный участок участвует также в димеризации инсулина.
Биосинтез инсулина
Проинсулин синтезируется в b-клеток островков Лангерганса поджелудочной железы в виде предшественника - препроинсулина (молекулярная масса 11500 Da).
Молекула предшественника в аппарат Гольджи и засщепляется. В результате образуется молекула проинсулина (молекулярная масса 9000 Da), принимающая конформацию, необходимую для правильного образования дисульфидных мостиков. В проинсулине обе инсулиновые цепочки скреплены молекулой соединительного пептида(С пептид).
Затем проинсулин расщепляется на инсулин, С-пептид и два дипептида. Затем депонируется в секреторных гранулах. Далее содержимое этих гранул секретируется в печеночную вену. До попадания в периферическую кровеносную систему, инсулин и С-пептид попадают в печень, где деградирует 50 % инсулина, в то время как С-пептид не подвергается никаким воздействиям.
Способы получения инсулина человека.
Исторически первым способом получения инсулина для терапевтических целей является выделение аналогов этого гормона из природных источников (островков поджелудочной железы крупного рогатого скота и свиней). В 20-х годах прошлого века было установлено, что бычий и свиной инсулины проявляют в организме человека активностьи поэтому долгое время для лечения пациентов, страдающих сахарным диабетом, применяли инсулины быка или свиньи. Однако через некоторое время было показано, что в ряде случаев в организме человека начинают накапливаться антитела к бычьему и свиному инсулинам, тем самым сводя на нет их действие.
2-ой метод полусинтетический. При этом способе получения инсулина человека в качестве исходного сырья использовали свиной инсулин. От очищенного свиного инсулина отщепляли С-концевой октапептид В-цепи, после чего синтезировали С-концевой октапептид человеческого инсулина. Затем его химически присоединяли, снимали защитные группы и очищали полученный инсулин. При тестировании данного метода получения инсулина было показана полная идентичность полученного гормона инсулину человека. Основной недостаток данного способа заключается в высокой стоимости получающегося инсулина.
В настоящее время инсулин человека, в основном, получают двумя способами: