Порядок выполнения работы
1) Изучить теоретический материал по работе.
2) Выписать и получить «набор химической посуды для выполнения качественных реакций».
3) Получить от преподавателя неизвестное вещество.
4) В лабораторном журнале оформить табл. 2.1 и 2.2, в последней не переписывая условия опытов.
5) Выполнить опыты, перечисленные в табл. 2.2. в строго приведенной последовательности, а наблюдаемые результаты записать в правую колонку таблицы. Требуемый реактив находят в штативе-лаборатории или в вытяжном шкафу по номеру, указанному в тексте после названия вещества (в скобках) и в табл. П.1.2.
6) Параллельно с исследованием известных веществ (табл. 2.1) анализируют полученное от преподавателя вещество, согласно алгоритма, приведенного на рис. 3 и в табл. 2.2. Наблюдаемый результат проводимых реакций записывают в правую колонку таблицы.
7) После проведения анализа установить класс соединения, к которому принадлежит выданное неизвестное вещество: алканы, алкины с тройной связью внутри цепи или алкены, алкины с тройной связью в конце цепи, арены без алифатической цепи, арены с алифатической цепью, галогенпроизводные углеводородов с галогеном в ароматическом кольце или в алифатической цепи.
8) Выписать и получить приборы для определения температуры кипения и показателя преломления. Определить температуру кипения (Т кип) и показатель преломления (nD 20) для анализируемого вещества.
9) Идентифицировать неизвестное вещество путем сопоставления табличных значений констант (см. табл. П.2.1–П.2.10) с экспериментально установленными. Результаты оформить в виде табл. 2.3.
10) После таблицы привести уравнения и признаки качественных реакций для идентифицированного соединения.

Рис. 3. Алгоритм определения углеводородов и галогенпроизводных
углеводородов
11) Защитить лабораторную работу выполнив контрольное задание в соответствии со своим вариантом (табл. 2.4).
В табл. 2.1 приведены углеводороды и галогенпроизводные углеводородов, анализ которых необходимо провести в данной лабораторной работе.
Таблица 2.1
Анализируемые соединения
| Название вещества | Класс органического соединения | Номер, соответствующий веществу в штативе-лаборатории |
| Гексан | алканы | |
| Гекс-1-ен | алкены | |
| Гекс-1-ин | алкины с тройной связью в конце цепи | |
| Толуол (метилбензол) | арены с алифатической цепью | |
| Бутилбромид (1-бромбутан) | галогенпроизводные углеводородов с галогеном в алифатической цепи | |
| Неизвестное вещество | необходимо установить | указывается преподавателем |
Оформление работы.
Лабораторную работу № 3 оформляют в соответствии с табл. 2.2, не переписывая условия опытов. Неизвестное вещество исследуют согласно алгоритму, приведенному на рис. 3, и вносят наблюдаемые результаты в таблицу только в том случае, если опыт с выданным веществом выполнялся (опыты 1–3 являются общими для всех веществ и проводятся обязательно).
Таблица 2.2
Свойства углеводородов и галогенпроизводных углеводородов
| Исследуемые вещества | Последовательность выполнения опытов. Физические свойства. Уравнения реакций. Замечания | Наблюдаемый эффект |
| 1. Исследование физических свойств веществ. Растворимость в воде и определение относительной плотности. | ||
| В пробирку вносят 2–3 капли органической жидкости, добавляют 1 мл холодной воды (1) и смесь встряхивают. Если жидкость расслаивается, то обращают внимание на то, над поверхностью или под слоем воды находится органическое вещество. По этому признаку определяют относительную плотность вещества (плотность воды при 4°С равна 1,0). |
Продолжение табл. 2.2
| гексан гекс-1-ен гекс-1-ин толуол бутил бромистый неизвестное вещество | 




| |
| 2. Горение органических веществ. Проба на свечение пламени | ||
| гексан гекс-1-ен гекс-1-ин толуол бутил бромистый неизвестное вещество | В маленькую металлическую ложечку помещают 2–3 капли вещества. Сжигание производят под тягой, постепенно продвигая ложечку в верхнюю бесцветную часть пламени горелки, и внимательно наблюдают за изменениями, происходящими с веществом. Отмечают: характер горения (медленное, быстрое, со вспышкой), цвет пламени, наличие и количество копоти. Чем больше массовая доля водорода в соединении, тем выше температура пламени при горении и больше вероятность полного сжигания содержащегося углерода без образования копоти (сажи).

| |
| 3. Проба Бейльштейна на галоген (открытие галогенпроизводных углеводородов с галогеном в алифатической цепи или ароматическом кольце) |
Продолжение табл. 2.2
| бутил бромистый неизвестное вещество | Медную проволоку, кончик которой загнут в петлю, тщательно прокаливают над пламенем горелки до покраснения. Петлю охлаждают, наносят каплю вещества, а затем петлю вносят в бесцветную часть пламени. Отмечают изменение цвета пламени.

| |
| 4. Реакция с бромной водой (открытие кратной связи в алкенах и алкинах) | ||
| гексан гекс-1-ен гекс-1-ин толуол | В пробирку наливают 0,5 мл бромной воды – 1%–ного водного раствора брома (2), затем постепенно добавляют 0,5 мл вещества, смесь энергично встряхивают. Наблюдают за изменением окраски слоев. При наличии в соединении кратной связи нижний слой бромной воды и верхний слой углеводорода обесцвечиваются.

 1,2–дибромгексан
1,2–дибромгексан
 1,1,2,2–тетрабромгексан
1,1,2,2–тетрабромгексан

| |
| 5. Реакция с перманганатом калия (реакция Вагнера) (открытие кратной связи в алкенах и алкинах) | ||
| гексан толуол | К 4–5 каплям вещества добавляют 4–5 капель 5%–ного раствора соды (4), а затем постепенно при встряхивании приливают 2–3 капли 1%-ного раствор перманганата калия (3). Пробирку встряхивают. Отмечают изменений окраски.


|
Продолжение табл. 2.2
| гекс-1-ен гекс-1-ин | 

| |
| 6. Реакция с раствором хлорида меди (I) (открытие алкина с концевой тройной связью) | ||
| гекс-1-ин | (Данный эксперимент проводят, если в соединении с помощью опытов 4 и 5 обнаружена кратная связь).
В пробирку помещают 3–4 капли вещества и по каплям доливают аммиачный раствор хлорида меди (I). Если появляются красно–бурые хлопья ацетиленида меди, значит вещество – алкин с концевой тройной связью.

| |
| 7. Нитрование арена в кольцо нитрующей смесью (открытие бензольного кольца) | ||
| толуол | (Реакцию проводят под тягой!). Первоначально готовят нитрующую смесь. Для этого в сухой широкой пробирке смешивают 3 капли концентрированной азотной и 6 капель концентрированной серной кислот (находятся в вытяжном шкафу). К полученной смеси добавляют 1–2 капли вещества, все тщательно перемешивают и осторожно при постоянном встряхивании нагревают пробирку до кипения на горелке. Затем охлаждают и добавляют 3–4 мл холодной воды (1) для разбавления кислот, взбалтывают и дают отстояться. Наблюдают образование твердого осадка или осаждение нерастворимой в воде тяжелой желтоватой маслянистой жидкости (плотность нитросоединений > 1).

|
Окончание табл. 2.2
| 8. Реакция с перманганатом калия в кислой среде (открытие аренов с алифатической цепью) | ||
| толуол | (Данный эксперимент проводят при положительной пробе на арены (опыт 7). В пробирку наливают 5 капель 1%–ного водного раствора перманганата калия (3), 8 капель 20%–ной серной кислоты (30), 5 капель воды (1) и после тщательного перемешивания добавляют 3 капли вещества. Пробирку сильно встряхивают и осторожно нагревают. Следят за изменением окраски.

| |
| 9. Реакция с нитратом серебра (открытие галогенпроизводных углеводородов с галогеном в алифатической цепи) | ||
| бутил бромистый | (Эксперимент проводят с веществом, которое дало положительный результат в опыте 3 (проба Бейльштейна)). В сухую пробирку наливают несколько капель 4%–ного спиртового раствора нитрата серебра (27), затем добавляют 3 капли вещества. Полученную смесь перемешивают и, если осадок не выпадает, то смесь осторожно нагревают до кипения.
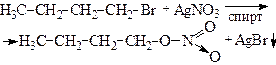 Галоген, связанный с ароматическим кольцом, в условиях этого опыта не замещается:
Галоген, связанный с ароматическим кольцом, в условиях этого опыта не замещается:

|
После выполнения данной части работы и оформления табл. 2.2 делают вывод о принадлежности неизвестного вещества к соответствующему классу соединений.
Последующую идентификацию неизвестного вещества проводят, определяя температуру кипения и показатель преломления, результаты вносят в табл. 2.3 и делают окончательный вывод о структуре и названии исследуемого вещества, а также приводят для него уравнения реакций для положительных опытов.
Таблица 2.3
Сравнение физических констант неизвестного вещества
и ближайших известных аналогов
| Данные | Класс соединения | Плотность | Т кип или | nD 20 | Структурная формула и название |
| полученные | |||||
| справочные | |||||
| Вывод: |