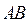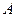По методу молекулярных орбиталей (ММО) молекула рассматривается как единое целое – ядра атомов составляют каркас молекулы, а электроны атомов становятся общими для всей молекулы и располагаются на молекулярных орбиталях (МО). Метод основан на следующих положениях:
1. Атомные орбитали (АО) могут образовывать МО, если их энергии близки по величине и симметрия относительно оси связи одинакова;
2. МО образуются в результате линейной комбинации АО (ЛК АО), то есть сложения или вычитания АО (метод ЛК АО): если МО образуется в результате сложения АО, то её энергия будет ниже, чем энергия исходных АО. Такая орбиталь называется связывающей МО (обозначается s, p или d в зависимости от типа перекрывания электронных облаков). В случае вычитания АО возникающая МО имеет большую энергию, чем исходная АО и называется разрыхляющей (обозначается s*, p* или d*). Электрон, находящийся на связывающей МО, обеспечивает связь между атомами, а электрон, находящийся на разрыхляющей МО, ослабляет связь между атомами;
3. Каждая МО характеризуется набором трех квантовых чисел. При заполнении электронами МО выполняются принцип Паули и правило Гунда;
4. Число МО равно числу взаимодействующих АО реагирующих атомов (например, при взаимодействии двух АО со стороны каждого атома в молекуле типа А 2 образуется четыре МО, из которых две - связывающие и две - разрыхляющие);
5. По возрастанию энергии МО двухатомных молекул первого периода и начала второго периода (до N2 включительно) можно расположить в следующий ряд: σ 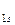 < σ
< σ  < σ
< σ 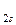 < σ
< σ  < π
< π  = π
= π  < σ
< σ 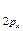 < π
< π  =
=
= π 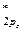 < σ
< σ 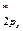 . МО двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
. МО двухатомных молекул конца второго периода по возрастанию энергии располагаются в несколько иной ряд:
σ 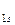 < σ
< σ  < σ
< σ 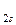 < σ
< σ  < σ
< σ 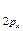 < π
< π  = π
= π  < π
< π  = π
= π 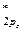 < σ
< σ 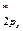 ;
;
6. Число связей (иначе порядок связи) n для двухатомных молекул определяют по формуле
 , (6)
, (6)
где  – количество электронов на связывающих МО;
– количество электронов на связывающих МО; 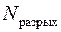 – количество электронов на разрыхляющих МО. С увеличением порядка связи в однотипных молекулах растет энергия связи и уменьшается ее длина;
– количество электронов на разрыхляющих МО. С увеличением порядка связи в однотипных молекулах растет энергия связи и уменьшается ее длина;
7. Если на МО имеются непарные электроны, то молекула обладает свойствами парамагнетика, если все электроны спарены, то она диамагнитна.
Образование молекул по ММО принято представлять в виде энергетических диаграмм (рис. 3). В средней части диаграммы изображены МО, а по краям расположены АО взаимодействующих атомов в соответствии с их энергиями. Связывающие МО всегда находятся ниже исходных АО, а разрыхляющие МО – выше, поскольку им соответствует более высокая энергия.
Образование химической связи можно также записывать через электронные конфигурации атомов и молекул. Например, образование химической связи в молекуле С2 может быть представлено следующим образом:
2С [1 s 22 s 22 p 2] → C2 [(σ 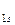 )2(σ
)2(σ  )2(σ
)2(σ 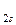 )2(σ
)2(σ  )2(π
)2(π  )2(π
)2(π  )2].
)2].

Рис. 3. Энергетическая диаграмма молекулы С2 по ММО.
Из энергетической диаграммы молекулы С2 (см. рис. 3) следует, что она диамагнитная, а порядок связи равен
 .
.
При описании по ММО двухатомных молекул, образованных разными по природе элементами, следует учитывать, что исходные АО одинаковых подуровней у взаимодействующих атомов будут обладать различными значениями энергии. У более электроотрицательного атома энергия АО несколько ниже, чем у атома с меньшим значением ЭО (рис. 4) Поэтому в таких молекулах связывающие МО располагаются ближе к АО атома с большим значением ЭО, а разрыхляющие – ближе к атому с меньшим значением ЭО. Разность b между энергиями АО взаимодействующих атомов характеризует полярность связи, а разность а между энергиями АО и ближайшей к атому МО характеризует ковалентность связи. Чем больше b (меньше а), тем больше полярность связи, то есть выше ее СИ и меньше СК.
|
|
|
|
|
|
|
|
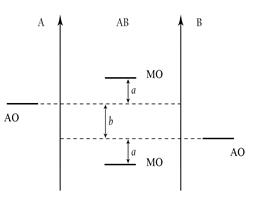
Рис. 4. Энергетическая диаграмма гетероядерной молекулы


А) б)
Рис. 5 Энергетические диаграммы СN– и NO.