КЛАССИФИКАЦИЯ БЕЛКОВ
Существуют несколько подходов к классификации белков: по форме белковой молекулы, по составу белка, по функциям. Рассмотрим их.
Классификация по форме белковых молекул
По форме белковых молекул различают фибриллярные белки и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых вытянуты вдоль одной оси и скреплены друг с другом поперечными сшивками (рис. 18,б). Эти белки отличаются высокой механической прочностью, нерастворимы в воде. Они выполняют главным образом структурные функции: входят в состав сухожилий и связок (коллаген, эластин), образуют волокна шелка и паутины (фиброин), волосы, ногти, перья (кератин).
В глобулярных белках одна или несколько полипептидных цепей свернуты в плотную компактную структуру – клубок (рис. 18,а). Эти белки, как правило, хорошо растворимы в воде. Их функции многообразны. Благодаря им осуществляются многие биологические процессы, о чем подробнее будет изложено ниже.
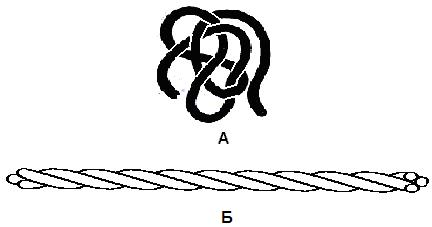
Рис. 18. Форма белковых молекул:
а – глобулярный белок, б – фибриллярный белок
Классификация по составу белковой молекулы
Белки по составу можно разделить на две группы: простые и сложные белки. Простые белки состоят только из аминокислотных остатков и не содержат других химических составляющих. Сложные белки, помимо полипептидных цепей, содержат другие химические компоненты.
К простым белкам относятся РНКаза и многие другие ферменты. Фибриллярные белки коллаген, кератин, эластин по своему составу являются простыми. Запасные белки растений, содержащиеся в семенах злаков, – глютелины, и гистоны – белки, формирующие структуру хроматина, принадлежат также к простым белкам.
Среди сложных белков различают металлопротеины, хромопротеины, фосфопротеины, гликопротеины, липопротеины и др. Рассмотрим эти группы белков подробнее.
Металлопротеины
К металлопротеинам относят белки, в составе которых имеются ионы металлов. В их молекулах встречаются такие металлы, как медь, железо, цинк, молибден, марганец и др. Некоторые ферменты по своей природе являются металлопротеинами.
Хромопротеины
В составе хромопротеинов в качестве простетической группы присутствуют окрашенные соединения. Типичными хромопротеинами являются зрительный белок родопсин, принимающий участие в процессе восприятие света, и белок крови гемоглобин (Hb), четвертичная структура которого рассмотрена в предыдущем параграфе. В состав гемоглобина входит гем, представляющий собой плоскую молекулу, в центре которой расположен ион Fe2+ (рис. 19). При взаимодействии гемоглобина с кислородом образуется оксигемоглобин. В альвеолах легких гемоглобин насыщается кислородом. В тканях, где содержание кислорода незначительно, оксигемоглобин распадается с выделением кислорода, который используется клетками:
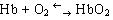 .
.
Гемоглобин может образовывать соединение с оксидом углерода (II), которое называется карбоксигемоглобином:
 .
.
Карбоксигемоглобин не способен присоединять кислород. Вот почему происходит отравление угарным газом.
Гемоглобин и другие гем-содержащие белки (миоглобин, цитохромы) называют еще гемопротеинами из-за наличия в их составе гема (рис. 19).

Рис. 19. Гем
Фосфопротеины
Фосфопротеины в своем составе содержат остатки фосфорной кислоты, связанные с гидроксильной группой аминокислотных остатков сложноэфирной связью (рис. 20).
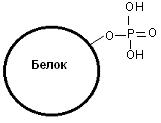
Рис. 20. Фосфопротеин
К фосфопротеинам относится белок молока казеин. В его состав входят не только остатки фосфорной кислоты, но и ионы кальция. Фосфор и кальций необходимы растущему организму в больших количествах, в частности, для формирования скелета. Кроме казеина, в клетках много и других фосфопротеинов. Фосфопротеины могут подвергаться дефосфорилированию, т.е. терять фосфатную группу:
фосфопротеин + Н2  протеин + Н3РО4
протеин + Н3РО4
Дефосфорилированные белки могут при определенных условиях быть снова фосфорилированы. От наличия фосфатной группы в их молекуле зависит их биологическая активность. Одни белки проявляют свою биологическую функцию в фосфорилированном виде, другие – в дефосфорилированном. Посредством фосфорилирования – дефосфорилирования регулируются многие биологические процессы.
Липопротеины
К липопротеинам относятся белки, содержащие ковалентно связанные липиды. Эти белки встречаются в составе клеточных мембран. Липидный (гидрофобный) компонент удерживает белок в мембране (рис. 21).

Рис. 21. Липопротеины в клеточной мембране
К липопротеинам относят также белки крови, участвующие в транспорте липидов и не образующие с ними ковалентную связь.
Гликопротеины
Гликопротеины содержат в качестве простетической группы ковалентно связанный углеводный компонент. Гликопротеины разделяют на истинные гликопротеины и протеогликаны. Углеводные группировки истинных гликопротеинов содержат обычно до 15 – 20 моносахаридных компонентов, у протеогликанов они построены из очень большого числа моносахаридных остатков (рис. 22).

Рис. 22. Гликопротеины
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани и т.д. Многие ферменты и транспортные белки являются гликопротеинами.