ОГЛАВЛЕНИЕ
Введение…………………………………………………………………………......6
1. Общие принципы организации везикулярного транспорта…………………...10
1.1. Понятие о везикулярном транспорте: определение,
его роль в клетке и в организме в целом…………………………………...10
1.2. Общее представление об основных транспортных путях: биосинтетическом (экзоцитозном) и эндоцитозном. Ретроградный и антероградный транспорт………………………………………………..….12
1.3. Основные стадии транспортного процесса ………………………………..15
1.4. Малые ГТФазы, принципы их действия…………………………………....18
1.5. Формообразование и везикулярный транспорт:
Роль липидов и белков………………………………………………………22
1.6. Методические подходы к изучению везикулярного транспорта………....24
2. Характеристика основных транспортных путей………………………………..28
2.1. Биосинтетический и экзоцитозный путь……………………………….......28
2.1.1. Основные компартменты биосинтетического пути: эндоплазматический ретикулум и аппарат Гольджи……. …………28
2.1.2. Прохождение грузов через Аппарат Гольджи. Обзор современных гипотез………………………………………………………………….30
2.1.3. Транс-сеть аппарата Гольджи – основная сортирующая стадия
биосинтетического пути……………………………………………....35
2.1.4. Секреторный, или экзоцитозный путь…………………………….….36
2.2. Эндоцитозный путь……………………………………………………….….38
2.2.1. Пути входа макромолекул в клетку……………………………….….38
2.2.2. Основные компартменты эндоцитозного пути. Ранние, рециклирующие и поздние эндосомы. Мультивезикулярные
тела. Лизосомы………………………………………………………...41
2.2.3. Общие принципы организации эндоцитозного пути………………..43
2.2.4. Ранние эндосомы – главная сортирующая стадия
эндоцитозного пути. Возможные механизмы сортировки
на путь рециклирования и лизосомной деградации………………....45
2.2.5. Проблемы идентификации ранних и поздних эндосом.
Современные представления об организации
эндоцитозного пути. Роль мультивезикулярных тел и лизосом………………………………………………………………....47
3. Формирование транспортных везикул…………………………………………..55
3.1. Окаймления и их типы……………………………………………………....55
3.2. СОРI окаймление…………………………………………………………….56
3.3 COPII-окаймление……………………………………………………………60
3.4. Клатриновые окаймления. Строение адапторных комплексов
семейства АР и GGA. Клатрин……………………………………………...61
3.4.1. Сборка GGA- и AP1-зависимых окаймлений………………………..64
3.4.2. Сборка AР3 окаймления………………………………………………65
3.4.3. Сборка AР4 окаймления………………………………………………66
3.4.4. Сборка и разборка АР2-окаймления……………………………….…67
3.4.5. Динамин – атипичная ГТФаза. Динамин-подобные белки…………72
3.4.6. Механизмы сортировки грузов в клатрин-окаймленные ямки……..74
3.4.7. Окаймления. Заключение………………………………….............76
4. Регуляция слияния мембран……………………………………………..………78
4.1. Характеристика компонентов системы NSF-SNAP-SNARE……………...80
4.1.1. Принцип действия SNARE-комплекса……………………………….82
4.2. Rab-белки, общая характеристика…………………………………….........86
4.2.1. Первый цикл после синтеза de novo ……………………………...86
4.2.2. Rab-белки в регуляции слияния мембран. Рабочий цикл……...88
4.3. Взаимодействие Rab-белков и SNARE в ходе слияния мембран.
3 фазы слияния. Возможные механизмы реорганизации
билипидных cлоев……………………………………………………...92
4.4. Полное слияние и полуслияние (semifusion).
Механизм «kiss-and-run». Реорганизация липидных
бислоев в процессе слияния…………………………………………...94
4.5. Rab- и SNARE- независимые механизмы слияния…………………...97
4.6. Роль ионов кальция в регуляции слияния……………………………..98
5. Rab-белки как “топ-менеджеры” клетки……………………………..…....103
5.1. Роль Rab-белков в транспортировке грузов………………………….103
5.2.. Rab-белки как организаторы мембранных территорий…………….104
6. Липиды и везикулярный транспорт……………………………………......108
6.1. «Трансмембранная» ассиметрия распределения липидов в мембранах………………………………………………………………..110
6.2 Латеральная ассиметрия распределения липидов в мембранах…….112
6.3. Липиды и формообразование………………………………………….116
6.4. Фосфатидилинозитиды как регуляторы транспортных процессов…………………………………………………………………....118
6.4.1. Фосфоинозитиды и экзоцитозный путь……………………………..121
6.4.2. Фосфоинозитиды на эндоцитозном пути. Механизм действия Vps34………………………………………………………………….122
6.4.3. Механизм действия фосфорилированых форм фосфоинозитида……………………………………….……………..125
7. Роль убиквитинирования в регуляции везикулярного транспорта белков….127
7.1.Типы убиквитинирования: моно-, мульти- и полиубиквитинирование.…………………………………………………..128
7.2. Убиквитин-конъюгирующая система. Деубиквитинирование.
Убиквитин-узнающие домены……………………………………………..130
7.3. Убиквитинирование и регуляция эндоцитоза. Убиквитинирование
белков-грузов и регуляторных белков…………………………………….133
7.4. Убиквитин-подобные белки, их роль в транспортных процессах.
Связь убиквитин-зависимых механизмов сортировки белков
с направлением инвагинации мембраны……………………………….…138
7.5 Убиквитинирование. Заключение……………………………………...140
8. АДФ-рибозилирование………………………………………………………….141
9. Роль цитоскелета в позиционировании органелл и транспортных процессах……………………………………………………………………..145
9.1. Типы цитоскелета, их основные характеристики…………………...145
9.2. Цитоскелет и позиционирование органелл………………………………………………………………….….148
9.3. Цитоскелет в транспортных процессах…………………………………...150
9.3.1. Цитоскелет и транспорт по антероградному пути………….…151
9.3.2. Цитоскелет и эндоцитозный путь…………………………….…152
9.3.3. Роль цитоскелета и везикулярного транспорта
в обеспечении пигментации кожи и мимикрии………………..157
10. Везикулярный транспорт в митозных клетках……………………………….160
11. Регуляция эндоцитоза рецепторов ЭФР как пример функционирования транспортной машинерии ……………………………………………………..162
12. Эндоцитоз и передача сигнала………………………………………………...173
13. Патологии, связанные с нарушением функционирования
транспортных систем…………………………………………………………..178
Заключение…………………………………………………………………………183
Библиографический список…………………………………………………..........184
ВВЕДЕНИЕ
Везикулярный транспорт, или перемещение макромолекул в составе мембранных пузырьков (везикул, англ. vesicles) между компартментами клетки, является одним из базовых клеточных процессов. При формировании транспортных везикул, их реорганизациях, слияниях постоянно происходят процессы формообразования – разнонаправленные искривления мембран, тубуляция, уплощение или набухание, и др. Строго говоря, все эти процессы можно симулировать в модельных системах на искусственных бислойных липидных везикулах, формируя их в буферах различного состава, подвергая осмотическому давлению, действию электрического поля, другим факторам физико-химической природы. Однако, несколько многочисленных групп белков во взаимодействии с липидами придают процессу очень высокую степень специфичности, определяя время и место данного транспортного события, не позволяя упаковать в везикулу «неправильный» груз или ошибиться с адресом его доставки. Такие белки часто объединяются под общим названием «транспортной машинерии», и в настоящем пособии о них будет подробно рассказано.
Достижения последних лет показывают, что регуляторные транспортные белки способны также реагировать на активацию или деактивацию различных сигнальных каскадов, а транспортируемые грузы часто принимают самое деятельное участи в организации собственной внутриклеточной судьбы. Таким образом, механизмы везикулярного транспорта часто выступают как элемент общей координации внутриклеточных процессов, позволяющих клеткам тонко реагировать на сигналы различной природы и на изменение внешней обстановки, повышая возможности адаптации.
Важность везикулярного транспорта для нормальной жизнедеятельности эукариотической клетки, да и организма в целом, подчеркивает тот факт, что целый ряд инфекционных агентов (бактерий и вирусов) поступают в клетки с помощью везикулярного транспорта и обладают способностью изменять работу отдельных элементов транспортных путей. Выявлен целый ряд генетически наследуемых заболеваний, связанных с дефектами в белках-регуляторах везикулярного транспорта, приводящих к дисфункции транспортных путей, нарушению механизмов сортировки молекул или их правильной доставки.
Хотя такие понятия, как пиноцитоз, фагоцитоз, секреция, слышал практически каждый школьник, можно сказать, что везикулярному транспорту как области исследований в нашей стране не повезло. Действительно, бурный всплеск интереса научного сообщества к различным аспектам везикулярного транспорта пришелся на конец 80х–90-е годы XX в., поскольку сама логика развития исследований привела к пониманию существования взаимосвязи между внутриклеточной сигнализацией, канцерогенезом, регуляцией клеточной подвижности, функционированием ионных каналов и т.д. с процессами везикулярного транспорта. К сожалению, в этот период в России, в условиях недостаточного финансирования науки, трудно было говорить о развитии новых напрвлений. С этим обстоятельством связана некоторая недооценка российскими учеными роли везикулярного транспорта в регуляции жизнедеятельности клетки, а как следствие – определенные проблемы с русскоязычной терминологией. Для многих англоязычных понятий не нашлось пока устоявшихся русских терминов, поэтому в тексте будут приводиться при необходимости и английские варианты названий.
«Недооцененность» понимания важности везикулярного транспорта для нормальной жизнедеятельности клетки особенно очевидна в планах преподавания биологических дисциплаин в технических вузах, готовящих специалистов для работы в области медицины и биотехнологии. Разрабатывая новые физические методы и приборы для использования в вышеупомянутых областях, необходимо понимать, как «работает» клетка в целом, что невозможно без знаний о базовых внутриклеточных процессах. К сожалению, русскоязычных источников, суммирующих существующие представления об этом процессе, нет. Настоящее пособие представляет собой первую такую попытку, не претендуя, однако, на полный охват темы. Так, представленные данные касаются в основном клеток животного происхождения как наиболее исследованных.
Из общих соображений хочется отметить еще следующее: как всегда бывает в науке, развитие представлений о каком-либо процессе идет от более простого к более сложному. Например, ранние представления о роли белков сводились к тому, что именно они несут основную функциональную (регуляторную, сигнальную) нагрузку в клетке, тогда как липидные мембраны являются пассивной платформой, предоставляющей «твердую почву» для регулируемых белками событий. Однако более глубокое проникновение в мир клеточных липидов смешало все карты в этой игре. Оказалось, что липиды принимают весьма активную роль в регуляции клеточных функций, и стало подчас непонятно, кто именно – белки или липиды, – играют ключевую роль в рассматриваемом процессе. Ситуация стала напоминать «проблему курицы и яйца», и если с научной точки зрения становится все более ясно, насколько все в клетке взаимосвязано, с точки зрения последовательного изложения материала возникают дополнительные трудности. В связи с этим данное пособие условно делится на три части: в первой даются некоторые общие представления о предмете и достаточно подробно описывается «феноменология» основных транспортных путей. Обсуждаются также основные гипотезы, их касающиеся. Во второй части будут описаны молекулярные механизмы формирования транспортных везикул, их адресной доставки, регуляции слияния и т. д. – т. е. процессы, в которых участвуют функционально сходные группы белков. Отдельная глава будет посвящена липидам мембран, их роли в везикулярном транспорте и координации их работы с белками, хотя эта тема поневоле затрагивается во многих частях пособия. Будут приведены данные по взаимодействию везикулярного транспорта и цитоскелетных структур клеток. В третьей части на примере эндоцитоза рецепторов ростовых факторов будут сведены воедино все описанные выше механизмы и дана, насколько это возможно, интегральная картина работы всех компонентов-регуляторов везикулярного транспорта и роли его в сигнальных процессах. Будут также рассмотрены частные случаи, такие как фагоцитоз и аутофагия, и описаны некоторые патологии, связанные с нарушениями работы «транспортной машинерии».
1. ОБЩИЕ ПРИНЦИПЫОРГАНИЗАЦИИ ВЕЗИКУЛЯРНОГО ТРАНСПОРТА
1.1. ПОНЯТИЕ О ВЕЗИКУЛЯРНОМ ТРАНСПОРТЕ: ОПРЕДЕЛЕНИЕ, ЕГО РОЛЬ В КЛЕТКЕ
И В ОРГАНИЗМЕ В ЦЕЛОМ
В общем случае под везикулярным транспортом подразумевается перенос белков от одного внутриклеточного компартмента к другому с помощью мембранных везикул. Транспортируемые белки принято называть белками-грузами, или карго (англ. cargo). Однако это определение следует считать несколько упрощенным, поскольку, во-первых, взаимодействие белков с липидами, составляющими мембрану везикулы, делают последние полноправным «грузом». Во-вторых, не всегда перенос осуществляется именно везикулами, т. е. пузырьками; некоторые транспортные пути обслуживаются длинными тубулярными структурами.
Везикулярный транспорт является одним из базовых процессов, свойственных живым организмам. Его значение чрезвычайно велико и многообразно.
Во-первых, везикулярный транспорт в отдельной клетке «работает» на организм в целом, опосредуя такие физиологически значимые процессы, как стимулируемая секреция, фагоцитоз, передача сигналов, синаптическая передача, участие в иммунном ответе.
Во-вторых, без везикулярного транспорта невозможно существование и функционирование многих жизненно важных органелл (например, зрелые гидролитические ферменты транспортируются в лизосомы из аппарата Гольджи). Именно благодаря везикулярному транспорту эукариотическая клетка имеет характерный для нее набор и вид компартментов, поскольку механизмы везикулярного транспорта обеспечивают гомеостаз внутриклеточных органелл, поддерживая постоянный состав белков и липидов, характерных именно для данной органеллы и позволяющей ей выполнять определенную функцию (так называемые «резидентные молекулы»). Кроме того, везикулярный транспорт участвует в таких подчас неожиданных процессах, как быстрое закрытие разрывов мембран скелетных мышц при повреждении в результате больших физических нагрузок, формирование разделяющих мембран после деления клеток, перемещение клетки по субстрату.
Учитывая, что через многие органеллы идет постоянный поток белков-грузов (например, через аппарат Гольжи (АГ) проходят вновь синтезированные белки, подвергаясь ряду модификаций, или «созревая», там синтезируется ряд липидов, доставляемых впоследствии в разные пункты конечного назначения), для поддержания идентичности компартментов клетка должна «уметь» различать резидентные молекулы и молекулы-грузы, оставляя в составе мембраны первые и исключая вторые. Можно говорить о том, что в процессе везикулярного транспорта идет постоянная сортировка макромолекул, и существующие молекулярные механизмы регуляции этого процесса выполняют свою работу с высокой точностью. Более того, транспортные потоки «в» органеллу и «из» нее строго сбалансированы. Именно тонко регулируемый баланс этих потоков позволяет нам думать, что в клетке существуют стабильные компартменты. Ярким примером является действие токсина Брефельдина А, который блокирует транспорт из цис-Гольджи в эндоплазматический ретикулум (ЭПР), не влияя на транспорт из ЭПР в АГ. Уже через 5 мин после добавления Брефельдина мембраны аппарата Гольджи начинают тубулироваться и затем полностью смешиваются с мембранами ретикулума. АГ исчезает.
1.2.ОБЩЕЕ ПРЕДСТАВЛЕНИЕ ОБ ОСНОВНЫХ ТРАНСПОРТНЫХ ПУТЯХ: БИОСИНТЕТИЧЕСКОМ (ЭКЗОЦИТОЗНОМ) И ЭНДОЦИТОЗНОМ. РЕТРОГРАДНЫЙ И АНТЕРОГРАДНЫЙ ТРАНСПОРТ
Практически все компартменты клетки связаны друг с другом транспортными путями. До недавнего времени лишь митохондрии исключались из этого списка. Однако и на их мембранах были обнаружены некоторые регуляторные транспортные белки (хотя прямых доказательств слияния мембран транспортных везикул и митохондрий нет).
Тем не менее, два пути рассматриваются в качестве основных: это путь, который проходят образующиеся de novo белки, после синтеза на рибосомах попадающие в люмен (внутреннее пространство) ЭПР, упаковывающиеся там, в транспортные везикулы и направляемые к цис-цистерне АГ. Этот участок пути получил название биосинтетического. Проходя через АГ, белки модифицируются, и по достижении последней цистерны или тубуло-везикулярной транс-сети АГ (TGN, trans-Golgi network, транс-Гольджи), сортируются и упаковываются в везикулы, судьба которых может быть различна. Так, если белки должны секретироваться во внешнюю среду, они упаковываются в крупные (до 500 нм) неправильной формы секреторные ганулы, и тогда этот участок пути называется секреторным. Если же белки должны просто встроиться в плазматическую мембрану (ПМ) и функционировать там (в этом случае транспортные везикулы формируются из определенных доменов последней цистерны), то применяют термин «экзоцитоз», хотя оба эти названия часто не разделяют, и обе части пути от ЭПР до ПМ называют в общем случае экзоцитозным. Везикулы, образованные в транс-Гольджи, могут направляться в эндосомы и лизосомы. Таким образом, пункт конечного назначения может находиться как вне клетки, так и внутри нее, однако в любом случае он начинается в клетке. Исторически этот путь целиком называют «антероградным». Наиболее существенным является то, что основной сортирующей станцией антероградного пути являются мембраны TGN.
Противоположный ему путь, «ретроградный», или эндоцитозный, начинается с плазматической мембраны. Этот путь, обеспечивающий связь клетки с внешней средой, используют макромолекулы и частицы, не способные проникать непосредственно через мембрану, а также многие трансмембранные белки. Эти макромолекулы, после упаковки в пузырьки, или первичные эндосомы, отпочковываются от плазматической мембраны в ходе процесса, называемого интернализацией. Первичные эндосомы, несущие разный груз, сливаются, и их содержимое оказывается в так называемых ранних эндосомах, являющихся основной сортирующей станцией эндоцитозного пути, дающей начало нескольким транспортным путям. Во-первых, груз, доставленный в ранние эндосомы, может быть упакован в пузырьки, возвращающиеся на мембрану (путь рециклирования). Во-вторых, из ранних эндосом берет начало трансцитозный путь, в ходе которого груз переносится через цитоплазму в немодифицированном виде и доставляется на сторону, противоположную месту входа. Примером может служить перенос иммуноглобулинов через эндотелиальные клетки, выстилающие кишечник. Альтернативой трансцитозу и рециклированию является путь лизосомной деградации, связанный с попаданием грузов в поздние эндосомы, или прелизосомы, и далее в лизосомы. Этот путь наиболее важен тем, что его проходят многие сигнальные рецепторы. Терминологически, под эндоцитозным путем часто понимают именно путь лизосомной деградации, хотя доля грузов, эндоцитируемых клеткой и проходящих этот путь, весьма мала (порядка 10–20 %) по сравнению с путем рециклирования. Частным случаем эндоцитоза с доставкой в лизосомы является фагоцитоз. Пути рециклирования и лизосомной деградации осуществляются во всех клетках, тогда как такие пути, как трансцитоз или фагоцитоз реализуется в основном в определенных типах клеток. Интересно, что в поляризованных клетках существуют две независимые, неспособные сливаться друг с другом, субпопуляции ранних эндосом – апикальные и базолатеральные, тогда как популяция поздних эндосом только одна (рис. 1).
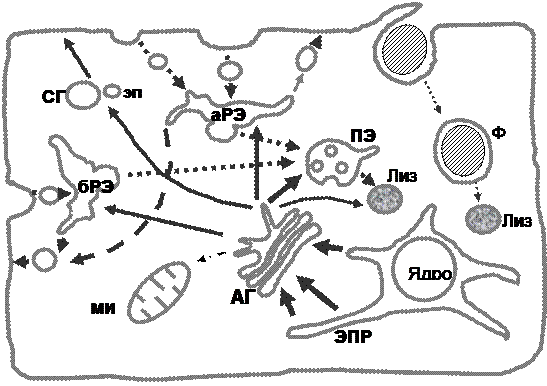
Рис. 1. Схематичное представление основных
внутриклеточных транспортных путей:
АГ – аппарат Гольджи, ЭПР – эндоплазматический ретикулум;
Лиз – лизосомы, Ф – фагосома; аРЭ и бРЭ – апикальная и
базолатеральная РЭ -ранняя эндосома, соответственно; мит –
митохондрия; ПЭ – поздняя эндосома; СГ – секреторная гранула;
эп – экзоцитозный пузырек. Существует и
путь, ведущий от плазматической мембраны в ЭПР и АГ
Ретроградный и антероградные пути существуют не изолированно, имея много точек пересечения. Так, подавляющее большинство лизосомных гидролаз доставляется из TGN в лизосомы не напрямую, а через поздние эндосомы. Некоторые лизосомные ферменты включаются в ранние эндосомы, а другие, секретируясь, затем проходят весь эндоцитозный путь, прежде чем достигнуть основного места своей работы. С другой строны, от эндосом также могут отщепляться везикулы, переносящие груз в транс-Гольджи.
1.3. ОСНОВНЫЕ СТАДИИ ТРАНСПОРТНОГО
ПРОЦЕССА
Условно любой транспортный процесс можно разбить на несколько стадий (рис. 2).
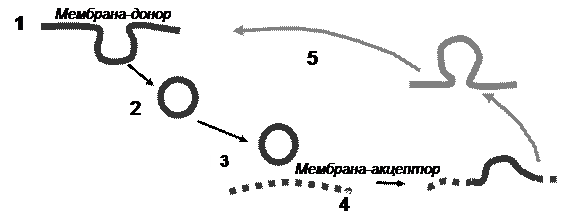
Рис. 2. Основные стадии транспортного процесса.
1 – формирование транспортного пузырька (везикулы) на
исходной мембране (мембрана-донор); 2 – транспортировка
везикулы к мембране-мишени (мембрана-акцептор); 3 – узнавание/ нацеливание/заякоривание (recognition/targeting/thethering/docking);
4 – слияние (fusion); 5 – рециклирование транспортных
регуляторных белков обратно в мембрану-донор
На стадии 1 на мембране исходного ― донорного компартмента, или донорной мембране, формируется инвагинация (почка, bud), дающая начало транспортной везикуле после отшнуровки от мембраны (budding). В нее включаются молекулы- грузы и компоненты регуляторной транспортной машинерии, определяющие специфичность доставки данной везикулы. После завершения формирования и отщепления от мембраны везикула транспортируется, иногда на весьма значительные в масштабе клетки расстояния. В этой транспортировке, как правило, участвуют цитоскелет и моторные белки (стадия 2), хотя зависимость отдельных транспортных стадий от наличия цитоскелетных структур может различаться. На стадии 3 везикула должна подойти к мембране-мишени, или акцепторной мембране, «убедиться» в том, что мембрана «правильная», и провзаимодействовать с ней. В отношении этих процессов, в совокупности получивших название «стыковка, или докинг» (docking), употребляются термины «узнавание» (recognition), «нацеливание» (targeting), «заякоривание» (anchoring, tethering).
Выбор того или иного термина достаточно условен и определяется, в основном, вкусами конкретного исследователя.
Третья стадия плавно перетекает в основную стадию – процесс слияния (стадия 4), которая также имеет две фазы, описанные в соответствующей главе. В результате мембрана везикулы вместе с мембранными белками встраивается в мембрану-мишень, содержимое жидкой фазы переходит в люмен акцепторного компартмента, или, вслучае секреции, выбрасывается в окружающую среду.
Однако следует помнить, что доставкой груза к мембране-мишени транспортный процесс не заканчивается, поскольку без рециклирования всех регуляторных компонентов, определявших предыдущие стадии, транспорт по определенному пути мог бы осуществляться только до тех пор, пока все эти компоненты не истощились бы на мембране-доноре. Таким образом, любой транспортный процесс является циклическим, и после слияния с акцепторной мембраной регуляторные белки отсортировываются в ту область мембраны акцепторного компартмента, где формируются пузырьки, направляемые в «обратный путь», или путь рециклирования (стадия 5).
Хотя в некоторых случаях транспортные везикулы могут захватывать и переносить растворимые белки (например, при пиноцитозе), в подавляющем большинстве даже такие белки «жидкой фазы» транспортируются в связанном с мембраной состоянии. Как правило, белки, направляемые в один и тот же компартмент, несут на себе определенные сигналы локализации, узнаваемые специальными мембранными рецепторами. Эти рецепторы, взаимодействуя с компонентами формирующейся везикулы, как структурными, так и регуляторными, обеспечивают сортировку определенного класса белков в соответствующие переносчики. Например, различные лизосомные ферменты, как правило, несут на себе маннозо-6-фосфат (М-6-Ф), и узнаются рецепторами к М-6-Ф, локализованными в мембранах TGN. Это делает возможным упаковку гидролаз разных типов в одну и ту же везикулу, направляемую в поздние эндосомы. Белки ЭПР, участвующие в регуляции биосинтетического пути и доставляемые с грузом в цис-Гольджи, как правило, имеют мотив KDEL или KKXX, который позволяет «вылавливать» их по прибытии в цис-цистерну, заякоривая с помощью так называемого KDEL-рецептора и рекрутируя в везикулы, направляемые обратно в ЭПР.
Таким образом, «единичный транспортный цикл» заключается в: (1) формировании транспортной везикулы на мембране донорного компартмента; (2) ее транспортировке к акцепторному компартменту; (3) узнавании везикулой мембраны-мишени и взаимодействии с ней (докинге); (4) слиянии мембран (т. е. реорганизации билипидных слоев) и переходе груза в акцепторный компартмент) и (5) рециклировании регуляторных белков обратно в компартмент-донор. Очевидно, что и рециклирование состоит из тех же 4х стадий.
Весь этот процесс обеспечивает множество белков, среди которых можно выделить несколько основных групп. Так, на первой стадии работают так называемые «окаймления» (coats), в везикулу также включаются белки, опосредующие специфическое узнавание и слияние (Rab-белки и SNARE-комплексы). Грузы и рецепторы грузов также играют активную роль в формировании везикулы, в основном, в придании ей «адресных свойств». Транспортировка подразумевает участие микротрубочек и в ряде случаев актиновых филаментов, а также их моторных белков. Стадия докинга и слияния опосредуется Rab-белками и их эффекторами и SNARE-системой. Рециклирование регуляторных компонентов, по сути, является зеркальным отражением всех вышеописанных процессов, с учетом того, что и окаймления, и белки слияния используются другие.
1.4. МАЛЫЕ ГТФАЗЫ, ПРИНЦИПЫИХ ДЕЙСТВИЯ
Этот класс белков настолько широко вовлечен в регуляцию клеточных функций, и в том числе, разных стадий транспортных процессов, что выделение их описания в отдельную главу просто необходимо для упрощения дальнейшего изложения.
Где бы они ни функционировали, принципы их строения и действия имеют общий характер. Эти белки объединяются в суперсемейство малых ГТФаз, или Ras-подобных белков, состоящее из семейств Ras, Rab, ARF, Rac, Rho и Ran (рис. 3), которые высоко консервативны от дрожжей до млекопитающих. Ras-семейство участвует в проведении сигналов, приводящих к регуляции активности генов, Ran занимается импортом белков в ядро, члены семейств Rab и ARF так или иначе участвуют в регуляции везикулярного транспорта и процессов сортировки белков, Rho и Rac опосредуют реорганизации цитоскелета в ответ на различные сигналы и отчасти также вовлечены в регуляцию транспорта. Их называют малыми ГТФазами в отличие от тримерных ГТФаз, которые обычно обозначают термином «G-белки».
Эти небольшие (20–30 кДа) мономерные белки (рис. 4) имеют высококонсервативный домен на N-конце, составляющий основную часть последовательности и содержащий четыре участка (G1-4), которые при формировании третичной структуры образуют гуанин-нуклеотид-связывающий карман, способный взаимодействовать как с гуанин-нуклеотид-трифосфатом (ГТФ), так и с гуанин-нуклеотд-дифосфатом (ГДФ). Ближе к С-концу локализован гипер-вариабельный участок (30–40 ао), отвечающий за специфичность взаимодействия с определенной мембраной. К С-терминальному остатку цистеина малых ГТФаз присоединен гидрофобный изопренильный «хвост», что позволяет белку непосредственно взаимодействовать с липидной мембраной.
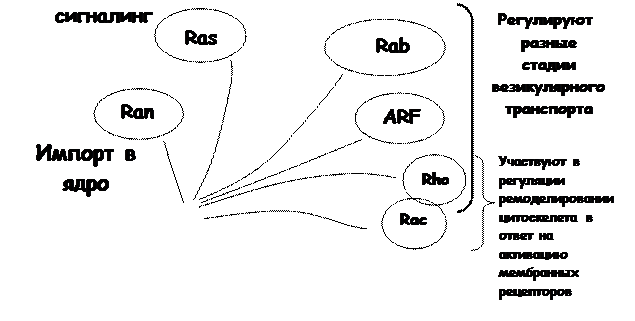
Рис. 3. Суперсемейство малых Ras-подобных ГТФаз
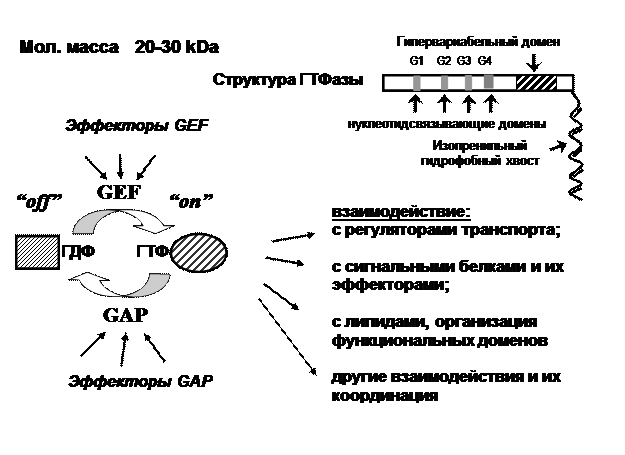
Рис. 4. Структура и принцип действия малых ГТФаз
Если первая часть их названия («малые») объясняется действительно небольшим размером молекулы, то отнесение этих белков к классу ГТФаз является некоторым преувеличением, поскольку их собственная базальная ферментативная активность чрезвычайно низка. Так, наиболее «быстрому» из всех белков суперсемейства, Ras, требуется 50 мин для самостоятельного расщепления одной молекулы ГТФ, и около 9 ч на замену ГДФ на ГТФ. Остальные члены суперсемейства справляются с гидролизом еще медленнее. Фактически, гидролиз ГТФ на Ras-подобном белке происходит в результате присоединения к нему ГТФаза-активирующего белка (GAP, G TPase a ctivating p rotein), а для замены ГДФ на ГТФ требуется фактор обмена нуклеотидов GEF (g uanine nucleotide e xchange f actor). GAP и GEF составляют систему эффекторов первого уровня малых ГТФаз и определяют ее связывание с ГТФ или ГДФ. Физиологический смысл функционирования малых ГТФаз сводится к тому, что в ГДФ-связанном состоянии белок локализован в цитоплазме (за редким исключением) и неактивен, а в связанной с ГТФ форме – встроен в мембрану и активирован. Активация и инактивация малых ГТФаз зависит, таким образом, от связанного нуклеотида и определяется способностью изменять конформацию внутреннего высококонсервативного эффекторного домена при взаимодействии с GAP. Таким образом, переходя из «активного» состояния в«неактивное» и обратно, малые ГТФазы выступают в качестве таймеров определенных взаимодействий, работая как молекулярные переключатели. В свою очередь, активация и GEF, и GAP находится под контролем ряда эффекторов второго уровня, участвующих в передаче сигналов. В результате, циклы везикулярного транспорта координируются с остальными процессами, протекающими в клетке.
Каждая малая ГТФаза имеет, как правило, более чем один набор GEF- и GAP-факторов, что определяет, с одной стороны, специфичность, а с другой – множественность процессов, в которых она участвует. В свою очередь, большинство эффекторов первого уровня могут взаимодействовать с более чем одной ГТФазой. Все в совокупности дает возможность координации многих процессов, например, сигнальных и транспортных.
Следует обратить внимание на то, что понятие «активная малая ГТФаза» в биохимическом и функциональном смысле существенно различается. В первом случае подразумевается активация процесса гидролитического расщепления ГТФ, т. е. ГТФаза рассматривается как фермент. Однако, как уже отмечалось, собственная ферментативная активность малых ГТФаз чрезвычайно низка.
С функциональной же точки зрения ключевым моментом работы всех малых ГТФаз является их способность существовать в двух формах: ГДФ-связанной и ГТФ-связанной. Смена нуклеотидов связана с изменением конформации малой ГТФазы, что делает возможным ее взаимодействие с большим количеством разнообразных белков-партнеров, набор которых специфичен для каждого члена суперсемейства. Именно эти белки и осуществляют работу, сигнал к началу которой подает «активированная» малая ГТФаза.
Фактически, малые ГТФазы являются «распорядителями и организаторами» внутриклеточных процессов: ничего не производя «собственными руками», они включают или выключают действие своих партнеров – именно поэтому их часто называют «голубыми воротничками», или «топ-менеджерами» внутриклеточных процессов.
Несомненно, «круг обязанностей» каждой малой ГТФазы достаточно четко очерчен и специфичен, однако их роль в регуляции клеточных функций трудно переоценить. Далее, в курсе будут обсуждаться конкретные примеры, но всегда следует иметь ввиду, что под «активной» малой ГТФазой подразумевается ее ГТФ-связанная форма, тогда как под «неактивной» – белок, связанный с ГДФ.
1.5. ФОРМООБРАЗОВАНИЕ И ВЕЗИКУЛЯРНЫЙ ТРАНСПОРТ. РОЛЬ ЛИПИДОВ И БЕЛКОВ
До того, как перейти к описанию молекулярных механизмов регуляции везикулярного транспорта, важно, чтобы читатель имел в виду одно существенное обстоятельство, которое уже упоминалось во Введении. Рассматривая клеточные компартменты, можно найти относительно небольшое число форм (рис. 5).
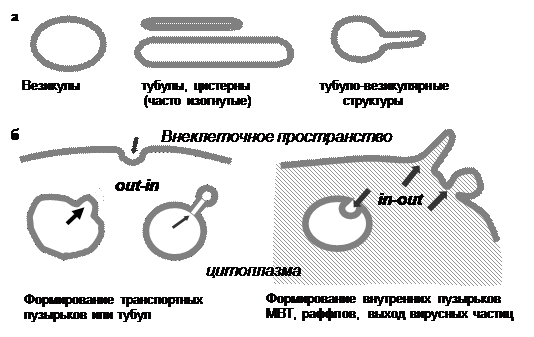 |
Рис. 5. Формы мембранных структур: (а) – встречающиеся
в клетке; (б) – возможные направления инвагинации
мембран
Действительно, несколько упрощая, можно сказать, что мембранные органеллы могут иметь форму везикулы, т. е. шара с кривизной поверхности, зависимой от диаметра пузырька (от 50 до 5000 нм), трубочки, или тубулы – цилиндрической замкнутой структуры, диаметр которой, как правило, сравним с диаметром самых маленьких везикул (50–100 нм), а длина существенно больше диаметра; уплощенной везикулы или тубулы (например, цистерны аппарата Гольджи или тубулы ЭПР). Везикулы могут отличаться по форме от идеального шара, часто значительно, а тубулы – различаться по длине и искривленности; кроме того, возможны различные комбинации этих форм, например, тубуло-везикулярные структуры довольно широко распространены в клетке.
Довольно долго считалось, что липидные мембраны приобретают и поддерживают ту или иную форму исключительно под влиянием мембранных белков. Однако эксперименты по формированию искусственных билипидных липосом с единым внутренним пространством, так называемые LUVs (L arge U nilamellar V esicles) показали, что варьируя липидный состав как внутреннего, так и наружного слоя, формируя LUVs в буфере с одним значением рН и перенося их затем в буфер с другой кислотностью, подвергая действию электрического тока или давлению, можно не только получать все наблюдаемые в живой клетке формы структур, но и превращения одних в другие. Более того, в определенных условиях можно было наблюдать на поверхности большой везикулы формирование маленьких везикул и их отпочкование – т. е. процесс, аналогичный формированию транспортных пузырьков. В других же условиях инициируется формирование инвагинаций с последующим отпочкованием маленьких пузырьков внутрь везикулы, т. е. именно то, что происходит при образовании мультивезикулярных тел или эндосом (МВТ или МВЭ) или упаковки секретируемых вирусных частиц на плазматической мембране (рис. 5). «С точки зрения клетки», в первом случае инвагинация мембраны происходит из компартмента в сторону цитоплазмы (out-in), а во втором – наоборот, из цитоплазмы в компартмент (in-out). Слияние LUVs также может происходить с определенной вероятностью, повышающейся с течением времени, без наличия белковой машинерии. Таким образом, теоретически, везикулярный транспорт липидных структур мог бы обойтись без всяких белков. Тем не менее, к настоящему времени уже известно несколько сотен белков, вовлеченных в везикулярный транспорт, и нужны они, в частности, для того, чтобы придать всем процессам специфичность и регулируемость.
Так, белки окаймлений определяют время и место формирования транспортных везикул, и что самое важное, выбор правильного груза; белки слияния определяют, с какой мембраной и когда сливаться транспортным везикулам, а малые ГТФазы Rab-семейства управляют и координируют все эти процессы. Координация везикулярного транспорта с процессами передачи сигнала осуществляют в основном сигнальные белки, но их субстратами могут быть не только белки транспортной машинерии, но и липиды. В результате везикулярный транспорт происходит с очень высокой точностью, и вероятность ошибочных слияний, также как и неверной сортировки, весьма низка, а уровень координации всех протекающих в клетке процессов очень высок.
1.6. МЕТОДОЛОГИЧЕСКИЕ ПОДХОДЫ
К ИЗУЧЕНИЮ ВЕЗИКУЛ