Коагуляция электролитам низшей валентности
При введении в воду электролитов, которые содержат колоедные частицы происходят след явления:1)повыш общая концентрация ионов наход в воде.
2)ядру коллоидной частицы определяется часть противоионов. начали переходить из диффузионного слоя в адсорбционный и таким образом уменьшает и толщину адсорб слоя и велечину электро кинетич потенциала.
Влияние концентрации электролитов на электро кинет потенциал
Мин кол-во электролита при при котором наблюдается эффективное появление хлопьев коагулянта называется порогом коагуляции. экспериментально установлено Гарди;
1) коагулирующим действием олад только те ионы, которые обладают противозонным знаком заряда колоедной частици. 2)коагул действие электролита тем больше чем больше его концентрация в воде, и чем выше его валентность. В общем случае между двумя колоедными частицами имеюшим одинаковый заряд (обуслов __ потенциалом) имеет место два два типа взаимодействия:1) силы отталкивания обуслав действием одинаковых злектр зарядов. Эти силы явл дальнодействующими.2)силы притяжения которые действуют на не большем расстоянии.3)при сближении колоед частиц превалируют силы электро статического отталкивания и в связи с этим возникает энергетический барьер. После преодоления энергетич барьера (Н) наступает область коагуляции РИСУНОК. Мин величина Н имеет место и энергитический барьер может быть преодолен при след условиях:
1)вода нагрев, усиливаются кинетич энергия колоедных частиц, энергетич барьер может быть преодолен. 2)при возникновении различных полей на воду (магнит, ультрозвуковые) снижается величина Н. 3)уменьшение за счет введения электролитов высшей валентности.
При совместном введении в воду нескольких солей электролитов имеет место 3 случая их влияния на процесс коагуляции.
1)аддитивное действие электр. В этом случае коагулирующее действие этих электролитов протекает независимо друг от друга. Конечный результат зависит от суммы концентр введенных электр. (при введении NaCl, KCl).
2)антагонизм электролита. Для достижения порога коагуляции необходимо вводить электролитов больше чем по рпвилу аддитивности, т.к возникает конкуренция за адсорбционный центр ДЭС коллоидных частиц. NaCl и Al2(SO4)3
3)синергизм электролитов. При совместном введении различных электролитов происходит усиление действия электр на процесс коагуляции и их кол-во может быть меньше.
6)взаимная коагуляция коллоидных систем.
В связи с тем что электрическая коагуляция с солями нишей валентности практически не применимо т к происходит засоление воды, то в воду вводят соли много валентных металлов и осуществляют взаимную коагуляцию коллоидных систем введением в воду соед алюминия и железа и эти вещества назыв коагулянтами.Требования к веществам коагулянта при переработке большого кол-ва воды:1)Дешевые и распространенные 2)наименьшая таксичность(CdSO4 токсичен) 3)образовывать гидроксидные осадки(хлопья с широкой развернутой поверхностью)
В нейтральной среде образуется гидроксидные осадки явл колоедным остатком, которые имеют слабый + заряд, а гидрофобные каллоидные системы имеют – заряд,поэтому В результате взаим электр притяжения происходят взаимные действия двух коллоидных систем. Их особенности:1) в процессе коогул участвуют разнородные частици (взвеш вещества, тонкий ил,глина, вещества 1 2 3 группы).2) взаимодействие между собой проходит более эффективно между разнородными частицами и коллоидными частицами, чем между двумя однотипными коллоидными частицами, которые имеют определенный заряд. Причем на достижении порога коагуляции влияет заряд хлопьев коагулянта, который меньше чем заряд коллоидных частиц. Таким образом происходит 1) осветление воды в следствии осаждения хлопьев коагулянта с примесями воды. 2) обесцвечивание воды в следствии сорбции органических веществ(торфяная вытяжка) на хлопьях осадка. 3)обеззараживание воды в следствии сорбции болезнет бактерии осжд на хлопьях коагулянта. 4) происходит уменьшение окисляемости воды.
Механизм процесса взаимной коагуляции коллоидных сис-м и влияние различных факторов на процесс
при введении 
 . Al начинает взаимодействовать в процессе
. Al начинает взаимодействовать в процессе
обменной адсорбции катионов. Этот процесс закл во внедрении катионов  в ДЭС колоелд частицы. При этом из дэс происходит вытеснение менее активных катионов природных воды Ca, Mg, Na и замена их катионом Al. При этом происходит сжатие диффузионного и адсорбц слоя и снижение электро кинетич потенц, уменьшения энергит барьера Н и нарушение агригативной устойчивости. В результате чего создаются условия для их взаимного слипания при этом наступает равновесие между ионами Al наход в дэс и избытком катиона
в ДЭС колоелд частицы. При этом из дэс происходит вытеснение менее активных катионов природных воды Ca, Mg, Na и замена их катионом Al. При этом происходит сжатие диффузионного и адсорбц слоя и снижение электро кинетич потенц, уменьшения энергит барьера Н и нарушение агригативной устойчивости. В результате чего создаются условия для их взаимного слипания при этом наступает равновесие между ионами Al наход в дэс и избытком катиона  наход в природной воде. Этот процесс назыв обменная адсорбция катионов. Эта стадия протекает очень быстро в процессе смешивания коагулянта с водой. 2-ая стадия: избыток катионов
наход в природной воде. Этот процесс назыв обменная адсорбция катионов. Эта стадия протекает очень быстро в процессе смешивания коагулянта с водой. 2-ая стадия: избыток катионов  наход не в дэс а в воде подвер-ся процессу гидролиза. Т.е происходит процесс взаимодействия с щелочностью примесной воды а потом с самой водой. (Формула). Щелочность обусл теми веществами которые способны взаим с сильными кислотами. Для того что бы эффект произ процесс коагул для
наход не в дэс а в воде подвер-ся процессу гидролиза. Т.е происходит процесс взаимодействия с щелочностью примесной воды а потом с самой водой. (Формула). Щелочность обусл теми веществами которые способны взаим с сильными кислотами. Для того что бы эффект произ процесс коагул для 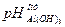 =5,5-8 необходимо в случае недостаточности щелочности воды подщелачивать для связывания ионов водорода и
=5,5-8 необходимо в случае недостаточности щелочности воды подщелачивать для связывания ионов водорода и  для этого используют реагент
для этого используют реагент 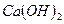 . По физическому состоянию это суспензия,поэтому при дозировании она должна быть перемешана. Кроме подщелачиваемого действия, известковое молоко выполняет роль электролитной коагуляции, поскольку оно явл электролитом и замутнителем, способствующему процессу коагуляции, по скольку технич продукт содерж и нераств часть котор явл взвесью. На процесс взаимной коагуляции влияет ряд факторов: доза коагулянта, рН воды, Т воды, показатели качества вода(щелочность, жесткость, мутность, цветность, окисляемость).
. По физическому состоянию это суспензия,поэтому при дозировании она должна быть перемешана. Кроме подщелачиваемого действия, известковое молоко выполняет роль электролитной коагуляции, поскольку оно явл электролитом и замутнителем, способствующему процессу коагуляции, по скольку технич продукт содерж и нераств часть котор явл взвесью. На процесс взаимной коагуляции влияет ряд факторов: доза коагулянта, рН воды, Т воды, показатели качества вода(щелочность, жесткость, мутность, цветность, окисляемость).
Влияние дозы коагулянта РИСУНОК.
Для того что бы определить оптимальную дозу коагулянта для воды необходимо в лаборат условиях или на очистных сооружениях получить данную коагулятивную кривую с использованием реальной воды, рельных реагентов, реальной температуры которая может изменяться 4 раза в году определяет оптимальную дозу коагулянта между концом II и началом III-оптимальная доза. Для I участка кривой характерна тем что доза мала, чтобы значительно изменить качество воды. Для II кривой характерно резкое уменьшение этих показателей. И в III увелич дозы коагулянта не приводит к уменьшению качества воды.в ней может быть перрерасход коагулянта и может иметь место увеличение остаточного содержания Al- ионов в воде. Следовательно оптимальной зоной является конец II и начало III. Снятие такой кривой является технологическим анализом воды.