Существуют различные способы выражения концентрации растворённого вещества в растворе, мы познакомимся с массовой долей растворённого вещества (процентной концентрацией).
I. Массовая доля растворённого вещества w растворённого вещества - это безразмерная величина, равная отношению массы растворённого вещества m растворённого вещества к общей массе раствора m раствора:
m раствора = m растворённого вещества + m растворителя
Массовую долю растворённого вещества (процентная концентрация) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
ЗАПОМНИТЕ!
 Пример решения задачи: Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
Пример решения задачи: Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
| Дано:
m раствора = 300 г
wрастворённого вещества = 5%
| Решение:
1. Запишем формулу для расчёта массовой доли:
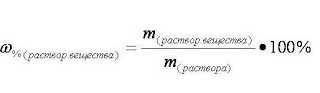 2. Преобразуем формулу и вычислим массу растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора = m растворённого вещества + m (H2O)
m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г = 285 г
Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
2. Преобразуем формулу и вычислим массу растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора = m растворённого вещества + m (H2O)
m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г = 285 г
Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
| | Найти:
m (H2O) =?
m растворённого вещества =?
| «Вычисление массовой доли растворённого вещества»
Задача: Сахар массой 12,5г растворили в 112,5г воды.
Определите массовую долю сахара в полученном растворе.
| Дано:
m сахара = 12,5 г
m (H2O) = 112,5 г
| Решение:
1. Запишем формулу для расчёта массовой доли:
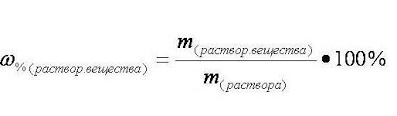 2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5 г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г · 100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %
2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5 г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г · 100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %
| | Найти:
w%=?
| «Вычисление массовой доли растворённого вещества в растворе, полученном при смешивании двух растворов»
Задача: Смешали два раствора соли: 120г 5%-ного раствора и 130г 15%-ного раствора. Вычислите массовую долю соли в образовавшемся растворе.
| Дано:
m раствора 1 = 120 г
wрастворённого вещества 1 = 5%
m раствора 2 = 130 г
wрастворённого вещества 2 = 15%
| Решение:
1. Запишем формулу для расчёта массовой доли:
 2. Преобразуем формулу и вычислим массы растворённого вещества в растворах 1 и 2
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества 1 = (5 % · 120 г) / 100% = 6 г
m растворённого вещества 2 = (15 % · 130 г) / 100% = 19,5 г
2. Общая масса растворённого вещества в полученном растворе:
m растворённого вещества 3 = m растворённого вещества 1+ m растворённого вещества 2 =6 г + 19, 5 г = 25,5 г
3. Вычислим массу раствора, полученного при сливании двух растворов:
m раствора 3 = m раствора 1 + m раствора 2 = 120 г + 130 г = 250 г
4. Вычислим массовую долю вещества в полученном растворе:
Wр.в. 3= (m р.в. 3 · 100%) /m раствора 3 = (25,5 г · 100%) /250 г = 10,2 %
Ответ: Wр.в. 3 = 10,2 %
2. Преобразуем формулу и вычислим массы растворённого вещества в растворах 1 и 2
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества 1 = (5 % · 120 г) / 100% = 6 г
m растворённого вещества 2 = (15 % · 130 г) / 100% = 19,5 г
2. Общая масса растворённого вещества в полученном растворе:
m растворённого вещества 3 = m растворённого вещества 1+ m растворённого вещества 2 =6 г + 19, 5 г = 25,5 г
3. Вычислим массу раствора, полученного при сливании двух растворов:
m раствора 3 = m раствора 1 + m раствора 2 = 120 г + 130 г = 250 г
4. Вычислим массовую долю вещества в полученном растворе:
Wр.в. 3= (m р.в. 3 · 100%) /m раствора 3 = (25,5 г · 100%) /250 г = 10,2 %
Ответ: Wр.в. 3 = 10,2 %
| | Найти:
wрастворённого вещества 3 =?
|
Задачи для закрепления:
| Процентная концентрация
| | 1. Вычислите массовую долю растворённого вещества, если в 88г воды растворили 12г соли.
| | 2. Рассчитайте массы соли и воды, необходимые для приготовления 400г раствора с массовой долей соли 0,05.
| | 3. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г воды.
| | 4. Как изменится процентная концентрация раствора, если к 10%-раствору соли массой 100г добавить 20г соли.
|
| Молярная концентрация
| | 1. Вычислите молярную концентрацию раствора поваренной соли, если в 500 мл этого раствора содержится 0,5 моль хлорида натрия.
| | 2. Вычислите молярную массу вещества, если известно, что в 24л раствора с молярной концентрацией 6 моль/л было растворено 2880 г вещества.
| Дополнительно:
|
 Пример решения задачи: Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
Пример решения задачи: Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора?
Решение:
 2. Преобразуем формулу и вычислим массу растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора = m растворённого вещества + m (H2O)
m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г = 285 г
Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
2. Преобразуем формулу и вычислим массу растворённого вещества в растворе
m растворённого вещества = (wрастворённого вещества · m раствора) / 100%
m растворённого вещества = (5 % · 300 г) / 100% = 15 г
3. Вычислим массу растворителя – воды:
m раствора = m растворённого вещества + m (H2O)
m (H2O) = m раствора - m растворённого вещества = 300 г - 15 г = 285 г
Ответ: Для приготовления 300 г 5% раствора надо взять 15 г соли и 285 г воды.
 2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5 г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г · 100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %
2. Вычислим массу раствора:
m раствора = m растворённого вещества + m (H2O)
m раствора = 12,5 г + 112,5 г = 125 г
2. Вычислим массовую долю сахара:
w% = (12,5 г · 100%) / 125 г = 10 % или 0,1
Ответ: w% = 10 %