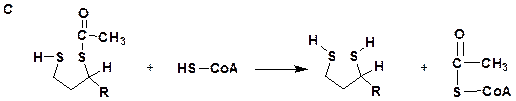МЕТАБОЛИЗМ УГЛЕВОДОВ


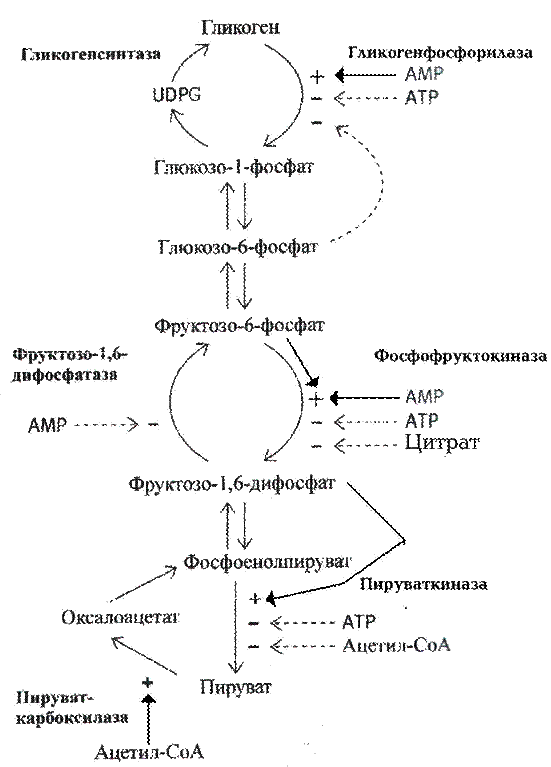
Подготовительный этап для вовлечения гликогена и галактозы в гликолиз
ГЛИКОЛИЗ-1

ГЛИКОЛИЗ-2

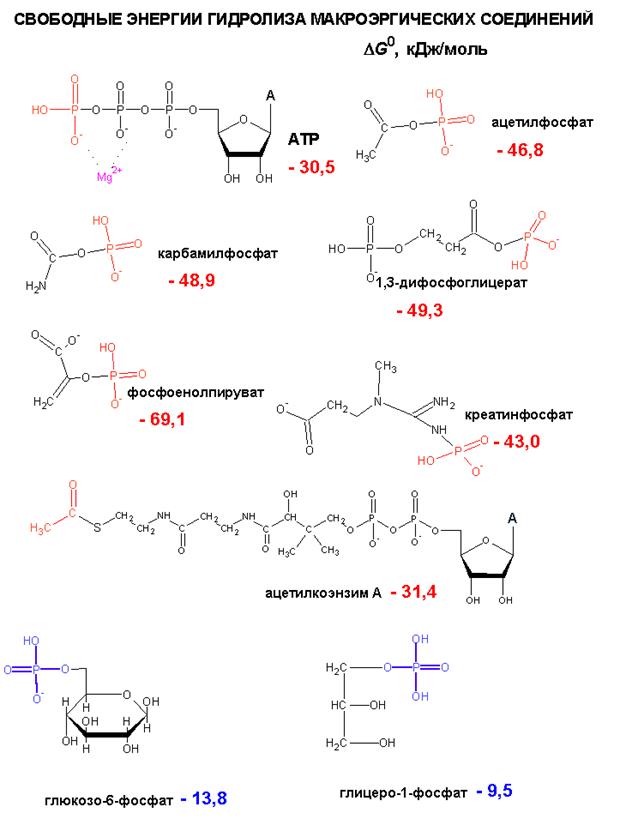
РЕГУЛЯЦИЯ ГЛИКОЛИЗА
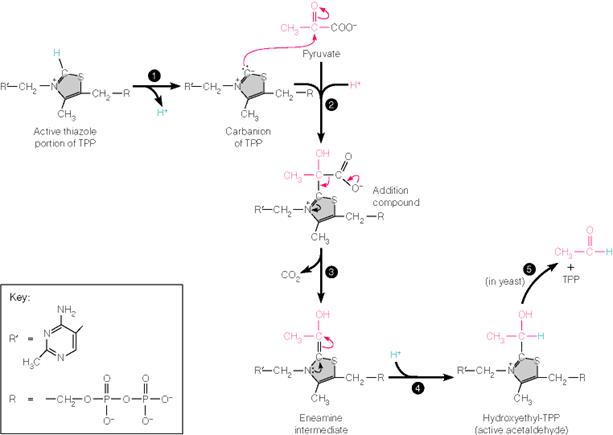
Действие пируватдегидрогеназного комплекса

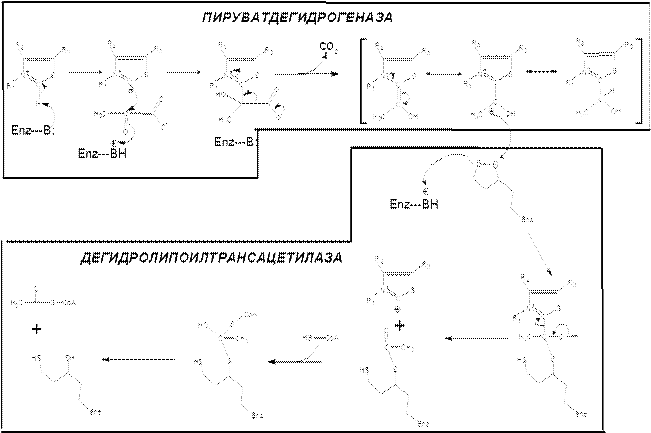
 Строение кофермента- А (СоА-SH)
Строение кофермента- А (СоА-SH)
Общая схема действия пируватдегидрогеназного комплекса (PDC)

ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
1) ОКИСЛИТЕЛЬНАЯ ВЕТВЬ 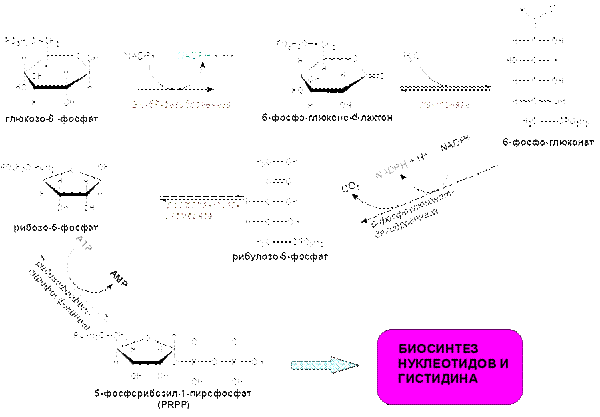
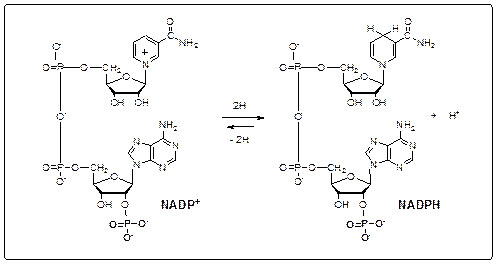
Некоторая часть электронов и атомов водорода топливных молекул используется для биосинтетических целей, а не переносится на О2 с генерированием АТР. Легкодоступным источником восстановительного эквивалента в клетках является NADPH, отличающийся от NADH наличием фосфатной группы при С-2 одного из рибозных компонентов. Фундаментальное различие между ролью NADPH и NADH в большинстве биохимических реакций состоит в том, что NADH окисляется дыхательной цепью с сопутствующим генерированием АТР, тогда как NAFPH служит донором водорода и электронов при восстановительных биосинтезах.
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
ОКИСЛИТЕЛЬНАЯ ВЕТВЬ (подробности)

В пентозофосфатном пути генерирование NADPH происходит при окислении глюкозо-6-фосфата в рибозо-5-фосфат. Этот пятиуглеродный сахар и его производные являются компонентами таких важных биологических молекул, как АТР, СоА, NAD+, FAD, RNA и DNA.
1) Дегидрирование Glc-6-P при С-1, фермент – 6-фосфат-дегидрогеназа (кофермент NADP+);
2) Гидролиз лактона лактоназой;
3) Окислительное декарбоксилирование, катализируемое 6-фосфоглюконат-дегидрогеназой (кофермент NADP+);
4) Изомеризация под действием фермента – фосфопентозо-изомеразы;
5) Изомеризация под действием пентозофосфат-эпимеразы (эта стадия происходит тогда, когда реализуется неокислительная ветвь пентозофосфатного пути)
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
НЕОКИСЛИТЕЛЬНАЯ ВЕТВЬ
Многие клетки нуждаются для восстановительных биосинтезов в большем количестве NADPH, чем требуется для включения рибозо-5-фосфата в нуклеотиды и НК. В таких случаях рибозо-5-фосфат превращается в глицеральдегид-3-фосфат и фруктозо-6-фосфат под действием транскетолазы и трансальдолазы.
Эти ферменты создают обратимую связь между пентозофосфатным путем и гликолизом, катализируя следующие три реакции:
С5 + С5 → С3 + С7 - катализируется транскетолазой
С7 + С3 → С4 + С6 - катализируется трансальдолазой
С5 + С4 → С3 + С6 - катализируется транскетолазой
Суммарный выход трех реакций – образование двух гексоз и одной триозы из трех пентоз.

Смысл этих процессов состоит в переносе двухуглеродного фрагмента транкетолазой и трехуглеродного фрагмента – трансальдолазой. Сахаром-донором двувх- и трехуглеродных фрагментов служит обычно кетоза, а акцептором – альдоза.
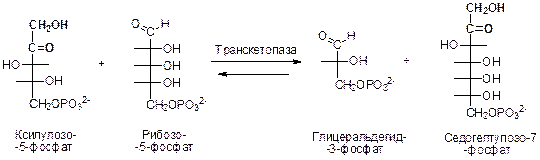
Роль донора двухуглеродного фрагмента в этой реакции выполняет ксилулоза-5-фосфат – эпимер рибулозо-5-фосфата. Кетоза может служить субстратом для транскетолазы только при условии, что ее гидроксильная группа при С-3 имеет конфигурацию ксилулозы, а не рибулозы. Рибулозо-5-фосфат под действием пентозофосфатизомеразы превращается в соответствующий эпимер, включающийся в транскетолазную реакцию.

Далее имеет место взаимодействие глицеральдегид-3-фосфата и седосептулозо-7-фосфата с образованием фруктозо-6-фосфата и эритрозо-4-фосфата. Этот синтез четырех- и шестиуглеродного сахаров катализируется трансальдолазой.
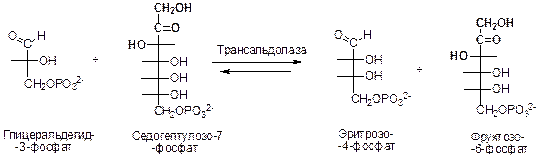
В третьей реакции транскетолаза катализирует синтез фруктозо-6-фосфата и глицеральдегид-3-фосфата из эритрозо-4-фосфата и ксилулозо-5-фосфата.

Таким образом, суммарная реакция, начиная с рибозо-5-фосфата (см. схему окислительной ветви), имеет следующий вид:
3 Рибозо-5-фосфат → 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат
Итак, избыток рибозо-5-фосфата, образованный в пентозофосфатном пути, может количественно превращаться в промежуточные продукты гликолиза.
Реакции, происходящие в пируват-дегидрогеназном комплексе
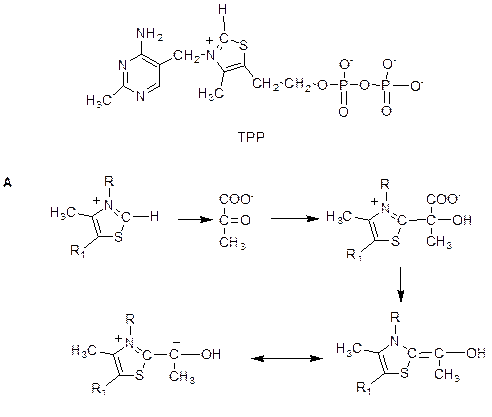
___________________________________________________________________
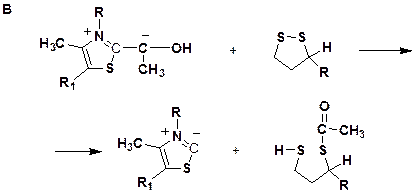
________________________________________________________________________