Металлическая связь
Металлы – это элементы 1-3 групп главных подгрупп, а также всех побочных подгрупп периодической системы. Они хорошо проводят электрический ток. С чем это связано? Чтобы ответить на этот вопрос, необходимо установить особенности их строения. Что мы сегодня и сделаем. Атомы металлов на внешнем энергетическом уровне имеют небольшое число электронов, поэтому они стремятся их отдать. Хорошо, если есть неметалл, который их примет. А если его нет, что тогда? В куске металла, слитке или металлическом изделии атомы металла отдают внешние электроны и посылают их в этот кусок, слиток или изделие, превращаясь при этом в положительные ионы. «Оторвавшиеся» электроны перемещаются от одного иона к другому, временно снова соединяются с ними в атомы, снова отрываются. И этот процесс происходит непрерывно. В куске металла существуют то атомы, то ионы. Их так и называют атом-ионы. Здесь же присутствуют и свободные электроны, которые могут выступать в роли переносчиков электрических зарядов. А схему образования металлической связи можно записать так: Ме0 – ne- ←→ Mеn+ атомы ионы металла металла, где n – число внешних электронов, участвующих в образовании связи. Наблюдается этот вид связи в металлах – простых веществах и сплавах. Таким образом, металлической называется связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов. Металлическая связь имеет некоторое сходство с ковалентной связью, так как основана на обобществлении внешних электронов. Однако при образовании ковалентной связи обобществляются внешние неспаренные электроны только двух соседних атомов, в то время как при образовании металлической связи в обобществлении этих электронов участвуют все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, тверды, пластичны, электропроводны, теплопроводны и имеют металлический блеск.
Водородная связь.
Рассмотрением водородной связи мы завершаем наше знакомство с типами химической связи. И это не случайно.
Во-первых, водородная связь — это частный случай межмолекулярного взаимодействия. Энергия такой связи примерно в 10 раз меньше, чем ковалентных и ионных химических связей, и составляет всего лишь 4—40 кДж/моль, т. е. вписывается в энергетическую характеристику межмолекулярных сил.
Во-вторых, рассмотрение водородной связи позволит сравнить эту химическую связь с другими типами и тем самым обобщить наши представления о природе химической связи вообще.
В-третьих, это самая значимая на нашей планете химическая связь, ибо она определяет структуру соединений, которые являются носителями жизни на Земле (белки и нуклеиновые кислоты), отвечают за хранение и воспроизведение наследственной информации живых организмов.
Все рассмотренные ранее типы химической связи (вспомните какие) имеют названия, в основу которых положены следующие химические понятия: «ионы», «атомы», «металлы». А водородная связь — специфический термин, связанный с конкретным химическим элементом — водородом. Очевидно, это связано с особенностью строения атома водорода, имеющего один- единственный валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крохотное ядро атома водорода, представляющее собой не что иное, как обыкновенный протон.

Образованием межмолекулярной водородной связи объясняется тот факт, что даже вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода; спирты — метанол, этанол, пропанол; карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород).
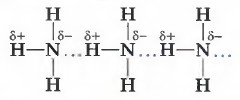
Механизм образования водородной связи состоит в электростатическом притяжении атома водорода, имеющего частичный положительный заряд, и атома кислорода (фтора или азота), имеющего частичный отрицательный заряд.
В образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободными орбиталями атомов водорода и неподелён- ными электронными парами атомов кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счёт водородных связей, возникающих между молекулами-диполями.
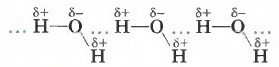
В жидкой воде образуются водородные связи между множеством молекул. А вот молекулы карбоновых кислот наиболее устойчивы в виде димеров, также образованных водородными связями:
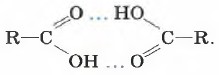
Алхимическое правило растворения «подобного в подобном» объясняется образованием водородной связи между молекулами растворителя и молекулами растворённого вещества.
Так, метиловый и этиловый спирты, этиленгликоль и глицерин, уксусная и муравьиная кислоты неограниченно растворяются в воде, например:
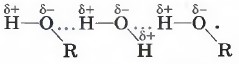
Способность некоторых газов, например аммиака, за счёт образования водородных связей
легко сжижаться (при давлении 0,9 МПа и комнатной температуре) и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках
Самостоятельная работа
Задание. Тест. Выберите правильный ответ.
1. Химическая связь - это а) взаимодействие между атомами б) взаимодействие между молекулами в) взаимодействие между электронами
2. Связь в металлах и сплавах между атом-ионами посредством обобществленных внешних электронов, называется а) ковалентной б) ионной в) металлической
3.Положительно заряженный ион – это а) катион б) анион в) электрон 4. Вещество, молекула которого образована посредством металлической связи: а) H2 – водород б) Na – натрий в) H2S – сероводород. 5) Схема образования металлической химической связи: а) Э0 – nе- → Эn+ б) Э0 + nе- → Эn- в) Э n+ + nе- → Э0
Задание.
Даны формулы веществ, определите вид химической связи (ионная, металлическая, ковалентная полярная, ковалентная неполярная) и запишите ответ напротив каждой формулы:
NaCl
O2
HCl
Na
K2S
H2S
Mg
H2
Al