Тема 1. Основы материаловедения. Физико-химические закономерности формирования структуры материалов.
1.1. Кристаллические и аморфные тела. Процессы кристаллизации и плавления.
1.2. Анализ структуры металлов: тонкая структура, микро- и макроструктура.
1.3. Строение металлов, кристаллические решетки.
1.4. Анизотропия ( неодинаковость свойств кристаллов ) и квазиизотропия ( псевдоодинаковость свойств поликристаллов ). Плоскости и направления свойств.
1.5. Полиморфизм или аллотропия ( способность иметь разные кристалл.решетки ). Железо, углерод.
Тема 2. Структура металлов и их сплавов.
2.1. Основные определения. Чистые металлы в современной промышленности и, в частности, в самолетостроении имеют ограниченное применение, т.к. не обладают требуемыми механическими, электрическими, магнитными свойствами. Поэтому широкое применение в технике имеют сплавы металлов. Изменяя состав и способ изготовления, можно получить сплавы почти с любыми заданными свойствами, например, с высокой механической прочностью в сочетании с малой плотностью и массой.
Металлические сплавы – это кристаллические тела, полученные при сплавлении металлов с другими металлами и (или) неметаллами. Важнейшими электротехническими сплавами являются сплавы меди (бронза и латунь), сплавы алюминия и различные сплавы железа.
Составляющие сплава называют компонентами. Сплавы могут быть двухкомпонентными и многокомпонентными. Обязательным условием образования сплава является получение однородного жидкого раствора соединяющихся компонентов. Так, например, железо со свинцом или свинец с цинком не образуют сплава, т.к. в жидком виде они не дают однородного раствора. В технологических сплавах входящие в них элементы полностью растворимы друг в друге и представляют собой жидкий раствор.
При затвердевании (не только при кристаллизации, но и при дальнейшем изменении структуры во время остывания) сплавы образуют три типа соединений: 1). Твердые растворы, имеющие общую кристаллическую решетку входящих компонентов. Применяются для производства конструкционных сплавов, т.к. хорошо деформируются в горячем состоянии, а в холодном имеют высокую прочность. 2). Химические соединения, имеющие совершенно новую кристаллическую решетку (и, соответственно, новые свойства), отличную от решеток исходных компонентов. Применяются, в основном для производства диэлектриков и сверхпроводников. 3). Механические смеси, где исходные компоненты не растворяются друг в друге и не вступают в химическую реакцию. Атомы каждого компонента кристаллизуются самостоятельно с образованием собственной кристаллической решетки. Применяются для производства припоев, т.к. имеют более низкую температуру плавления по сравнению с исходными компонентами (например, олово с цинком).
2.2. Твердые растворы. При образовании твердых растворов атомы растворяющегося элемента и атомы растворителя образуют общую кристаллическую решетку.
Растворитель – это тот компонент раствора, кристаллическая решетка которого сохраняется при образовании твердого раствора. Если же два компонента имеют одинаковые по типу кристаллические решетки, то растворителем будет тот из них, концентрация которого превышает 50%.
Различают два вида твердых растворов: замещения и внедрения. В твердых растворах замещения атомы растворенного компонента замещают атомы растворителя. Условием образования раствора замещения является размерный фактор – если атомные радиусы компонентов отличаются не более чем на 15%. В твердых растворах внедрения атомы растворенного компонента размещаются между атомами растворителя. Условием образования раствора внедрения также является размерный фактор, но с той лишь разницей, что размер внедряющегося атома должен быть равным или чуть больше размеров поры (межатомного пространства в кристаллической решетке). При меньшем размере будет наблюдаться неустойчивая связь внедряющихся атомов с атомами решетки растворителя, что приведет к их «выпадению». Твердые растворы внедрения имеют более ограниченную растворимость по сравнению с растворами замещения. При увеличении концентрации растворенного элемента возрастает электрическое сопротивление, твердость и прочность, т.к. уменьшается свободное пространство для перемещения электронов и атомов. Наиболее ярким примером растворов внедрения является сплав железа с углеродом – твердые растворы углерода в α-Fe и ϒ-Fe.
2.3. Диаграмма состояния сплава.
Любое фазовое превращение расплава или сплава отмечается изменением физико-механических свойств. Переход сплава из жидкого состояния в твердое сопровождается значительным выделением теплоты (при обратном процессе – поглощением теплоты). Поэтому, измеряя температуру при охлаждении (нагреве) во времени, можно по перегибам или остановкам (прямые линии) на кривых охлаждения (нагрева) определить критические температуры, при которых происходят фазовые превращения. Для того же, чтобы зафиксировать превращения в твердом состоянии (сопровождаемые малыми тепловыми эффектами), обычно наблюдают за какой-либо величиной (электрическое сопротивление, магнитные свойства, размеры и объемы образцов …). Так, при нагреве железного образца при температурах 911°С и 1392°С наблюдаются резкое уменьшение и увеличение его длины, что указывает на переход железа из одного состояния в другое (не раскрывая атомного строения этих фаз).
ΔL
α-Fe ϒ-Fe α-Fe
0911°C 1392°C t°
Чистому компоненту А (обычно это растворитель) на диаграмме состояния соответствует левая вертикальная крайняя линия, соответствующая 100% содержанию этого компонента. На ней отмечаются критические точки температур фазовых превращений по вышеприведенным исследованиям. Таким же образом исследуются и сплавы компонента А с различными концентрациями второго компонента В, для которого правая крайняя точка диаграммы будет соответствовать 100% его содержанию. Для каждого из этих сплавов экспериментально устанавливают на диаграмме свою точку фазовых превращений, а также точку начала кристаллизации.
Верхняя линия (АВСD диаграммы «железо-углерод») – геометрическое место всех точек начала кристаллизации сплавов – ликвидус (от латинского слова «ликва» - жидкий).
Ниже линия (AHJECF) – соответствует точкам, определяющим температуру конца кристаллизации сплавов – солидус (от латинского слова «солид» - твердый).
При полной взаимной растворимости компонентов в жидком и твердом состоянии (когда они имеют одинаковые кристаллические решетки и атомные диаметры компонентов мало отличаются по размерам) линии ликвидус и солидус пересекаются между собой в точках кристаллизации чистых компонентов А и В.
| (Ж) жидкий раствор 1 t1 t2 а с b e f Ж+α (α) твердый раствор xf xa xc xb xe |
Жидкий раствор
e
t3
100%,A B,100%
Рассмотрим затвердевание такого сплава при относительном составе его компонентов xc. Жидкий раствор при температуре t1 начинает кристаллизоваться. Можно предположить, что состав образующихся при этом кристаллов будет того же состава, что и жидкий раствор. Однако, из жидкого раствора состава xc при температуре t1 начнут зарождаться (выпадать) кристаллы, сильно обогащенные более тугоплавким компонентом В. При дальнейшем охлаждении жидкого раствора до температуры t2 жидкий (менее тугоплавкий) компонент А будет диффундировать в кристаллы xc, меняя при этом его количественный состав до xb. Т.е. в соответствие с диаграммой при температуре t2 вместе с жидким раствором xa, обогащенным компонентом А, будут находиться кристаллы твердого раствора xb. При условии медленного охлаждения к концу затвердевания при температуре t3 все кристаллы будут иметь одинаковый состав xc. Если же процесс кристаллизации протекает в условиях ускоренного охлаждения, то диффузионное выравнивание состава у кристаллов, выпавших при температуре выше линии солидуса (точки t3), не успеет произойти. В результате внутренние участки кристалла будут более богаты тугоплавким компонентом В, а наружные – компонентом А. Явление неоднородности состава кристаллов носит название ликвации; чаще всего она играет отрицательную роль и может привести к преждевременному разрушению деталей литых конструкций.
Итак, химический состав выделяющихся кристаллов по мере снижения температуры изменяется по линии солидус от xe до xc. В это же время состав жидкой фазы изменяется по линии ликвидус от xс до xf. Отсюда следуют правила определения состава фаз:
правило концентраций элементов: для определения концентраций компонентов в двух фазах через данную точку температуры, характеризующую состояние сплава в данный момент, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область. Проекции точек пересечения на горизонтальную ось диаграммы покажут составы фаз;
правило количественного соотношения фаз: Жa/αb = bc/ac.
Для трехкомпонентного сплава диаграмма состояния строится уже в пространстве.
Примером многокомпонентного состава является вода. Ее плотность максимальна при 4°С. При охлаждении ниже этой точки молекулы воды начинают собираться в упорядоченную кристаллическую решетку, которая занимает больше места, и потому плотность ее падает. В замкнутой среде – в контейнере давление кристаллизирующейся воды возрастает до 200 МПа (2000 атм.). После чего атомы начнут перестраиваться в более компактную фазу: смеси льда и воды. Известно 13 видов льда, которые устойчивы при различных температурах и давлениях. Самая плотная разновидность – лёд-III.
2.4. Диаграмма «железо-углерод».
В сплаве железа с углеродом элементы полиморфные, т.е. обладают аллотропией – свойством иметь разные кристаллические решетки при определенных условиях.
Температура плавления чистого железа равна 1539°С.
Железо образует две кристаллические модификации: α-Fe с кубической объемно-центрированной решеткой, существ. при t < 911° и t > 1392°C ϒ-Fe с кубической гранецентрированной решеткой – при 911° < t < 1392°C.
ГЦК решетка более компактна, чем ОЦК решетка, в связи с этим при переходе Feα в Feϒ объем железа уменьшается приблизительно на 1% и Feϒ к тому же парамагнитно, т.е. слабо намагничивается.
Углерод существует в двух модификациях: графита и алмаза. Алмаз – метастабилен, т.е. имеет устойчивую структуру при высоких давлениях и температурах.
Сплавы железа с углеродом имеют при различных температурах и концентрациях следующие фазы:
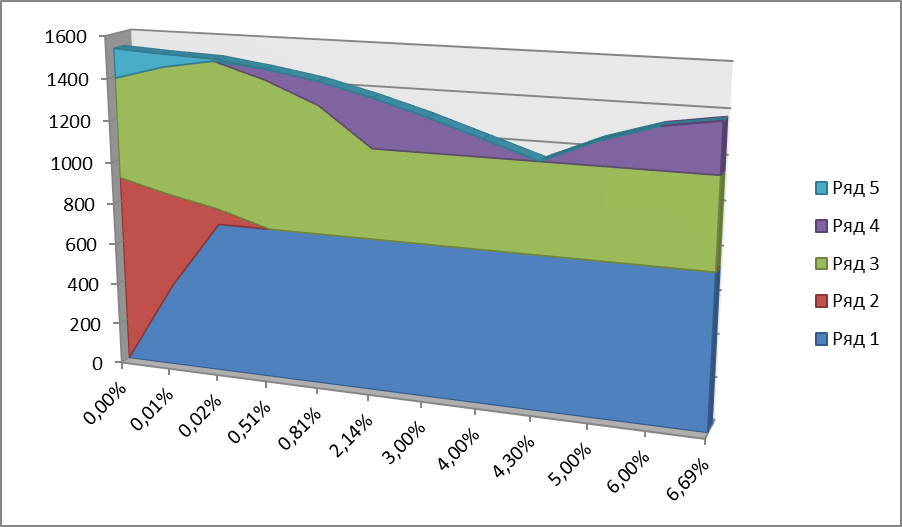
- жидкий раствор. - Феррит – твердый раствор внедрения углерода в Feα; различают низкотемпературный (с концентрацией углерода до 0,02%) и высокотемпературный феррит (с концентрацией углерода до 0,1%). Столь низкая растворимость углерода в Feα обусловлена малым размером межатомных пор в ОЦК решетке. Феррит – мягкая пластичная фаза. - Аустенит - твердый раствор внедрения углерода в Feϒ. Он имеет ГЦК решетку, межатомные поры в которой больше, чем в ОЦК решетке, поэтому растворимость углерода будет больше и достигает 2,14%. Аустенит также пластичен, но прочнее феррита. - Цементит – химическое соединение карбид железа, почти постоянного состава с содержанием углерода 6,69% (поэтому его состав в растворах отмечается по отдельной оси). Он тверд и хрупок, а его температуру плавления трудно определить в связи с его распадом при нагреве. Она установлена равной 1260°С при нагреве лазерным лучом. - Графит – свободный углерод, выделяющийся при охлаждении в железоуглеродистых сплавах, имеет гексагональную решетку; химически стойкий, электропроводный, непрочный и мягкий.
Далее по диаграмме (и таблице ее основных точек, стр.56). Точка А определяет температуру плавления чистого железа (1539°С). Точка D определяет температуру плавления цементита (1260°С). Точки N и G соответствуют температурам полиморфных превращений чистого железа (1392°С и 911°С). Точки Н и Р определяют крайние точки участков превращения высокотемпературного и низкотемпературного ферритов (1499°С и 727°С) и соответствующую при этом предельную концентрацию углерода в феррите (0,1% и 0,02%). Точка Е определяет крайнюю точку участка образования аустенита и соответствует наибольшей концентрации углерода в аустените 2,14% при температуре 1147°С. Линии ABCD и AHJECF – линии ликвидуса и солидуса первичной кристаллизации в интервале температур 1147…1539°С ограничивают области образования аустенита (слева от точки С) и цементита (справа от точки С). Поскольку низкоуглеродистое железо является более тугоплавким компонентом, то, в отличие от предыдущего примера диаграммы с неограниченной растворимостью, верхние точки линий ликвидуса и солидуса будут слева. Линии ES и PQ – характеризуют изменение концентрации углерода в аустените и низкотемпературном феррите при снижении температуры и переходе железа из модификации ϒ в α. Линия DFKL цементита почти неизменного состава с содержанием С=6,67…6,69% ограничивает область избытка углерода, выделяющегося из твердых растворов при переходных процессах.
В системе железо-цементит происходят три изотермических превращения (изо – при одной температуре для всех количественных составов данной области) по следующим линиям: Линия HJB - перитектическое превращение ФН + ЖВ → АJ при температуре 1499°С, т.е. феррит + жидкость → аустенит (с содержанием С=0,16%). Эта реакция имеет место только у сплавов с содержанием С=0,1…0,51%; Линия ECF - эвтектическое превращение ЖС → [АЕ + ЦF ] при температуре 1147°С, т.е. происходит кристаллизация сразу обоих компонентов с образованием механической смеси аустенита (с содержанием С=2,14%) и цементита (с содержанием С=6,67%), называемой ледебуритом (с содержанием С = 4,3%). Обладает высокой твердостью и хрупкостью, поэтому присутствие его в сплавах затрудняет их обрабатываемость давлением и резанием. Линия PSK - эвтектоидное превращение АS → [ФР + ЦК ] при температуре 727°С, т.е. происходит образование из аустенита механической смеси феррита (с содержанием С=0,02%) и цементита (с содержанием С=6,67%), называемой перлитом (с содержанием С=0,8%). Чаще всего имеет пластинчатое строение и является прочной структурной составляющей твердого раствора железо-углерод. Имеет хорошую пластичность наряду с высокой прочностью.
Поскольку изотермические превращения сопровождаются выделением теплоты, реакция может иметь обратный процесс до тех пор, пока температура не снизится ниже соответствующей данному превращению. Квадратные скобки означают образование самостоятельных структурных составляющих твердых растворов в результате превращения.
При охлаждении ледебурита (по вертикальной линии из точки С) до температур линии SK входящий в него аустенит превращается в перлит, а при температуре 20…25°С ледебурит представляет собой смесь цементита и перлита.
ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫподразделяются на 2 группы: СТАЛИ (с содержанием С до 2,14%) и ЧУГУНЫ(с содержанием С>2,14%): - до 0,02% - техническое железо, - от 0,02 до 0,8% - доэвтектоидная сталь. В результате эвтектоидного превращения аустенит переходит в перлит, который вместе с выделившимся ранее ферритом образует конечную структуру стали. Количественное соотношение между структурными составляющими феррит и перлит в доэвтектоидных сталях определяется содержанием углерода: чем ближе содержание углерода к эвтектоидной концентрации, тем больше в структуре перлита. Следовательно, зная содержание углерода в доэвтектоидной стали, можно заранее предвидеть ее структуру в стабильном состоянии. - С=0,8% - эвтектоидная сталь, - от 0,8 до 2,14% - заэвтектоиднавя сталь. При таком содержании углерода эвтектоидному превращению будет предшествовать выделение из аустенита вторичного цементита, что вызвано уменьшением растворимости углерода в аустените согласно линии ES. Максимальное количество структурно свободного цементита (приблизительно 20%) будет в сплаве с содержанием углерода 2,14%. На микрофотографиях он образует сплошные оболочки светлого цвета вокруг аустенитных зерен. - от 2,14 до 4,3% - доэвтектический белый чугун. Его кристаллизация начинается с выделения аустенита из жидкого раствора. В конечном превращении - крупные темные поля на фоне ледебурита – это перлит, образовавшийся из структурно свободного аустенита. - С=4,3% - эвтектический белый чугун. Кристаллизуется с одновременным выделением двух фаз: аустенита (состав точки Е) и цементита, образуя смесь ледебурита с фазовым составом, равным отношению отрезков ЕС…ЕS / CF. При температуре линии PSK аустенит в ледебурите претерпевает эвтектоидное превращение в перлит. - более 4,3% - заэвтектический белый чугун. Его кристаллизация начинается с выделения из жидкого раствора цементита, что приводит в конечном итоге к появлению в составе зерен крупных пластин первичного цементита.
2.5. Легирование сталей.
Широкое применение находят стали, содержащие не только железо-углерод, но и специально вводимые добавки, чаще всего других металлов. Эти добавки принято называть легирующими элементами, а сами стали – легированными сталями. В качестве легирующих элементов используют: Cr, Ni, Mn, Si, Mo, W, V, Ti, Co, Nb. Реже используются Al, Cu, B и некоторые другие.
Почти все легирующие элементы изменяют температуры полиморфных превращений железа, температуру эвтектоидной и эвтектической реакций и влияют на растворимость углерода в аустените. Некоторые легирующие элементы способны как железо, при взаимодействии с углеродом образовывать карбиды, а при взаимодействии с железом или между собой образовывать промежуточные фазы – интерметаллиды.
Первую группу образуют легирующие элементы, которые расширяют диапазон температур полиморфных превращений железа (t1<911°…1392°<t2). В сплавах железа с Ni, Mn, Co ϒ-область открывается, т.е. в определенном интервале температур существует неограниченная растворимость компонентов, образуя твердые растворы с ГЦК решеткой.

В сплавах с концентрацией добавки, равной или превышающей концентрацию в нижней точке линии ϒ, ГЦК решетка устойчива при температуре 20°С. Такие сплавы называют аустеничными сталями. Т.о. аустенитом называют не только твердый раствор углерода в Fe-ϒ, но и любые твердые растворы на основе Fe-ϒ.
Во вторую группу входят элементы, которые сужая диапазон температур полиморфных превращений железа (t1>911°…1392°>t2), расширяют температурный интервал устойчивости Fe-α. Таких легирующих элементов большинство: Cr, Si, Mo, W, V, Ti и др. (Мо – единственный из металлов, способный выдерживать температуру свыше 1700°С). Все элементы образуют с железом диаграмму с замкнутой ϒ-областью. Влияние легирующих элементов на протяженность замкнутой ϒ-области представлено на диаграмме:
| Ti,V |
| W |
1300°
| Mo |
| Si |
| Cr |
911°
800°
Fe 2 4 6 8 10 12 14 %
Максимальная концентрация в ϒ-области для большинства элементов не более 2%, для хрома аустеничная область простирается до 12%.
Из перечисленных элементов, дающих замкнутую ϒ-область, только хром и ванадий имеют неограниченную растворимость в железе с ОЦК решеткой (Fe-α), поэтому α-область открывается (и на следующей диаграмме с замкнутой ϒ-областью зеленой пунктирной линии не будет):

Остальные легирующие элементы при повышении их концентрации перестают растворяться и образуют с железом промежуточную фазу. Поэтому на диаграмме появляется линия, ограничивающая растворимость, правее которой расположены двухфазные области. Однофазные сплавы с ОЦК решеткой (α) устойчивой при всех температурах вплоть до солидуса, называют ферритными сталями. Таким образом, ферритом называют не только твердый раствор углерода в Fe-α, но и любые твердые растворы на основе Fe-α.
Легирующие элементы смещают линии PSK, GS, SE (см.диаграмму «железо-углерод») в сторону более высоких температур и изменяют положение важнейших точек стали S и E. Также легирующие элементы уменьшают растворимость углерода в аустените при всех температурах, что равносильно сдвигу линии SE влево (в сторону меньших концентраций углерода).
Максимальная растворимость углерода в аустените (точка Е) наиболее резко смещается влево под влиянием элементов, замыкающих ϒ-область: Cr, Si, Mo, W, V, Ti. Очевидно, что и ледебурит появится в сплаве при меньших концентрациях углерода. Например, в стали, легированной 10% Cr, ледебурит появляется в структуре при содержании углерода всего в 1%. Характерно, что небольшое количество ледебуритной эвтектики при пониженном содержании углерода не снижает способности сплава обрабатываться давлением и резаньем в горячем состоянии, тогда как нелегированный белый чугун (с содержанием углерода более 2,14%) теряет способность к обработке даже при малых количествах эвтектической составляющей. В связи с этим легированные стали с ледебуритной составляющей относят к стали, а не к белым чугунам и классифицируют как ледебуритные стали.
Маркировка легированных сталей. По ГОСТ 4543-71 принято обозначать: Х – хром, Н – никель, Г – марганец, С – кремний, М – молибден, В – вольфрам, Т – титан, Ф – ванадий, Ю – алюминий, Д – медь, Б – ниобий, (Р – бор)*, К – кобальт.
Цифра, стоящая после буквы, указывает на примерное содержание легирующего элемента в %. Если цифра отсутствует, то содержание легирующего элемента менее или около 1%. Две цифры вначале буквенного обозначения показывают содержание углерода в сотых долях %.
Например, 20ХН3А – сталь, содержащая около 0,20% С, 1% Cr и 3% Ni. Буква А в конце названия марки означает, что сталь высококачественная. Самые высококачественные стали имеют в конце обозначения букву Ш, например, 30ХГС-Ш.
Некоторые группы сталей содержат дополнительные обозначения: - начинающиеся с буквы Ш – шарикоподшипниковые стали, - начинающиеся с буквы Э – электротехнические стали, - начинающиеся с буквы А – автоматные стали, - начинающиеся с буквы У – углеродистые стали пониженной прокаливаемости, - начинающиеся с буквы Р – быстрорежущие стали*.
Нестандартные легированные стали, выпускаемые заводом «Электросталь», маркируют: ЭИ – электросталь исследовательская, ЭП – электросталь пробная и порядковым номером: ЭИ415, ЭП716 и т.д.