равна
а) +3 б) +5 в) -3 г) -5
9. Фосфид натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Mn(NO3)2 + NaBiO3 + HNO3 = HMnO4 + Bi(NO3)3 + NaNO3 + H2O
а) 42 б) 24 в) 20 г) 48
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 19
1.Массовая (процентная) концентрация раствора (%), полученного при прибавлении
300 г воды к 250 г 15% раствора гидроксида натрия равна:
а) 6,82 б) 3,41 в) 2,63 г) 1,89
2.Молярная концентрация эквивалента сульфата алюминия (моль/л) в растворе, в 250 мл которого содержится 34,2 г Al2(SO4)3 равна:
а) 2,4 б) 1,2 в) 3,6 г) 4,8г
а) 0,00245 б) 0,006700 в) 0,00123 г) 0,003350
3..Второй ступени диссоциации дигидровисмутата (V) натрия соответствует уравнение
 а) Na2HBiO 4 2Na+ + HBiO42-
а) Na2HBiO 4 2Na+ + HBiO42-
 б) H2BiO4- H+ + HBiO42-
б) H2BiO4- H+ + HBiO42-
 в) NaH2BiO4 Na+ + H2BiO4-
в) NaH2BiO4 Na+ + H2BiO4-
 г) HBiO42- H+ + BiO43-
г) HBiO42- H+ + BiO43-
4. Константа диссоциации муравьиной кислоты (%) в 0,5м растворе, при концентрации ионов водорода 0,01моль/л равна:
а) 4,02*10-6 б)2,0 4*10-4 в) 6,02*10-10 г) 8,04*10-2
4.Степень диссоциации гидроксида аммония (%) в растворе с концентрацией 0,1 моль/л
(константа диссоциации KNH4OH=1,8*10-5)
а) 2,2 б) 4,5 в) 6,2 г) 1,3
5. Водородный показатель (рН) фосфатной буферной смеси равен:
а) 10,2 б) 8,0 в) 2,2 г) 4,7
6.Водородный показатель 0,1м раствора гидроксида аммония (Кд 1,8*10-5) равен
а) 2,0 б) 12,8 в) 6,38 г) 11,13
7. Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
8. Степень окисления атома хрома в молекуле хромата натрия равна
а) +3 б) +5 в) +6 г) +2
9. Хромат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Zn + HNO3 = Zn(NO3)2 + NH4NO3 +H2O
а) 87 б) 54 в) 23 г) 22
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 20
1.Масса хлорида алюминия, необходимая для приготовления 0,20л 0,25н раствора равна
а) 4,350г б) 6,675г в) 2,225г г) 8,700г
2.Молярная концентрация раствора карбоната натрия (моль/л), в 250мл которого содержится 2.12 г Na2CO3, равна:
а) 0,08 б) 0,16 в) 0,04 г) 0,32
3..Второй ступени гидролиза нитрата железа (III) соответствует уравнение
а) FeOH2+ + Н2О = Fe(ОН)2+ Н+
б) Fe3+ + Н2О = FeОН2+ + H+
в) Fe(OH)3 + Н2О = Fe3+ + H+
г) Fe(ОН)2+ + Н2О = Fe3+ + H+
4.Координационное число комплексообразователя в молекуле сульфат тетрааквамеди (II)
а) 2 б) 4 в) 6 г) 8
5.Самый слабый электролит
а) KNO3 б) HNO3 в) HNO2 г) NH4OH
6. Водородный показатель насыщенного раствора гидроксида магния, если произведение растворимости ПР Mg(OH)2=3*10-11 равен:
а) 4 б) 10 в) 2,2 г) 12,7
7. Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
7.Произведение растворимости хромата серебра, если в 500мл раствора содержится 0,011г Ag2CrO4 равно:
а) 2,34*10-14 б) 1,45*10-13 в) = 1,16 * 10-12 г) 1,25*10-10
8. Степень окисления атома молибдена в молекуле молибдата натрия равна
а) +3 б) +5 в) +6 г) +8
9. Молибдат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
HCl + KMnO4 = MnCl2 + Cl2 + KCl + H2O
а) 24 б) 35 в) 36 г) 12
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 21
1.Объем 30% раствора гидроксида калия (плотность раствора 1,29г/см3) для приготовления 3л раствора с молярной концентрацией 0,54 моль/л равен:
а) 117,21 мл б) 341,5мл в) 25,45 мл г) 234,42 мл
2.Молярная концентрация раствора карбоната натрия (моль/л), в 250мл которого содержится 2.12 г Na2CO3, равна:
а) 0,08 б) 0,16 в) 0,04 г) 0,32
3. При уменьшении объема газовой смеси в три раза скорость прямой реакции

 2SO2(г) + О2(г) 2SO3(г)
2SO2(г) + О2(г) 2SO3(г)
увеличится в:
а) 9 раз б) 27 раз в) 4 раза г) 12раз
4.Координационное число комплексообразователя в молекуле хлорид дихлоротетраамминплатины (IV) равно:
а) 2 б) 4 в) 6 г) 8
5. Водородный показатель (рН) фосфатной буферной смеси равен:
а) 10,2 б) 8,0 в) 2,2 г) 4,7
6.Водородный показатель 0,1м раствора гидроксида аммония (Кд 1,8*10-5) равен
а) 2,0 б) 12,8 в) 6,38 г) 11,13
7..Произведение растворимости карбоната магния при 200C, в 1л насыщенного раствора которого содержится
0,533г MgCO3, равно
а) 2,6*10-6 б) 4,0*10-5 в) 1,8*10-8 г) 8,0*10-3
8. Степень окисления атома фосфора в молекуле фосфида натрия равна
а) +3 б) +5 в) -3 г) -5
9. Фосфид натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Au + HNO3 +HCl =AuCl3 +NO2 +H2O
а) 27 б) 24 в) 20 г) 14
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 22
1. Масса нитрата свинца (II) для приготовления 20л 0,05н
раствора равна
а) 1,78г б) 122,5г в) 165,5г г) 155,5г
2.Молярная концентрация эквивалента хлорида железа (Ш), в 300мл которого 32,44г соли равна
а) 4,0 моль/л б) 8,0 моль/л в) 5,0 моль/л г) 2,0 моль/л
3. Степень диссоциации 0,1 н раствора уксусной кислоты (Кд=1,85*10-5) равна
а) 25% б) 1,36% в) 13,6 % г) 3,5%
4.Второй ступени диссоциации дигидростибата (V) натрия соответствует уравнение
 а) Na2HSbO 4 2Na+ + HSbO42-
а) Na2HSbO 4 2Na+ + HSbO42-
 б) H2SbO4- H+ + HSbO42-
б) H2SbO4- H+ + HSbO42-
 в) NaH2SbO4 Na+ + H2SbO4-
в) NaH2SbO4 Na+ + H2SbO4-
 г) HSbO42- H+ + SbO43-
г) HSbO42- H+ + SbO43-
5.Растворимость фосфата серебра при 200С равна 0,0065г/л.
Произведение растворимости равно:
а) 1,7*10-18 б) 1,7*10-5 в) 1,7*10-15 г) 1,7*10-8
6.Водородный показатель 0,1м раствора гидроксида аммония (Кд 1,8*10-5) равен
а) 2,0 б) 12,8 в) 6,38 г) 11,13
7.Аммиачная буферная смесь поддерживает в растворе
а) кислую среду б) щелочную среду в) нейтральную среду г) рН=4,1
8. Концентрация ионов гидроксида в растворе (Сн+= 10-3 моль/л) равна
а) 10-3 б) 10-9 в) 10-12 г) 10-11
9.Степень окисления атома мышьяка в молекуле арсенита натрия равна
а) +3 б) +5 в) -3 г) -5
10.Сумма стехиометрических коэффициентов в уравнении ОВР равна
Hg + HNO3 = Hg(NO3)2 + NO + H2O
а) 12 б) 20 в) 22 г) 40
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 23
1.Титр 0,05 н раствора серной кислоты (г/мл) равен:
а) 0,00245 б) 0,00490 в) 0,00123 г) 0,00145
2. Массовая доля (%)КОН в растворе с молярной концентрацией 3,8 моль/л (плотность раствора 1,17г/см3) равна:
а) 36 б) 54 в) 18 г) 28
3.При диссоциации дигидроксосульфата алюминия на второй ступени процесса образуется
катион
а) Al(OH)2+ б) Al3+ в) AlO+ г) AlOH2+
4.Координационное число комплексообразователя в молекуле хлорид дихлоротетраамминплатины (IV) равно:
а) 2 б) 4 в) 6 г) 8
5. Ионное произведение воды при 250С равно
а) 10-2 б) 10-14 в) 20*10-14 г) 14*10-1
6. Водородный показатель (рН) 0,1м раствора гидроксида аммония (КNH4OH=1,8*10-5) равен:
а) 10,24 б) 11,13 в) 2,24 г) 4,72
7. Произведение растворимости хромата серебра, если в 500мл раствора содержится 0,011г Ag2CrO4 равно:
а) 2,34*10-14 б) 1,45*10-13 в) 1,7*10-6 г) 1,16*10-12
8. Степень окисления атома мышьяка в молекуле арсената натрия равна
а) +3 б) +5 в) -3 г) -5
9. Арсенат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
K2Cr2O7 + HCl ® CrCl3 + Cl2 + KCl + H2O
а) 27 б) 54 в) 18 г) 28
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 24
1.Молярная концентрация раствора сульфата калия (моль/л), в 2л которого содержится 4,35г соли равна
а) 4,35 б) 0,01 в) 0,025 г) 0,02
2.Массовая доля (%) гидроксида натрия в 300 мл раствора (р =1,235г/см3), содержащего 10,5г
KOH равна:
а) 2,8 б) 20,00 в) 0,1 г) 5,0
3.При диссоциации гидрофосфата натрия на второй ступени процесса образуется
анион
а) NaH-) H2PO4- в) HPO42- г) PO43-
4.Сокращенное ионно-молекулярное уравнение
H2S + Zn2+ = ZnS+ 2H+
соответствует реакции взаимодействия
а) сульфида цинка и сероводородной кислоты
б) сульфата аммония и сероводородной кислоты
в) сульфата цинка и сероводородной кислоты
г) сульфида калия и гидроксида цинка
5.Самый слабый электролит
а) KNO3 б) HNO3 в) HNO2 г) NH4OH
6.Водородный показатель 0,002н раствора гидроксида калия равен
а) 11,3 б) 2,7 в) 8,5 г) 1,32
7.Концентрация ионов водорода в растворе сильной кислоты равна
а) константе диссоциации кислоты
б) степени диссоциации кислоты
в) произведению степени диссоциации на концентрацию кислоты
г) основности кислоты
8.Произведение растворимости карбоната магния при 200C, в 1л насыщенного раствора которого содержится
0,533г MgCO3, равно
а) 2,6*10-6 б) 4,0*10-5 в) 1,8*10-8 г) 8,0*10-3
9.Степень окисления атома азота в молекуле нитрата хрома(III) равна:
а) +5 б) -5 в) +1 г) -3
10.Сумма стехиометрических коэффициентов в уравнении ОВР равна
KMnO4 + KBr + H2SO4 = MnSO4 + Br2 + K2SO4 +H2O
а) 18 б) 30 в) 41 г) 26
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 25
1. Молярная концентрация (моль/л) ортофосфорной кислоты в растворе, полученном растворением 18 г Н3РО4 в 282 г воды (плотность раствора 1,031г/см3)
равна:
а) 0,232 б) 0,465 в) 0,63 г) 6,3
2. Объем раствора с массовой долей серной кислоты 9,3% (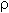 = 1,05 г/мл) для приготовления 0,35м раствора H2SO4 объемом 40 мл равен
= 1,05 г/мл) для приготовления 0,35м раствора H2SO4 объемом 40 мл равен
а) 12,5мл б) 14,05 мл в) 138мл г) 3,0 мл
3. При диссоциации дигидроарсената натрия на второй ступени процесса образуется
анион
а) As3- ) H2AsO4- в) HAsO42- г) AsO43-
4. Сокращенное ионно-молекулярное уравнение гидролиза ацетата калия:
а) CH3COOK + Н2О = KОН + CH3COOH
б) K+ + Н2О = KОН + H+
в) CH3COO- + Н2О = CH3COOH + OH-
г) K+ + Н2О = KОН + OH-
5. Произведение растворимости хромата серебра в 100 мл насыщенного раствора которого содержится 0,002156 г Ag2CrO4 равно:
а)1,1*10–11 б) 1,1*10–8 в) 1,1*10–18 г) 1,1*10–8
6. Водородный показатель (рН) ацетатной буферной смеси равен:
а) 10,2 б) 4,7 в) 2,2 г) 12,7
7.Водородный показатель насыщенного раствора гидроксида магния, если произведение растворимости ПР Mg(OH)2=3*10-11 равен:
а) 4 б) 10 в) 2,2 г) 12,7
8. Степень окисления атома вольфрама в молекуле вольфрамата аммония равна
а) -1 б) +6 в) +4 г) +1
.9. Вольфрамат аммония может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
. PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 + H2O
а) 62 б) 28 в) 54 г) 18
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 26
1.Объем раствора серной кислоты (плотность раствора 1,202г/см3),который необходимо разбавить водой, чтобы получить 1,5 л кислоты с молярной концентрацией эквивалента 0,1моль/л равен:
а) 52,36 мл б) 26,27 мл в) 1,32 мл г) 182 мл
2.Молярная концентрация эквивалента сульфата алюминия (моль/л) в растворе, в 250 мл которого содержится 34,2 г Al2(SO4)3 равна:
а) 2,4 б) 1,2 в) 3,6 г) 4,8г
3..Второй ступени гидролиза карбоната натрия соответствует уравнение
а) CO32- + Н2О = CO2+ O Н-
б) HCO3- + Н2О = H2CO3 + OH-
в) CO32- + Н2О = HCO3- + OH-
г) HCO3- + Н2О = CO32- + OH-
4.Сокращенное ионно-молекулярное уравнение
H2S + 2OH- - = S2- + 2H2O
соответствует реакции взаимодействия
а) гидроксида цинка и сероводородной кислоты
б) сульфида аммония и сероводородной кислоты
в) гидроксида бария и сероводородной кислоты
г) сульфида калия и гидроксида аммония
5. Ионное произведение воды при 250С равно
а) 10-2 б) 10-14 в) 20*10-14 г) 14*10-1
6. Водородный показатель 0,1м сероводородной кислоты, если константа диссоциации H2S по первой ступени К H2S=5,7*10-8, равен
а) 10,21 б) 4,12 в) 2,24 г) 4,7
7. Растворимость фосфата серебра при 200С равна 0,0065г/л.
Произведение растворимости равно:
а) 1,7*10-18 б) 1,7*10-5 в) 1,7*10-15 г) 1,7*10-8
8. Степень окисления атома хрома в молекуле хромата натрия равна
а) +3 б) +5 в) +6 г) +2
9. Хромат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Ag +NaCN +O2 +H2O = Na[Ag(CN)2 + NaOH]
а) 23 б) 54 в) 42 г) 32
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 27
1.Масса хлорида алюминия, необходимая для приготовления 0,20л 0,25н раствора равна
а) 4,350г б) 6,675г в) 2,225г г) 8,700г
2.Массовая доля (%) гидроксида калия в 0,2л раствора (р =1,035г/см3), содержащего 20,7г
KOH равна
а) 2,00 б) 20,00 в) 10,0 г) 0,05
3.При диссоциации дигидроксохлорида алюминия на второй ступени процесса образуется
катион
а) Al(OH)2+ б) Al3+ в) AlO+ г) AlOH2+
4.Сокращенное ионно-молекулярное уравнение
H2S + 2OH-- = S2- + 2H2O
соответствует реакции взаимодействия
а) гидроксида цинка и сероводородной кислоты
б) сульфида аммония и сероводородной кислоты
в) гидроксида бария и сероводородной кислоты
г) сульфида калия и гидроксида аммония
5.Произведение растворимости карбоната бария, в насыщенном растворе которого объемом
200мл содержится 0,3914г соли равно
а) 1,4*10-10 б) 0,7*10-8 в) 1,7*10-6 г) 0,2*10-5
6.Водородный показатель 0,001н раствора гидроксида натрия равен
а) 11 б) 3 в) 8 г) 7
7.Концентрация
ионов гидроксида в растворе сильного основания равна
а) константе диссоциации основания
б) степени диссоциации основания
в) произведению степени диссоциации на концентрации ионов гидроксида
г) основности гидроксида
8.В растворе гидролизуюшейся соли селенида натрия среда
а) кислая б) щелочная в) нейтральная г) никакая
9.Степень окисления атома хрома в молекуле хромата аммония равна:
а) +6 б) -6 в) +3 г) -3
10.Сумма стехиометрических коэффициентов в уравнении ОВР равна
KMnO4 + KI + H2SO4 = MnSO4 + I2 + K2SO4 +H2O
а) 41 б) 30 в) 22 г) 26
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 28
1.Массовая (процентная) концентрация раствора (%), полученного при прибавлении
300 г воды к 250 г 15% раствора гидроксида натрия равна:
а) 6,82 б) 3,41 в) 2,63 г) 1,89
2.Титр 0,05 н раствора оксалата натрия, г/мл (Na2C2O4) равен:
а) 0,00245 б) 0,006700 в) 0,00123 г) 0,003350
3..Второй ступени диссоциации дигидровисмутата (V) натрия соответствует уравнение
 а) Na2HBiO 4 2Na+ + HBiO42-
а) Na2HBiO 4 2Na+ + HBiO42-
 б) H2BiO4- H+ + HBiO42-
б) H2BiO4- H+ + HBiO42-
 в) NaH2BiO4 Na+ + H2BiO4-
в) NaH2BiO4 Na+ + H2BiO4-
 г) HBiO42- H+ + BiO43-
г) HBiO42- H+ + BiO43-
4.Координационное число комплексообразователя в молекуле сульфат тетрааквамеди (II)
а) 2 б) 4 в) 6 г) 8
5.Самый слабый электролит
а) KNO3 б) HNO3 в) HNO2 г) NH4OH
6. Водородный показатель насыщенного раствора гидроксида магния, если произведение растворимости ПР Mg(OH)2=3*10-11 равен:
а) 4 б) 10 в) 2,2 г) 12,7
7. Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
8. Степень окисления атома хлора в молекуле хлората калия равна
а) +3 б) +5 в) -3 г) -5
9. Хлорат калия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
SnSO4 + KMnO4 + H2SO4 = Sn (SO4)2+ MnSO4 +K2SO4 +H20
а) 27 б) 31 в) 43 г) 24
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 29
1. Молярная концентрация (моль/л) ортофосфорной кислоты в растворе, полученном растворением 18 г Н3РО4 в 282 г воды (плотность раствора 1,031г/см3)
равна:
а) 0,232 б) 0,465 в) 0,63 г) 6,3
3.При диссоциации дигидроксосульфата алюминия на второй ступени процесса образуется
катион
а) Al(OH)2+ б) Al3+ в) AlO+ г) AlOH2+
4.Степень диссоциации гидроксида аммония (%) в растворе с концентрацией 0,1 моль/л
(константа диссоциации KNH4OH=1,8*10-5)
а) 2,2 б) 4,5 в) 6,2 г) 1,3
5. Водородный показатель (рН) карбонатной буферной смеси равен:
а) 10,3 б) 4,7 в) 2,2 г) 12,7
6. Водородный показатель 0,001 м раствора гидроксида натрия (α=1) равен:
а) 2 б) 11 в) 7 г) 8
7. Произведение растворимости карбоната бария, в насыщенном растворе которого объемом
200мл содержится 0,3914г соли равно
а) 1,4*10-10 б) 0,7*10-8 в) 1,7*10-6 г) 0,2*10-5
8. Степень окисления атома азота в молекуле нитрита натрия равна
а) +3 б) +5 в) +4 г) -5
9. Нитрит натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
NaI + KClO3 + H2SO4 = I2+ KCl +Na2SO4 + H2O
а) 27 б) 34 в) 20 г) 14
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 30
1. Молярная концентрация раствора серной кислоты с массовой долей H2S04 в этом растворе 12%(плотность раствора 1,08 г/мл)
а) 2,36 моль/л б) 0,54 моль/л в) 1,32 моль/л г) 1,82 моль/л
2.Масса щавелевой кислоты (Н2С2О4*2Н2О) для приготовления 2л раствора с молярной концентрацией эквивалента 0,2 моль/л равна:
а) 2,52 г б) 25,2г в) 252г г) 0,252г
3..Второй ступени диссоциации дигидроарсената (V) натрия соответствует уравнение
 а) Na2HAsO 4 2Na+ + HAsO42-
а) Na2HAsO 4 2Na+ + HAsO42-
 б) H2AsO4- H+ + HAsO42-
б) H2AsO4- H+ + HAsO42-
 в) NaH2AsO4 Na+ + H2AsO4-
в) NaH2AsO4 Na+ + H2AsO4-
 г) HAsO42- H+ + AsO43-
г) HAsO42- H+ + AsO43-
4.Степень диссоциации гидроксида аммония (%) в растворе с концентрацией 0,1 моль/л
(константа диссоциации KNH4OH=1,8*10-5)
а) 2,2 б) 4,5 в) 6,2 г) 1,3
5. Водородный показатель (рН) фосфатной буферной смеси равен:
а) 10,2 б) 8,0 в) 2,2 г) 4,7
6.Водородный показатель 0,1м раствора гидроксида аммония (Кд 1,8*10-5) равен
а) 2,0 б) 12,8 в) 6,38 г) 11,13
7. Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
8. Степень окисления атома свинца в молекуле плюмбата натрия равна
а) +3 б) +4 в) -3 г) +6
9. Плюмбат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
PbS + HNO3 ® S + Pb(NO3)2 + NO + H2O
а) 27 б) 54 в) 23 г) 18
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 31
1.Массовая (процентная) концентрация раствора (%), полученного при прибавлении
300 г воды к 250 г 15% раствора гидроксида натрия равна:
а) 6,82 б) 3,41 в) 2,63 г) 1,89
2.Молярная концентрация эквивалента сульфата алюминия (моль/л) в растворе, в 250 мл которого содержится 34,2 г Al2(SO4)3 равна:
а) 2,4 б) 1,2 в) 3,6 г) 4,8г
а) 0,00245 б) 0,006700 в) 0,00123 г) 0,003350
3..Второй ступени диссоциации дигидровисмутата (V) натрия соответствует уравнение
 а) Na2HBiO 4 2Na+ + HBiO42-
а) Na2HBiO 4 2Na+ + HBiO42-
 б) H2BiO4- H+ + HBiO42-
б) H2BiO4- H+ + HBiO42-
 в) NaH2BiO4 Na+ + H2BiO4-
в) NaH2BiO4 Na+ + H2BiO4-
 г) HBiO42- H+ + BiO43-
г) HBiO42- H+ + BiO43-
4. Константа диссоциации муравьиной кислоты (%) в 0,5м растворе, при концентрации ионов водорода 0,01моль/л равна:
а) 4,02*10-6 б)2,0 4*10-4 в) 6,02*10-10 г) 8,04*10-2
4.Степень диссоциации гидроксида аммония (%) в растворе с концентрацией 0,1 моль/л
(константа диссоциации KNH4OH=1,8*10-5)
а) 2,2 б) 4,5 в) 6,2 г) 1,3
5. Водородный показатель (рН) фосфатной буферной смеси равен:
а) 10,2 б) 8,0 в) 2,2 г) 4,7
6.Водородный показатель 0,1м раствора гидроксида аммония (Кд 1,8*10-5) равен
а) 2,0 б) 12,8 в) 6,38 г) 11,13
7. Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
8. Степень окисления атома хрома в молекуле хромата натрия равна
а) +3 б) +5 в) +6 г) +2
9. Хромат натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Zn + HNO3 = Zn(NO3)2 + NH4NO3 +H2O
а) 87 б) 54 в) 23 г) 22
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 32
1. Молярная концентрация раствора серной кислоты с массовой долей H2S04 в этом растворе 12%(плотность раствора 1,08 г/мл)
а) 2,36 моль/л б) 0,54 моль/л в) 1,32 моль/л г) 1,82 моль/л
2. Объем серной кислоты плотностью 1,84 г/см3 (W=96%) для приготовления 3л 0,4н раствора равен:
а) 1,96 мл б) 0,98 мл в) 138мл г) 33,32 мл
3..Второй ступени гидролиза нитрата железа (III) соответствует уравнение
а) FeOH2+ + Н2О = Fe(ОН)2+ Н+
б) Fe3+ + Н2О = FeОН2+ + H+
в) Fe(OH)3 + Н2О = Fe3+ + H+
г) Fe(ОН)2+ + Н2О = Fe3+ + H+
4. Константа диссоциации муравьиной кислоты (%) в 0,5м растворе, при концентрации ионов водорода 0,01моль/л равна:
а) 4,02*10-6 б)2,0 4*10-4 в) 6,02*10-10 г) 8,04*10-2
5. Ионное произведение воды при 250С равно
а) 10-2 б) 10-14 в) 20*10-14 г) 14*10-1
6. Водородный показатель (рН) 0,1м раствора гидроксида аммония (КNH4OH=1,8*10-5) равен:
а) 10,24 б) 11,13 в) 2,24 г) 4,72
7. Произведение растворимости хромата серебра, если в 500мл раствора содержится 0,011г Ag2CrO4 равно:
а) 2,34*10-14 б) 1,45*10-13 в) 1,7*10-6 г) 1,1*10-12
8. Степень окисления атома серы в молекуле сульфита натрия равна
а) +2 б) +4 в) -4 г) +6
9. Сульфит натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
H2S + KMnO4 + H2SO4 = S+ MnSO4 +K2SO4 + H2O
а) 17 б) 28 в) 26 г) 14
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 33
1.Молярная концентрация эквивалента (моль/л) ортофосфорной кислоты в растворе, полученном растворением 18 г Н3РО4 в 282 г воды (плотность раствора 1,031г/см3)
а) 0,189 б) 0,465 в) 2,63 г) 1,89
2.Массовая (процентная) концентрация 0,25м раствора о-фосфорной кислоты (Н3РО4) равна:
а) 25,2 % б) 2,37% в) 1,52% г) 0,252%
3..Второй ступени гидролиза карбоната аммония соответствует уравнение
а) NH4+ + CO32- + Н2О = HCO3- + NH4OН
б) NH4 HCO3- + Н2О = H2CO3 + OH-
в) NH4+- + CO32 + Н2О = NH4CO3- + OH-
г) NH4+ + HCO3- + Н2О = H2CO3 + NH4OН
4. Константа диссоциации муравьиной кислоты (%) в 0,5м растворе, при концентрации ионов водорода 0,01моль/л равна:
а) 4,02*10-6 б)2,0 4*10-4 в) 6,02*10-10 г) 8,04*10-2
5. Водородный показатель (рН) карбонатной буферной смеси равен:
а) 10,3 б) 4,7 в) 2,2 г) 12,7
6. Водородный показатель 0,001 м раствора гидроксида натрия (α=1) равен:
а) 2 б) 11 в) 7 г) 8
7. Произведение растворимости карбоната бария, в насыщенном растворе которого объемом
200мл содержится 0,3914г соли равно
а) 1,4*10-10 б) 0,7*10-8 в) 1,7*10-6 г) 0,2*10-5
8. Степень окисления атома фосфора в молекуле фосфида натрия равна
а) +3 б) +5 в) -3 г) -5
9.. Фосфид натрия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10 Сумма стехиометрических коэффициентов в уравнении ОВР равна
Os +HNO3 =OsO4 +NO2 + H2O
а) 27 б) 34 в) 23 г) 24
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 34
1.Молярная концентрация эквивалента раствора серной кислоты плотностью 1,14г/см3 (W=20%) равна
а) 0,232г б) 0,465 в) 4,65 г) 2,32г
2. Масса сульфита калия для приготовления 500мл 0,01н раствора равна
а) 0,69г б) 1,38г в) 0,138г г) 0,399г
3.При диссоциации дигидроарсената натрия по первой ступени образуется анион
а) H2AsO4- б) HAsO42- в) AsO43- г) As-3
4.Сокращенное ионно-молекулярное уравнение реакции взаимодействия
гидроксида железа (III) и серной кислоты:
а) Fe(OH)3 + 2H+ = Fe3+ + 2H2O
б) Fe3+ + SO42- = Fe2+ + 2H+
в) Fe(OH)3 + SO42- = Fe3+ +2H2O
г) Fe(OH)3 + 3H+ = Fe3+ +3H2O
5.Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
6.Ионное произведение воды при 250С равно
а) 10-2 б) 10-14 в) 20*10-14 г) 14*10-1
7.Водородный показатель 0,01м раствора гидроксида натрия равен
а) 10,2 б) 1,02 в) 12,0 г) 12,7
8. Степень окисления атома кремния в молекуле силиката калия равна
а) -1 б) +7 в) +4 г) +1
9. Сульфит калия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10. Сумма стехиометрических коэффициентов в уравнении ОВР равна
Mn + HNO3 = Mn(NO3)2 + NO + H2O
а) 20 б) 28 в) 12 г) 8
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 35
1.Массовая доля сульфата натрия в 200 мл раствора (р=1,02г/см3), содержащего 20,84г соли равна
а) 0,232% б) 4,65% в) 10,2% г) 25,8%
2. Масса карбоната калия для приготовления 250мл 0,04н раствора равна
а) 0,69г б) 1,38г в) 0,138г г) 1,89г
3.При диссоциации гидрофосфата натрия по первой ступени образуется анион
а) H2PO4- б) HPO42- в) PO43- г) P+5
4.Сокращенное ионно-молекулярное уравнение реакции взаимодействия
гидроксида меди (II) и серной кислоты:
а) Cu2+ + H2SO4 = CuSO4 + 2H+
б) Cu2+ + SO42- = Cu2+ + 2H+
в) Cu(OH)2 + SO42- = Cu2+ +2H2O
г) Cu(OH)2 + 2H+ = Cu2+ +2H2O
5.Концентрация ионов бария в насыщенном растворе BaF2 равна 0,75*10-2 моль/л, чему соответствует произведение растворимости
а) 2,34*10-4 б) 3,7*10-8 в) 1,7*10-6 г) 1,7*10-10
6.Концентрация ионов водорода в 0,05м растворе азотнои кислоты равна
а) 0,2*10-12 б) 5,0*10-2 в) 4,0*10-14 г) 2,0*10-4
7.Водородный показатель 0,05м раствора гидроксида натрия равен
а) 10,2 б) 1,02 в) 8,2 г) 12,7
8. Степень окисления марганца в молекуле перманганата калия равна
а) -1 б) +7 в) +5 г) +1
9. Бромат калия может проявлять
а) только окислительные свойства
б) только восстановительные свойства
в) окислительные и восстановительные свойства
г) нейтральные свойства
10. Сумма стехиометрических коэффициентов в уравнении ОВР равна
Ni + HNO3 = Ni (NO3)2 + N2 + H2O
а) 28 б) 18 в) 29 г) 8
ТЕСТ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫАНАЛИТИЧЕСКОЙ ХИМИИ
Инструкция:
укажите правильный ответ на основании расчетов, логических выводов, теоретических положений
Вопросов 10 Ответов 10
ВАРИАНТ 36
1.Молярная концентрация эквивалента (моль/л) раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, (плотность полученного раствора 1,12 г/см3) равна:
а) 1,96 б) 0,98 в) 138 г) 3,46
&nbs