Регенерация мышечной ткани.
Физиологическая регенерация проявляется в форме гипертрофии мышечных волокон, что выражается в увеличении их толщины и даже длины, увеличение числа органелл, главным образом миофибрилл, а также нарастании числа ядер, что, в конечном счете проявляется увеличением функциональной способности мышечного волокна. Радиоизотопным методом установлено, что увеличение числа ядер в мышечных волокнах в условиях гипертрофии достигается за счет деления клеток миосателлитов и последующего вхождения в миосимпласт дочерних клеток.
Увеличение числа миофибрилл осуществляется посредством синтеза актиновых и миозиновых белков свободными рибосомами и последующей сборки этих белков в актиновые и миозиновые миофиламенты параллельно с соответствующими филаментами саркомеров. В результате этого вначале происходит утолщение миофибрилл, а затем их расщепление и образование дочерних миофибрилл. Кроме того, возможно образование новых актиновых и миозиновых миофиламентов не параллельно, а встык предшествующим миофибриллам, чем достигается их удлинение. Саркоплазматическая сеть и Т-канальцы в гипертрофирующемся волокне образуются за счет разрастания предшествующих элементов. При определенных видах мышечной тренировки может формироваться преимущественно красный тип мышечных волокон (у стайеров) или белый тип мышечных волокон (у спринтеров). Возрастная гипертрофия мышечных волокон интенсивно проявляется с началом двигательной активности организма (1-2 года), что обусловлено, прежде всего, усилением нервной стимуляции. В старческом возрасте, а также в условиях малой мышечной нагрузки наступает атрофия специальных и общих органелл, истончение мышечных волокон и снижение их функциональной способности.
Репаративная регенерация
Гладкие мышцы. Клетки обладают способностью к митозу и амитозу и при небольших дефектах регенерируют достаточно полно. При глобальном повреждении происходит рубцевание или неполная регенерация. Новообразование волокон идёт путём метаплазии клеток соединительной ткани: фибробласты превращаются в миобласты.
Поперечно-полосатая мускулатура. Регенерирует лишь при сохранении сарколеммы путём почкования. Источником регенерации являются располагающиеся под сарколеммой клетки-сателлиты.
Сателлитные клетки ("клетки-спутники") - моноядерные миогенные стволовые клетки, расположенные между базальной ламиной и клеточной мембраной (сарколеммой) скелетного мышечного волокна и являющиеся главными участниками постнатального мышечного роста. Сателлитные клетки впервые описаны в 1961 г. (Mauro A.). Это открытие позволило решить многолетнюю проблему: почему растет число ядер и размер миофибриллы без видимых ядерных делений? В результате последующих электронно-микроскопических исследований покоящиеся клетки, лежащие на поверхности мышечного волокна под его базальной мембраной получили название - сателлитные. Они составляют 2-5 % субламинальных ядер и в нормальных условиях митотически инертны, однако активируются к пролиферации при постнатальном росте и регенерации мышцы в ответ на повреждение или физические упражнения и начинают делиться, 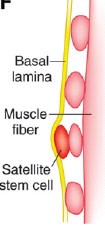 проходя через самообновление и дифференциацию в зрелую мышечную клетку. С возрастом способность скелетных мышц к регенерации снижается.
проходя через самообновление и дифференциацию в зрелую мышечную клетку. С возрастом способность скелетных мышц к регенерации снижается.
Для успешной регенерации мышечной ткани необходимо сохранение напряжения мышцы, восстановление кровоснабжения и нервной связи. Основным источником регенерации являются миосателлитоциты. После активации последних происходит их митотическое деление, возникают миобласты, которые претерпевают дифференцировку, сливаются друг с другом и формируют симпласты. Развитие симпластов продолжается с участием размножающихся миосателлитоциов, часть которых сливается с растущими симпластами. Так формируются новые клеточно-симпластические системы — мышечные волокна.
Поперечно-полосатые мышечные волокна регенерируют путём амитотического деления клеток здоровой ткани, которая граничит с повреждённой. Здоровая ткань образует выпячивания, которые затем сливаются и происходит восстановление поперечной исчерченности и саркомеров.
Регенерация мышцы сердца при повреждении заканчивается рубцеванием дефекта.
Зрелые мышечные волокна — продукт конечной дифференцировки, не способны к делению. Рост и регенерация осуществляется благодаря пролиферации сателлитных клеток. Они по размеру близки к ядрам миоцитов и находятся на периферии мышечных волокон.
В мышечных волокнах количество цитоплазмы находится в определённых пределах — мионуклеарный домен. Увеличение размеров волокна достигается благодаря слиянию пролиферирующих сателлитных клеток с волокном.
Стимул для пролиферации — миотравма, в том числе не уровне отдельного мышечного волокна.
Выходя из состояния покоя, сателлитные клетки начинают экспрессировать миогенные маркёры; они сливаются как с существующим мышечным волокном, так и между собой, образуя новые волокна. Часть клеток возвращается в состояние покоя для восстановления пула сателлитных клеток, в результате хемотаксиса они мигрируют к повреждённым участкам и в зависимости от степени повреждения сливаются с волокном или между собой, закрывая дефект. См. рис.
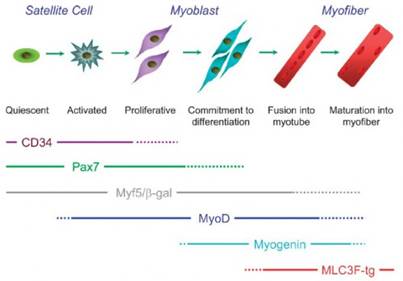
Привести пример: Симметричное и асимметричное деленение стволовых клеток
Ядра сателлитных клеток находятся в центре мышечного волокна, а затем по ходу дифференцировки они мигрируют к периферии.
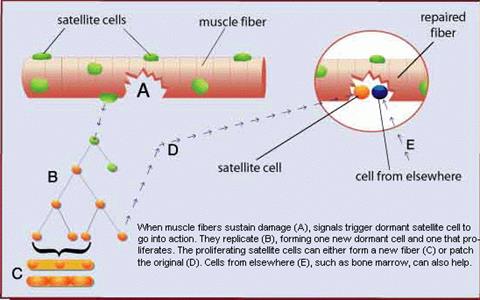
Скелетные мышцы могут повреждаться при травмах, болезнях и некоторых типах физических нагрузок. Повреждения проходят следующие фазы: некроз/дегенерация, воспаление, восстановление и образование шрама (фиброз). Некроз/дегенерация сопровождается разрушением плазматической и базальной мембран, входом внеклеточного кальция и последующим разрушением миофибрилы.Сначала поверхность заполняется воспалительными клетками (моноцитами, макрофагами и Т-лимфоцитами. Последующая секреция ростовых факторов и цитокинов вызывает прилив крови к месту травмы и усиливает воспалительную реакцию. Регенерация мышцы начинается после того, как фагоциты очистят ее от некротической ткани, поэтому блокирование воспалительных клеток (например, нестероидными противовоспалительными средствами) замедляет процесс регенерации, так как выделяемые макрофагами факторы могут играть роль в пролиферации и дифференциации миобластов. Активная регенерация мышцы обычно длится 2-3 недели после травмы.
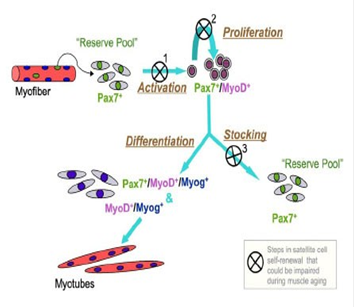
Основную роль в регенерации поврежденных скелетных мышечных волокон играют сателлитные клетки. В ответ на повреждение они активируются и с этого момента могут рассматриваться как миобласты. Миобласты объединяются вместе у базальной ламины поврежденного волокна и сливаются, образуя новую миофибриллу (обзор). Каждый миобласт добавляет в миофибриллярный синцитий небольшое количество цитоплазмы и новое ядро. Кроме этого, сателлитные клетки самообновляются, поддерживая пул клеток, способных к дальнейшей регенерации или гипертрофии. (см.)
Причинами уменьшения мышечной ткани служат:
- продолжительные периоды отсутствия мышечной активности (длительный постельный режим или пребывание в невесомости);
- травмы;
- онкологические заболевания;
- осложнения после химиотерапии;
- сепсис;
- некоторые острые хронические инфекции, например, СПИД;
- старческая саркопения — потеря мышечной массы тела у людей после 40 лет.
Снижение способности скелетных мышц к регенерации в процессе старения приводит к саркопении - возраст-зависимому уменьшению количества и величины мышечных волокон - старческой мышечной слабости, проявляющейся в нарушении движений, риске падений, снижении физической активности. Кроме того, старение сопровождается общим снижением регенеративной способности - большой чувствительности к повреждениям мышц и длительным восстановлением после травм (см.).
Для старой скелетной мышцы характерно меньшее число сателлитных клеток на миофибриллу, у людей это снижение становится значительным после 70-летнего возраста. С другой стороны, показано, что при старении сателлитные клетки в значительной степени сохраняют миогенные свойства, хотя по другим данным с возрастом пролиферативный потенциал сателлитных клеток снижается (см.).
Стволовая ниша играет важнейшую роль в поддержании регенеративных свойств скелетной мышцы при старении. Carlson B. and Faulkner J. (1989) нашли, что при трансплантации мышц молодых животных старым регенеративная способность этих мышц соответствует мышцам старых организмов. Напротив, пересадка мышц старых крыс молодым приводит к регенерации, сравнимой с регенерацией у молодых.
Белок GDF-8 является отрицательным регулятором роста и дифференцировки мышечных волокон. Он называется миостатином.
Уровень синтеза миостатина различен в разных скелетных мышцах. Он является одним из признаков полового диморфизма. При одинаковой экспрессии гена миостатина, уровень синтеза миостатина различен в разных скелетных мышцах. Он входит в половой диморфизм. Уровень секретируемого миостатина выше у женщин, чем у мужчин при одинаковой экспрессии гена миостатина. Она начинается в эмбриогенезе и продолжается в мышцах взрослого организма в течение всей жизни.
Сателлитные клетки являются миобластами и во взрослом организме уровень миостатина в этих клетках выше, чем в эмбриогенезе. Т.е. пролиферативная активность постепенно снижается по сравнению с эмбриогенезом.
У людей разных возрастных категорий уровень миостатина различен в сыворотке крови. Наиболее высокий — у женщин и мужчин старше 72 лет. У мужчин и женщин среднего возраста выше, чем у молодых. Уровень миостатина выше у больных СПИДом.
Регенерация миокарда.
Патологические состояния: инфаркт миокарда и др.
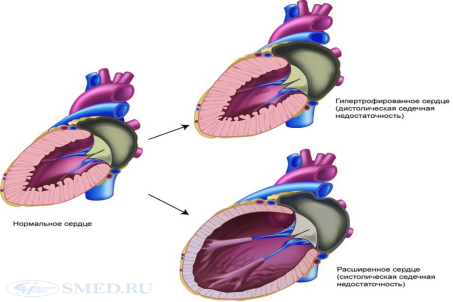
Ремоделирование миокарда — это процесс последовательных адаптационных структурно-функциональных изменений мышцы сердца в результате её повреждения.
При инфаркте миокарда они затрагивают не только повреждённый участок, но и здоровые ткани.
Инфарктная зона постепенно растягивается и подвергается рубцеванию, а не поражённые — гипертрофируются и берут на себя функцию поражённых участков. Наблюдается удлинение и истоньшение миофибрилл, увеличение радиуса между кардиомиоцитами и кардиофиброз. Кардиомиоциты не способны к пролиферации, поэтому замещение дефекта сердечной мышцы происходит без их участия, за счёт клеток стромы (фибробластов).
Если возникло повреждение сердечной мышцы, оно необратимо заканчивается ремоделированием => сердечная недостаточность.
 После инфаркта миокарда острая потеря миокардиальных клеток приводит к аномальным условиям нагрузки не только в тканях, граничащих с зоной инфаркта, но и в отдаленных участках миокардиальной стенки. Это перераспределение нагрузки вызывает дилатацию и изменение формы желудочка, делает его более сферическим и вызывает гипертрофию. Ремоделирование длится несколько месяцев после начального поражения, а конечная форма желудочка отрицательно влияет на насосную функцию сердца. Часто такой тип ремоделирования осложняется дисфункцией митрального клапана и развитием аневризмы, что усугубляет снижение систолической функции сердца. В данном случае также развивается эксцентрический тип ремоделирования. При этом после инфаркта миокарда всегда имеет место увеличение массы миокарда левого желудочка (эксцентрическая гипертрофия).
После инфаркта миокарда острая потеря миокардиальных клеток приводит к аномальным условиям нагрузки не только в тканях, граничащих с зоной инфаркта, но и в отдаленных участках миокардиальной стенки. Это перераспределение нагрузки вызывает дилатацию и изменение формы желудочка, делает его более сферическим и вызывает гипертрофию. Ремоделирование длится несколько месяцев после начального поражения, а конечная форма желудочка отрицательно влияет на насосную функцию сердца. Часто такой тип ремоделирования осложняется дисфункцией митрального клапана и развитием аневризмы, что усугубляет снижение систолической функции сердца. В данном случае также развивается эксцентрический тип ремоделирования. При этом после инфаркта миокарда всегда имеет место увеличение массы миокарда левого желудочка (эксцентрическая гипертрофия).
Ремоделирование миокарда при систолической сердечной недостаточности и диастолической сердечной недостаточности.
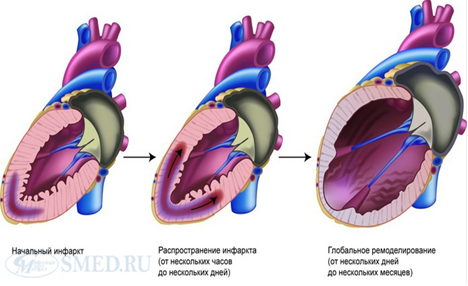
Ремоделирование миокарда после инфаркта.
Полежаев: под влиянием ингибирования соединительной ткани появляются клетки, которые дифференцируются в миофибробласты. Рубцевание меньше, чем при нормальном течении болезни.
Непонятно, что является источником миобластов.
Считается, что кардиомиоциты пролиферировать не могут. У них идёт сложная дифференцировка в процессе онтогенеза. Их сравнивают с нервными клетками.
+ из учебника Бабаева