Металлы — это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которых имеется металлическая связь.
Металлическая связь — химическая связь в металлах, осуществляемая за счет валентных электронов металла, относительно свободно перемещающихся по всему объему образца металла (электронный газ). В узлах кристаллической решетки в твердом состоянии находятся положительно заряженные ионы металла (часть атомов может оставаться в электронейтральном состоянии). Металлическая связь сохраняется при переходе металла в жидкое состояние.
Общие физические свойства металлов — электропроводность, теплопроводность, пластичность и металлический блеск обуславливаются именно наличием металлической связи. Почти все металлы при обычных условиях твердые вещества (исключение Hg).
В периодической системе элементов в главных подгруппах металлы располагаются левее диагонали, проходящей от В к At. Все элементы побочных подгрупп, лантаниды и актиниды являются металлами.
Химические свойства металлов
Все металлы являются восстановителями, то есть отдают валентные электроны и приобретают положительную степень окисления. Высшая положительная степень окисления для металлов главных подгрупп в их соединениях равна номеру группы (например, NaCl, MgCl2, AlCl3, SnCl4), а для металлов побочных подгрупп в их кислородсодержащих соединениях также часто совпадает с номером группы (например, ZnO, TiO2, V2O5, CrO3, KMnO4).
Для металлов главных подгрупп восстановительная активность (способность отдавать электроны) возрастает сверху вниз и справа налево (увеличение атомного радиуса приводит к ослаблению связи валентных электронов с ядром). Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе медленно окисляется, а золото нет; медь вытесняет серебро из его солей):
Свойства оксидов металлов слева направо по периоду и снизу вверх по группе изменяются от основных к амфотерным для металлов главных подгрупп (Na2O и MgO — основные оксиды, Al2O3 и ВеО — амфотерные). Для металлов побочных подгрупп свойства оксидов, в которых металлы проявляют свою высшую степень окисления, изменяются от основных через амфотерные к кислотным (CuO — основный оксид, ZnO — амфотерный, CrO3 — кислотный).
Сила оснований, образуемых металлами главных подгрупп увеличивается справа налево по периоду и сверху вниз по группе [Be(OH)2 и Al(OH)3 — амфотерные гидроксиды, Mg(OH)2 — слабое основание, NaOH и Ca(OH)2— сильные основания). Гидраты оксидов металлов побочных подгрупп с высшими степенями окисления металла вдоль периода слева направо меняют свои свойства от оснований через амфотерные гидроксиды к кислотам [Cu(OH)2 — основание, Zn(OH)2 — амфотерный гидроксид, H2CrO4 — кислота).
1.Взаимодействие с простыми веществами неметаллами
1.1. Галогенами
Ca + Cl2 → CaCl2 (хлорид)
3 Cl2 + 2 Fe 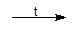 2 FeCl3(хлорид)
2 FeCl3(хлорид)
1.2. Кислородом
2 Ca + O2 → 2 CaO (оксид)
4 Li + O2 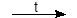 2 Li2O(оксид)
2 Li2O(оксид)
2 Na + O2 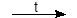 Na2O2(пероксид)
Na2O2(пероксид)
1.3. Серой
2 Na + S → Na2S (сульфид)
1.4. Азотом и фосфором
3 Ca + N2 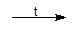 Ca3N2 (нитрид)
Ca3N2 (нитрид)
3 Ca + 2 P 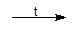 Ca3P2 (фосфид)
Ca3P2 (фосфид)
1.5.Самые активные металлы реагируют с углеродом, кремнием и водородом
6 Na + N2 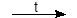 2 Na3N (нитрид).
2 Na3N (нитрид).
Ca + H2 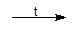 CaH2 (гидрид)
CaH2 (гидрид)
Ca + 2 C 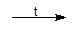 CaC2 (карбид)
CaC2 (карбид)
2.Взаимодействие со сложными веществами. К сложным окислителям относятся вода, кислоты, соли, щелочи.
2.1 С водой
Натрий и кальций вытесняют водород из воды уже при обычных условиях:
2 Na + 2 H2O ® 2 NaOH + H2 Ca + 2 H2O ® Ca(OH)2 + H2
Например, магний реагирует с водой только при нагревании:
Mg + H2O  MgO + H2
MgO + H2
2.2. С кислотами
Ca + 2 HCl → CaCl2 + H2
2 CH3COOH + 2 Na → 2 CH3COONa + H2
2.3. С солями
Cu + 2 AgNO3 ® 2 Ag ¯ + Cu(NO3)2
2.4.Амфотерные металлы растворяются как в кислотах, так и в щелочах
Ве+ 2NаОН + 2H2O → Nа2[Be(OH)4] +Н2
Электрохимический ряд напряжения металлов (ряд стандартных электродных потенциалов — см. таблицу на стр.):
| Li | K | Ba | Ca | Na | Mg | Be | Al | Mn | Zn | Cr | Fe | Cd | Co | Ni | Sn | Pb | (H) | Bi | Cu | Hg | Ag | Pt | Au |
Этот ряд показывает относительную легкость перехода металла из состояния простого вещества в водный раствор в виде гидратированного иона. Чем левее в ряду находится металл, тем легче он окисляется, т.е. тем более сильным он является восстановителем. Электрохимический ряд напряжений металлов можно использовать для предсказания свойств металлов и их солей.
Металл, стоящий левее в ряду, может вытеснять все металлы, стоящие правее его из водных растворов их солей:
Fe + CuSO4 → Cu + FeSO4
Металлы, стоящие левее магния способны вытеснять водород из воды в обычных условиях:
Са + Н2О → Са(ОН)2 + Н2 ↑
Металлы в интервале от магния до водорода могут вытеснять водород из воды при повышенных температурах:
3 Fe + 4 H2O → Fe3O4 + 4 H2 ↑
Металлы, стоящие левее водорода в ряду, вытесняют водород из разбавленных растворов кислот (кроме азотной, в которой происходит восстановление азота):
Zn + 2 HCl → ZnCl2 + H2 ↑
Взаимодействие металлов с кислотами–окислителями (азотная и концентрированная серная кислоты) также происходит в соответствии с эти рядом.
Платина и золото не реагируют с этими кислотами.
Малоактивные металлы (Pb – Ag) восстанавливают разбавленную азотную кислоту до NO, концентрированную азотную кислоту до NO2 и концентрированную серную кислоту при нагревании доSO2/
Металлы средней активности (Cr – Sn) могут восстанавливать разбавленную азотную кислоту до N2O.
Активные металлы (Zn и другие металлы, стоящие левее его в ряду) могут восстанавливать разбавленную азотную кислоту до N2 или иона аммония, а серную кислоту средней концентрации до серы или сероводорода.