Методические указания
по дисциплине «Теплотехника»
(разделы термодинамика и теплопередача)
Сыктывкар 2012
Оглавление
Введение4
1. Уравнение состояния идеального газа6
2. Первый закон термодинамики7
3. Термодинамические процессы9
Изохорный процесс10
Изобарный процесс11
Изотермический процесс13
Адиабатный процесс14
Политропный процесс15
4. Второй закон термодинамики16
5. Круговые термодинамические процессы или циклы18
1) Цикл Карно19
2) Цикл с подводом теплоты при постоянном объеме20
3) Цикл газовой турбины22
4) Цикл Ренкина23
6. Круговые термодинамические процессы или циклы25
7. Основы теплообмена29
Теплопроводность 29
Конвективный теплообмен30
Теплопередача 30
Литература33
ВВЕДЕНИЕ
Последовательность различных курсов как общей, так и теоретической физики определяется прежде всего постепенным переходом к изучению все более сложных форм движения соответствующих структурных видов материи (макротела, молекулы, атомы, электрические частицы и поля).
Механика изучает закономерности простейшей формы движения - относительного перемещения тел в пространстве со временем.
Термодинамика рассматривает явления, обусловленные совокупным действием огромного числа непрерывно движущихся молекул или других частиц, из которых состоят окружающие нас тела. Благодаря очень большому количеству частиц беспорядочное их движение приобретает новые качества: макроскопические свойства систем из большого числа частиц в обычных условиях совершенно не зависят от начального положения этих частиц, в то время как механическое состояние системы существенно зависит от начальных условий. Это один из примеров диалектического закона перехода количественных изменений в качественные: возрастание количества механически движущихся частиц в системе порождает количественно новый вид движения - тепловое движение.
Термодинамика является первым шагом на пути к изучению закономерностей в большом количестве непрерывно движущихся и взаимодействующих частиц (статических закономерностей); для всестороннего и более полного рассмотрения этих закономерностей необходимо применение статистических методов.
Однако термодинамика относительно самостоятельна. Хотя в конечном итоге все свойства физических систем определяются молекулярным движением в них, термодинамика позволяет установить многие из этих свойств, не прибегая к представлению о молекулярном строении тел.
Для решения многих практических задач достаточны методы термодинамики. Основным методом исследования термодинамики XIX века был метод круговых процессов.
В конце XIX века появляются работы Гиббса, которые заложили основу нового метода термодинамических исследований (метод термодинамических потенциалов) и определили общие условия термодинамического равновесия.
Первое начало термодинамики выражает количественную сторону закона сохранения и превращения энергии в применении к термодинамическим системам. Оно устанавливает существование у всякой системы однозначной функции состояния - внутренней энергии, которая не изменяется в отсутствии внешних воздействий при любых процессах внутри системы.
Второе начало термодинамики устанавливает существование у всякой равновесной системы другой однозначной функции состояния - энтропии, которая в отличие от внутренней энергии не изменяется у изолированной системы только при равновесных процессах и всегда возрастает при неравновесных в ней процессах; аналогично ведет себя энтропия и адиабатных систем.
Термодинамика позволяет с помощью своих начал учитывать наблюдаемые на опыте закономерности и получать из них функциональные следствия.
Методические указания строятся по такому плану: сначала обсуждаются основные понятия и исходные положения термодинамики и теплопередачи, рассматриваются методы решения типовых задач и с их помощью разбираются основные приложения термодинамики.
1 УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
1) для 1 кг PV = RT
где Р - абсолютное давление, Па;
V - удельный объём газа, м3;
Т - абсолютная температура, К;
R - удельная газовая постоянная, Дж/кг К;
2) для М кг PV = MRT,
где V - объем газа, м3;
М - масса газа, кг;
3)для 1 моля PV μ - μRТ
где Vμ - объём одного моля, м3/моль;
μ R - универсальная газовая постоянная; Дж (моль К).
Задачи:
1. Определить численное значение универсальной газовой постоянной, используя величины параметров газа для нормальных физических условий:
Р0 = 1,013 105 н/м2; Т0 = 273,15 К
Решение:
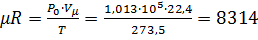 Дж/(моль×К),
Дж/(моль×К),
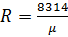 Дж/(моль×К).
Дж/(моль×К).
2. Определить расход метана в газопроводе диаметром d = 800 мм, если скорость течения газа С = 15 м/сек, абсолютное давление Р = 5 MПa, температура 10 °С.
Решение:
Площадь поперечного сечения газопровода  м2
м2
Плотность метана  кг/м3
кг/м3
Массовый расход m - F × р × с = 257 кг/с
3. Баллон с кислородом емкостью 20 л находится под давлением 10 МПа при 15 °С. После израсходования части кислорода давление понизилось до 7,6 МПа, а температура упала до 10 °С. Определить массу израсходованного кислорода.
Решение:
Из уравнения состояния газа 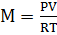 , кг.
, кг.
Находим массу кислорода в баллоне до и после израсходования
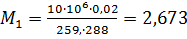 кг
кг
 кг
кг
Тогда расход кислорода М равен
М= M1-M2 = 2,673 - 2,067 - 0,606 кг;
2 ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Первый закон термодинамики является частным случаем общего закона сохранения и превращения энергии, и устанавливает возможность взаимного превращения тепловой и механической энергий. Согласно этому закону тепловая энергия может превращаться в механическую работу и, наоборот, механическая энергия может в превращаться в тепловую, т.е. QÛ L, где Q - количество тепловой энергии, кДж; L - количество механической энергии, кДж. Аналитическое выражение первого закона термодинамики для 1 кг газа
q = U2-U1+L +ΔK
или
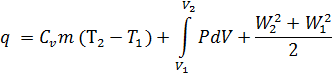
или в дифференциальной форме
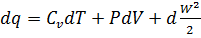 .
.
Аналитическое выражение первого закона может быть представлено в виде 2-х членного выражения, если приращение кинетической энергии незначительно, т.е.
 ;
;
 .
.
Задачи:
1. Один килограмм воздуха в процессе расширения с подводом 100 кДж тепла совершает работу 70 кДж. Определить изменение температуры воздуха в процессе, полагая теплоемкость постоянной величиной.
Решение:
Согласно первому закону термодинамики тепло, подводимое к теплу, расходуется на изменение внутренней энергии и совершение внешней механической работы.
Тогда q = AU +l ; 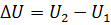 ,
,
Так как 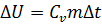 , где
, где 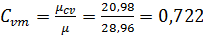 кДж/кг×К,
кДж/кг×К,
Тогда 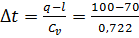 ;
;
2. Определить расход воздуха в системе охлаждения двигателя мощностью Ne = 38 кВт, если отводимое тепло составляет 75 % от работы двигателя, а температура охлаждения воздуха повышается на 15 °С
Решение:
Теплота, отводимая в систему охлаждения, составляет
Q=0,75×38 = 28,5 кДж/с,
Из уравнения теплового баланса
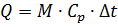 ,
,
Находим
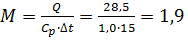 кг/с.
кг/с.
3 ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Термодинамическим процессом называется процесс изменения состояния рабочего тела, связанный с изменением его параметров. В технической термодинамике рассматриваются следующие термодинамические процессы:
¾ изохорный процесс - при постоянном объеме (V=const);
¾ изобарный процесс - при постоянном давлении (P=const);
¾ изотермический процесс - при постоянной температуре (T=const);
¾ адиабатный процесс - без теплообмена с внешней средой (dq=0);
¾ политропный процесс (PV n = const, -∞ < n < +∞).
В таблице 1 приведены основные математические соотношения для указанных термодинамических процессов.
Таблица 1
| Процесс | Уравнение процесса | Соотношение междупараметрами | Механическая работа | Теплота |
| Изохорный | V=const | 
| l =0 | 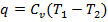
|
| Изобарный | Р=const | 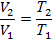
| 
| 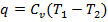
|
| Изотермический | Т=const РV=const | 
| 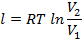
| q=l |
| Адиабатный | dq=0 РVк=const | 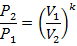
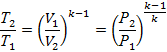
| 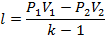
| q=const |
| Политропный | РVn=const | 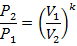

| 
| 

|
Изохорный процесс
Задачи:
1. В закрытом сосуде емкостью у = 0,6 м3 содержится воздух при давлении рл = 0,5 МПа и температуре f = 29 °С. При охлаждении сосуда воздух, находящийся в нем, теряет 105 кДж. Определить давление и температуру воздуха в конце процесса охлаждения, принимая теплоемкость воздуха величиной постоянной 0,722 кДж/кг К.
Решение:
Из уравнения состояния находим
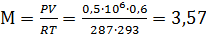 кг,
кг,
Количество теплоты, отводимой от воздуха в процессе, определяется уравнением:
Q = M Cvm(t2-t1)
откуда
 -40,7 + 20 =-20,7 °С,
-40,7 + 20 =-20,7 °С,
Из соотношения параметров в изохорном процессе имеем
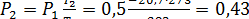 МПа.
МПа.
2. Двигатель внутреннего сгорания работает с подводом теплоты в процессе V=const. Состояние рабочей смеси перед зажиганием: P1 = 1,2 МПа и t1= 400 °С. Определить температуру в конце процесса сгорания, если давление продуктов сгорания Р2 = 4 МПа.
Решение:
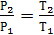 ;
;  К;
К;  °С
°С
Изобарный процесс
Задачи:
1. В цилиндре с объемом 400 л находится воздух при давлении Р1 -0,5МПа и tл =400 °С. От воздуха отнимается теплота в процессе при постоянном давлении благодаря чему в конце процесса устанавливается температура t2 =0 °С. Определить количество потерянной теплоты, конечный объем, изменение внутренней энергии и работу сжатия, считая теплоемкость величиной постоянной. Расчет провести по формуле, связанной с объемом и массой газа.
Решение:
а) Количество потерянной теплоты (в процессе охлаждения) определяем по формуле
Qр=VHC'Pm(t2-t1)
где VH - объем воздуха, приведенный к нормальным условиям, л;
С’Pm - объемная теплоемкость, кДж/м3.
 т3
т3
C'Pm = 1,33 кДж/(м 3 ×н×к)
тогда
Qр = 0,8 × 1,33×(0 - 400) = -425 кДж
б) Это количество теплоты можно определить по формуле
QP=M×CPm(t2-t1),
где М - масса воздуха, кг;
СРт - массовая теплоемкость, кДж/(кг К).
 кг, СРт =1,03 кДж/(кг×К)
кг, СРт =1,03 кДж/(кг×К)
Qр = 1,035-1,03(0-400) = -425 кДж
Конечный объём
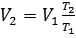 ,
,  м3
м3
Изменение внутренней энергии определяется по формуле
u2-U1=VHС’v т(t2-t1),
Работа, затраченная на сжатие, определяется по формуле
L = P×(V2 – V1) = 0,5 × 106 × (0,162 - 0,4) = -118,9 кДж,
2. Определить тепловую мощность электрического калорифера, предназначенного для нагревания потока воздуха от температуры г, t1= -20 °С до t1 = 20° С; производительность вентилятора 3600 м3/ч. Теплоемкость воздуха считать постоянной. Барометрическое давление Ро = 750 мм рт. ст.
Решение:
Массовый расход воздуха через калорифер
 кг/c
кг/c
Мощность калорифера
Q=M×CPm(t2-t1),
Изотермический процесс
Задачи:
1. Один килограмм воздуха при температуре t1 =30° С и начальном давлении Р, =10,1 МПа сжимается изотермически до конечного давления Р2 = 1 МПа. Определить конечный объем, затрачиваемую работу и количество теплоты, отводимой от газа.
Решение:
Начальный объем воздуха можно определить из уравнения состояния
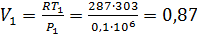 м3/кг
м3/кг
Конечный объем определяется из уравнения
Р1V1=P2V2;  м3/кг
м3/кг
Работа, затрачиваемая на сжатие 1 кг воздуха, получается из уравнения
 ;
;  кДж/кг
кДж/кг
 кДж/кг.
кДж/кг.
2. При изотермическом сжатии 5 м3 азота отводится 600 кДж тепла. Определить работу сжатия, конечное давление Р2 и объем V2 газа, если начальное давление Р1 =0,08 МПа.
Решение:
В изотермическом процессе затрачиваемая работа на сжатие рабочего тела равняется отведенному теплу L = Q = 600 кДж.
Из выражения  ,
,
Находим Р2 = 0,36 МПа,
Конечный объем к  ;
; 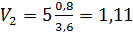 м3.
м3.
Адиабатный процесс
Задачи:
1. В процессе адиабатного сжатия в цилиндре дизеля температура воздуха повышается до величины, равной температуре воспламенения топлива, объем при этом уменьшается в 14 раз. Определить конечные температуры и давления воздуха, если Р1 = 0,1МПа и t1= 100 °С.
Решение:
Конечная температура определяется по формуле
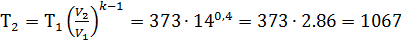 K.
K.
Конечное давление находится из уравнения
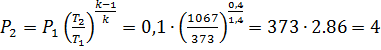 МПа.
МПа.
2. Один килограмм воздуха с начальной температурой t1=20°С и давлением Р, = 0,6 МПа расширяется адиабатно до давления Р2 = 0,1 МПа. Определить параметры состояния в конце процесса расширения, работу процесса и изменение внутренней энергии газа.
Решение:
Температура в конце процесса
 K.
K.
Удельный объем воздуха в конце процесса
 м3/кг
м3/кг
Работа в адиабатном процессе
 кДж/кг
кДж/кг
Политропньш процесс
Задачи:
1. Один килограмм воздуха при P1 =0,5 МПа и t, =111 °С расширяется политропно до давления Р2 =0,1 МПа. Определить конечное состояние воздуха, изменение внутренней энергии, количество подведенной теплоты и полученную работу, если показатель политропы n =1,2.
Решение:
Начальный объем воздуха определяется по уравнению
 м3/кг
м3/кг
Конечный объем воздуха определяется по уравнению
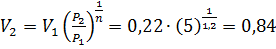 м3/кг
м3/кг
Конечная температура определяется из уравнения состояния
 К
К
Величина работы определяется по формуле
 кДж/кг
кДж/кг
Изменение внутренней энергии
 кДж/кг
кДж/кг
Количество теплоты, сообщенной воздуху, определяется из уравнения
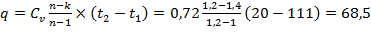 кДж/кг
кДж/кг
2. 1,5 кг воздуха сжимается политропно от Р1 = 0,9 МПа и t1 =18 °с до Р2 = 1 МПа, температура при этом повышается до t2 = 185 °С. Определить показатель политропы, конечный объем, затраченную работу и количество отведенной теплоты.
Решение:
Из уравнения
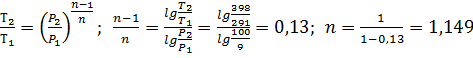
Конечный объем
 м3
м3
Затраченная работа
 кДж/кг
кДж/кг
Количество отведенной теплоты
 кДж/кг
кДж/кг
4. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
Второй закон термодинамики определяет направление, в котором протекают естественные термодинамические процессы, устанавливает условия для преобразования тепловой энергии в механическую, а также показывает величину теплоты, которая может быть преобразована в работу. Второй закон термодинамики математически может быть выражен формулой

где dS- бесконечно малое приращение энтропии системы;
dQ -бесконечно малое количество теплоты, полученное системой от источника теплоты;
Т -абсолютная температура источника теплоты.
Знак неравенства соответствует необратимым (реальным) процессам, а знак равенства - обратимым процессам. Тогда аналитическое выражение второго закона термодинамики для бесконечно малого обратимого процесса имеет вид:
dQ = TdS.
Согласно первому закону термодинамики
dQ = dU + PdV.
Тогда
TdS=dU + PdV
Изменение энтропии между двумя произвольными состояниями газа 1 и 2 определяется по следующим формулам (при постоянной теплоёмкости)
 ;
; 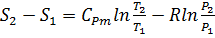 ;
;

Изменение энтропии для термодинамических процессов определяют по формулам:
изохорный процесс 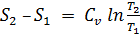 ;
;
изобарный процесс 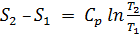 ;
;
изотермический процесс 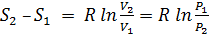 ;
;
адиабатный процесс S = const;
политропный процесс 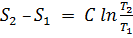 ;
; 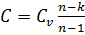
В технической термодинамике приходится иметь дело не с абсолютным значением энтропии, а с её изменением, поэтому отсчет значений энтропии можно вести от любого состояния. Для газов принято считать значение энтропии равным нулю при нормальных условиях, т.е. S1 =0 при P=l01325 Па и T=273615 К (760 мм рт. ст. и 0°С) тогда S2 = S.
Задачи:
1. При 10 м3 воздуха, находящегося в начальном состоянии при нормальных условиях, сжимают до конечной температуры 400 °С. Сжатие производится: изохорно, изобарно, адиабатно и политропно с показателем политропы n=2,2. Считая значение энтропии при нормальных условиях равным 0 и принимая теплоемкость воздуха постоянной, определить энтропию воздуха в конце каждого процесса.
Решение:
Масса 10 м3 воздуха при нормальных условиях:
 кг
кг
Определяем изменение энтропии в каждом из перечисленных процессов: изохорное сжатие
 кДж/К
кДж/К
изобарное сжатие
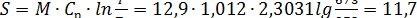 кДж/К
кДж/К
адиабатное сжатие
S=const,
политропное сжатие
 кДж/К
кДж/К
5. КРУГОВЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫИЛИ ЦИКЛЫ
Круговым процессом или циклом, называют совокупность термодинамических процессов, в результате осуществления которых рабочее тело возвращается в исходное положение.
Циклы, протекающие по часовой стрелке, называются прямыми. Прямые циклы лежат в основе работы тепловых двигателей, в которых тепловая энергия частично преобразуется в работу.
Циклы, протекающие против часовой стрелки, называются обратными и требуют для своего осуществления затрат работы (или другого вида энергии).
1) Цикл Карно
Цикл Карно состоит из 2-х изотерм и 2-х адиабат. Цикл Карно является сугубо идеальным циклом и не может быть реализован в двигателях, но он имеет огромное теоретическое значение.
Задачи:
1 кг воздуха совершает цикл Карно в пределах температур t1 = 627 ° C и t2 =27 °С, причем наивысшее давление составляет 6 МПа, а низшее-0,1 МПа. Определить параметры состояния воздуха в узловых точках цикла и количество подведенной и отведенной теплоты.
Изобразим схему цикла Карно в системах координат PV и TS.
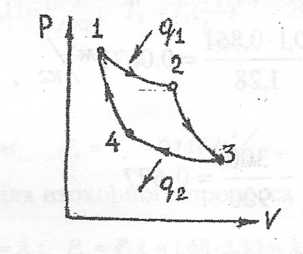
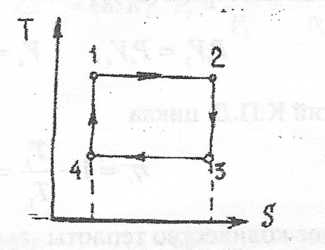
Решение:
Точка 1
Р=6 МПа Т1 =900 К
 м3/кг
м3/кг
Точка 2
Т2 =Т1= 900 К
Из уравнения адиабаты (2-3)
 ;
;  МПа
МПа
Из уравнения изотермы получим
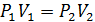
 м3/кг
м3/кг
Точка 3
Р3 = 0,1 МПа и Т3 = 300 K
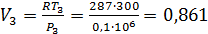 м3/кг
м3/кг
Точка 4
Т4 = 300 К,
Из уравнения адиабаты (4-1) имеем
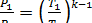 ;
; 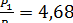 МПа;
МПа; 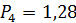 МПа;
МПа;
Из уравнения изотермы (3-4)
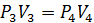 ;
;  м3/кг
м3/кг
Термический К.П.Д. цикла
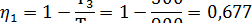
Подведенное количество теплоты
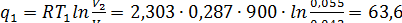 кДж/кг
кДж/кг
Отведенное количество теплоты
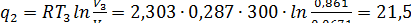 кДж/кг
кДж/кг
Работа цикла
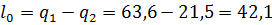 кДж/кг
кДж/кг
2) цикл с подводом теплоты при постоянном объеме
Цикл состоит из двух изохор и двух адиабат. Данный цикл отражает рабочий процесс, протекающий в цилиндре карбюраторного двигателя.
Задачи:
1 кг воздуха совершает цикл с подводом теплоты при постоянном объеме. Определить параметры в узловых точках цикла, полученную работу, термический к.п.д., количество подведенной и отведенной теплоты.
Дано:
Р1=0,1 МПа; t1 = 20 °С; ε = 7,2; λ = 3,33; κ =1,4; теплоемкость величина постоянная.
Решение:
Схема цикла в системах PV и TS

Точка 1
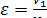 ;
; 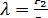 ;
; 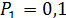 МПа;
МПа; 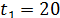 0C
0C
Удельный объем
 м3/кг
м3/кг
Точка 2
 м3/кг;
м3/кг; 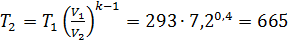 K;
K; 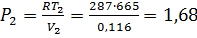 МПа
МПа
Точка 3
Удельный объем V3 = V2 = 0,116 м3/кг
Из выражения для изохорного процесса
 ;
;  МПа;
МПа;
 К.
К.
Точка 4
Удельный объем V4 = V1 = 0,84 м3/кг
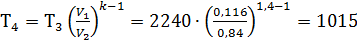 К;
К;
 МПа.
МПа.
Количество подведенной теплоты
 = 0,723(2240 - 665) = 970 кДж/кг
= 0,723(2240 - 665) = 970 кДж/кг
Количество отведенной теплоты
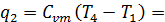 0,723(1015 - 293) = 536 кДж/кг
0,723(1015 - 293) = 536 кДж/кг
Термический к.п.д. цикла можно определить

3) цикл газовой турбины
Цикл газовой турбины с подводом теплоты при состоящей из двух изобар и двух адиабат в системах координат PV и TS показан на следующих схемах:

|

|
Задачи:
Для цикла газовой турбины с подводом теплоты при. Рабочее тело - воздух, теплоемкость принять постоянной. Определить параметры в узловых точках, количество подведенной и отведенной теплоты, полезную работу и термический к.п.д., если дано:
Р2 = 100 кПа; t1 = 27 °С; t3 = 700 ° С.
Решение:
Точка 1
P1=0,1 МПа; Т1=300 К;  м3/кг
м3/кг
Точка 2
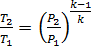 ;
;  K
K
Точка 3
T3=973 К; P3=P2=1 МПа;  м3/кг
м3/кг
Точка 4
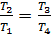 ;
; 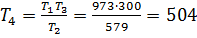 К
К
T4= 229 0C; P4=P1= 0,1 МПа; 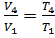 ;
;  м3/кг
м3/кг
Количество теплоты
 = 1,03(973 - 579) = 399 кДж/кг
= 1,03(973 - 579) = 399 кДж/кг
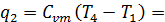 1,03 (500 - 300) = 202 кДж/кг
1,03 (500 - 300) = 202 кДж/кг
Работа цикла
 кДж/кг
кДж/кг
Термический к.п.д. цикла

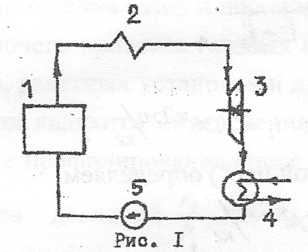
4) Цикл Ренкина
Этот цикл лежит в основе работы паросиловых установок. На рис. 1 показана схема простейшей паросиловой установки; включает паровой котел 1, пароперегреватель 2, паровой двигатель 3, конденсатор 4 и питательный насос 5. На рис. 2 изображен цикл Ренкина для перегретого пара в системе координат TS.
|

|
На схеме цикла точка 1 характеризует состояние пара, поступающего в паровой двигатель (турбину); 1-2 процесс адиабатного расширения пара в турбине; точка 2 - состояние отработавшего пара, выходящего из турбины; 2-3 процесс конденсации пара в конденсаторе; точка 3 характеризует состояние воды (конденсата); 3-4 процесс повышения давления в питательном насосе (условный); 4-5 процесс парообразования в паровом котле; точка 5 - состояние сухого насыщенного пара; 5-1 процесс перегрева пара, протекающий в пароперегревателе.
Термический к.п.д. цикла Ренкина
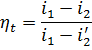
где i1,i2 - начальное и конечное значение энтальпий пара в адиабатном процессе расширения его в турбине; i’2 - энтальпия воды поступающей в паровой котел.
Удельный расход пара и теплоты при осуществлении идеального цикла Ренкина определяется по формулам
 кг/(кВт×ч),
кг/(кВт×ч), 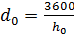 кг/(кВт×ч)
кг/(кВт×ч)
Величина h0=i1-i2 - располагаемый теплоперепад.
Задачи:
1. Паросиловая установка работает по циклу Ренкина. Параметры начального состояния пара: Р1 =2 МПа; t1 =300 °С. Давление в конденсаторе
Р2 = 0,004 МПа. Определить термический к.п.д.
Решение:
Термический к.п.д. цикла Ренкина
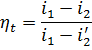
По диаграмме iS находим:
i 1=3019 кДж/кг; i 2=2036 кДж/кг
По таблице ("Вода и перегретый водяной пар") определяем:
i' 2=121,4 кДж/кг
тогда
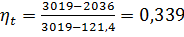
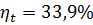
2. Паровая турбина мощность N=24000 кВт работает при начальных параметрах Р1 =8 МПа; t1 =450 ° С. Давление в конденсаторе Р2 =0,004MПa. В котельной установке используется уголь с теплотой сгорания Qpн=25120 кДж/кг, к.п.д. котельной равен 0,8. Температура питательной воды tnв =90 °С. Определить производительность котельной установки и часовой расход топлива при полной нагрузке на паровую турбину, работающей по циклу Ренкина.
Решение:
Пользуясь диаграммой iS находим
i 1=3274 кДж/кг; i 2=1972 кДж/кг
тогда
 кг/(кВт×ч)
кг/(кВт×ч)
Полный расход пара на паровую турбину
D = d0N; D = 2,77 × 24000 = 66480 кг/ч
Это количество пара и определяет паропроизводительность котельной установки (без учета других потребителей пара). Количество теплоты, которое надо подвести к воде, равно
 кДж/ч
кДж/ч
тогда часовой расход топлива определяется по формуле
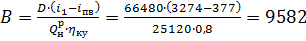 кг/ч
кг/ч
6. ИСТЕЧЕНИЕ ГАЗОВ И ПАРОВ.
Процесс истечения газов и паров имеет большое значение для рассмотрения теории рабочего процесса газовых и паровых турбинах, компрессоров лопаточного типа, ракетных установок и др. Основными вопросами при рассмотрении истечения являются определения скорости рабочего тела, секундного расхода, а также профилирования сопел. Истечение газов и паров связано с наличием перепада давлений  , где P1- давление среды при входе в сопло (в сосуде откуда имеет места истечение), а Р2- давление среды, в которую происходит истечение (давление на выходе из сопла). Полученное числовое значение
, где P1- давление среды при входе в сопло (в сосуде откуда имеет места истечение), а Р2- давление среды, в которую происходит истечение (давление на выходе из сопла). Полученное числовое значение  сравнивают с так называемым критическим отношением давлении для данного газа, которое определяется из выражения
сравнивают с так называемым критическим отношением давлении для данного газа, которое определяется из выражения
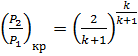
и равным:
¾ для одноатомных газов при К= 1,67 
¾ для двухатомных газов при К=1,4 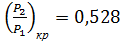
¾ для трех- и многоатомных газов при К=1,29 
В первом приближении процесс истечения можно рассматривать в качестве адиабатного, т.е. бея теплообмена с внешней средой, так как истечение протекает с большими скоростями. Для случая, когда адиабатное истечение происходит при  ,то теоретическая скорость газа у устья суживающегося сопла определяется по формуле
,то теоретическая скорость газа у устья суживающегося сопла определяется по формуле
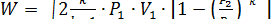 м/с
м/с
где V2 – удельный объем газа на входе в сопло.
Так как PV=RT, то
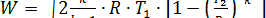 м/с
м/с
Теоретическая скорость истечения может быть также определена по формуле

где i1 и i2 - соответственно энтальпии газа или пара в Дж/кг, или

если i выражено в кДж/кг.
Средний расход газа определяется по формуле
 , кг/с
, кг/с
где f - выходное отверстие сопла, м3.
Если же адиабатное истечение газа происходит при  , то теоретическая скорость истечения будет равна критической скорости и определяется по уравнению
, то теоретическая скорость истечения будет равна критической скорости и определяется по уравнению
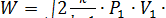 м/с
м/с
а критический расход рабочего тела определяется по формуле
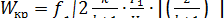 кг/с
кг/с
Задачи:
1. В резервуаре, заполненном кислородом, поддерживается давление Р1 =8 МПа. Истечение кислорода производится через суживающееся сопло в среду с давлением 4 МПа. Начальная температура кислорода 100 °С. Определить теоретическую скорость истечения и его расход, если площадь сечения сопла ¦ = 20 мм2. Процесс истечения считать адиабатным.
Решение:
Находим отношение давлений:
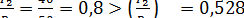
Так как скорость истечения меньше критической, то она определяется по формуле
 м/с
м/с
Из уравнения состояния газа находим:
 м3/ кг
м3/ кг
Тогда
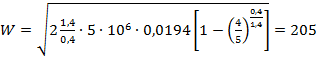 м/с
м/с
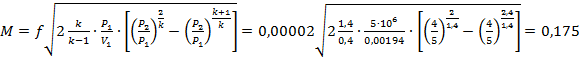 кг/с
кг/с
2. Используя условие предыдущей задачи, определить теоретическую скорость истечения кислорода и его расход, если истечение будет происходить в атмосферу с барометрическим давлением 0,1 МПа.
Решение:
При истечении в атмосферу отношение давлений составляет

Тогда скорость истечения будет равна критической, а расход максимальным, которые определяются по формулам
 м/с
м/с
 кг/с
кг/с
3. Определить теоретическую скорость истечения пара через сопло Лаваля, если давление пара Р1 =1,4 МПа, t1 = 300 °С температура, а противодавление равно 0,006 МПа. Процесс расширения пара считать адиабатным.
Решение:
Из диаграммы iS h0 = i1 - i2 = 896 кДж/кг
7. ОСНОВЫТЕПЛООБМЕНА
Теплопроводность
Уравнение Фурье:

где Q - тепловой поток - количество тепла проходящего через твердую стенку;
X - коэффициент теплопроводности, Вт/(м×К)
 - градиент температуры, К/м;
- градиент температуры, К/м;
F- площадь, м2
 Вт/м2
Вт/м2
q - плотность теплового потока (удельный тепловой поток).
Задачи:
1. Определить количество т