Физические свойства
Чистое золото — мягкий металл жёлтого цвета. Красноватый оттенок некоторым изделиям из золота, например, монетам, придают примеси других металлов, в частности, меди. В тонких плёнках золото просвечивает зелёным. Золото обладает высокой теплопроводностью и низким электрическим сопротивлением.
Золото — очень тяжёлый металл: плотность чистого золота равна 19,32 г/см³ (шар из чистого золота диаметром 46,237 мм имеет массу 1 кг). Среди металлов по плотности занимает седьмое место после осмия, иридия, платины, рения, нептуния и плутония. Сопоставимую с золотом плотность имеет вольфрам (19,25 грамма в одном кубическом сантиметре).
Высокая плотность золота облегчает его добычу, отчего даже простые технологические процессы — например, промывка на шлюзах, — могут обеспечить высокую степень извлечения золота из промываемой породы.
Золото — очень мягкий металл: твёрдость по шкале Мооса ~2,5, по Бринеллю 220—250 МПа (сравнима с твёрдостью ногтя).
Золото также высокопластично: оно может быть проковано в листки толщиной до ~0,1 мкм (100 нм) (сусальное золото); при такой толщине золото полупрозрачно и в отражённом свете имеет жёлтый цвет, в проходящем — окрашено в дополнительный к жёлтому синевато-зеленоватый. Золото может быть вытянуто в проволоку с линейной плотностью до 2 мг/м.
В апреле 2019 года группа российских учёных-физиков под руководством кандидата физико-математических наук Алексея Владимировича Арсенина[11] (Центр фотоники и двумерных материалов МФТИ) впервые в мире получили «двумерное» золото — золотую плёнку толщиной менее 10 нм[12]. Учёным из университета МФТИ удалось узнать, что обычное золото можно превратить в практически абсолютно «плоскую» двумерную структуру толщиной 3—4 нм[13], прикрепив его атомы к особой подложке из сульфида молибдена (MoS2). Подобные плёнки, по мнению российских физиков и нанотехнологов, должны найти применение при создании прозрачной электроники будущего. Результаты прорывного исследования отечественных учёных опубликованы в журнале Advanced Material Interfaces[12]. Исследования новой формы золота показали, что оно сохраняет свойства металла даже при таких сверхмалых толщинах, а сульфидно-молибденовая подложка позволяет перенести плёнку «двумерного золота» практически на любую подложку.[13][14][15][16]
Температура плавления золота 1064,18 °C (1337,33 К)[2], кипит при 2856 °C (3129 К)[2]. Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см3 при температуре плавления. Жидкое золото довольно летучее, оно активно испаряется задолго до температуры кипения.
Линейный коэффициент теплового расширения — 14,2⋅10−6 К−1 (при 25 °C). Теплопроводность — 320 Вт/м·К, удельная теплоёмкость — 129 Дж/(кг·К), удельное электрическое сопротивление — 0,023 Ом·мм2/м.
Электроотрицательность по Полингу — 2,4. Энергия сродства к электрону равна 2,8 эВ; атомный радиус 0,144 нм, ионные радиусы: Аu+ 0,151 нм (координационное число 6), Аu3+ 0,082 нм (4), 0,099 нм (6)[4].
Спектральный коэффициент отражения золота (Au) и для сравнения алюминия (Al) и серебра (Ag)
Причиной того, что цвет золота отличается от цвета большинства металлов, является малость энергетической щели между полузаполненной 6s-орбиталью и заполненными 5d-орбиталями[17]. В результате золото поглощает фотоны в синей, коротковолновой части видимого спектра, начиная с примерно 500 нм, но отражает более длинноволновые фотоны с меньшей энергией, которые не способны перевести 5d-электрон на вакансию в 6s-орбитали (см. рис.). Поэтому золото при освещении белым светом выглядит жёлтым. Сужение щели между 6s- и 5d-уровнями вызвано релятивистскими эффектами — в сильном кулоновском поле вблизи ядра золота орбитальные электроны движутся со скоростями, составляющими заметную часть скорости света, причём на s-электронах, у которых максимум плотности орбитали находится в центре атома, эффект релятивистского сжатия орбитали сказывается сильнее, чем на p-, d-, f-электронах, чья плотность электронного облака в окрестностях ядра стремится к нулю. Кроме того, релятивистское сжатие s-орбиталей увеличивает экранировку ядра и ослабление притяжения к ядру электронов с более высокими орбитальными моментами (непрямой релятивистский эффект). В целом, 6s-уровень снижается, а 5d-уровни растут[18][19].
Химические свойства золота
Золото (Au, от латинского Aurum) - химический элемент 1-й группы периодической системы таблицы Менделеева, атомный номер 79. Почти все природное золото состоит из изотопа 197 Au. Валентность золота в химических соединениях обычно +1, +3. За прошедшие столетия химики (а до них алхимики) провели с золотом огромное количество различных экспериментов, и оказалось, что золото вовсе не так инертно, как об этом думают неспециалисты. Правда, сера и кислород, агрессивные по отношению к большинству металлов (особенно при нагревании), на золото не действуют ни при какой температуре. Исключение – атомы золота на поверхности. При 500–700°С они образуют чрезвычайно тонкий, но очень устойчивый оксид, не разлагающийся в течение 12 часов при нагреве до 800° С. Это может быть Au2O3 или AuO(OH). Такой оксидный слой найден на поверхности крупинок самородного золота.
Не реагирует золото с водородом, азотом, фосфором, углеродом, а галогены с золотом при нагревании образуют соединения: AuF3, AuCl3, AuBr3 и AuI. Особенно легко, уже при комнатной температуре, идет реакция с хлорной и бромной водой. С этими реактивами встречаются только химики. В быту опасность для золотых колец представляет иодная настойка – водно-спиртовый раствор иода и иодида калия:
2Au + I2 + 2KI ® 2K[AuI2].
Щелочи и большинство минеральных кислот на золото не действуют. На этом основан один из способов определения подлинности золота. Весь истолченный металл пересыпается в фарфоровую чашку, куда наливается азотная кислота в количестве, достаточном для покрытия всего металла. Чашку с кислотой и металлом, при непрерывном помешивании стеклянной палочкой, подогревают на примусе до кипения. Если при этом не происходит растворения металла и выделения пузырьков газа, то металл является золотом. Смесь концентрированных азотной и соляной кислот («царская водка») легко растворяет золото:
Au + HNO3 + 4HCl ® H[AuCl4] + NO + 2H2O.
После осторожного выпаривания раствора выделяются желтые кристаллы комплексной золотохлористоводородной кислоты HAuCl4 ·3H2O. Царскую водку, способную растворять золото, знал еще арабский алхимик Гебер, живший в 9–10 веке. Менее известно, что золото растворяется в горячей концентрированной селеновой кислоте:
2Au + 6H2SeO4 ® Au2(SeO4)3 + 3H2SeO3 + 3H2O.
В концентрированной серной кислоте золото растворяется в присутствии окислителей: иодной кислоты, азотной кислоты, диоксида марганца. В водных растворах цианидов при доступе кислорода золото растворяется с образованием очень прочных дицианоауратов:
4Au + 8NaCN + 2H2O + O2 ® 4Na[Au(CN)2] + 4NaOH;
эта реакция лежит в основе важнейшего промышленного способа извлечения золота из руд - цианирования.
Действуют на золото и расплавы из смеси щелочей и нитратов щелочных металлов:
2Au + 2NaOH + 3NaNO3 ® 2Na[AuO2] + 2Na2O,
пероксиды натрия или бария: 2Au + 3BaO2 ® Ba[AuO2]2 + 3BaO,
водные или эфирные растворы высших хлоридов марганца, кобальта и никеля:
3Au + 3MnCl4 ® 2AuCl3 + 3MnCl2,
тионилхлорид: 2Au + 4SOCl2 ® 2AuCl3 + 2SO2 + S2Cl2, некоторые другие реагенты.
Интересны свойства мелкораздробленного золота. При восстановлении золота из сильно разбавленных растворов оно не выпадает в осадок, а образует интенсивно окрашенные коллоидные растворы – гидрозоли, которые могут быть пурпурно-красными, синими, фиолетовыми, коричневыми и даже черными. Так, при добавлении к 0,0075%-му раствору H[AuCl4] восстановителя (например, 0,005%-го раствора солянокислого гидразина) образуется прозрачный голубой золь золота, а если к 0,0025%-му раствору H[AuCl4] добавить 0,005%-й раствор карбоната калия, а затем по каплям при нагревании добавить раствор танина, то образуется красный прозрачный золь. Таким образом, в зависимости от степени дисперсности окраска золота меняется от голубой (грубодисперсный золь) до красной (тонкодисперсный золь).
При размере частиц золя 40 нм максимум его оптического поглощения приходится на 510–520 нм (раствор красный), а при увеличении размера частиц до 86 нм максимум сдвигается до 620–630 нм (раствор голубой). Реакция восстановления с образованием коллоидных частиц используется в аналитической химии для обнаружения малых количеств золота.
При восстановлении соединений золота хлоридом олова в слабокислых растворах образуется интенсивно окрашенный темно-пурпурный раствор так называемого кассиевого золотого пурпура (он назван так по имени Андреаса Кассия, стекловара из Гамбурга, жившего в 17 в.). Кассиев пурпур, введенный в расплавленную стеклянную массу, дает великолепно окрашенное рубиновое стекло, количество затрачиваемого при этом золота ничтожно. Кассиев пурпур применяется и для живописи по стеклу и фарфору, давая при прокаливания различные оттенки – от слаборозового до ярко-красного.
В геологических процессах подвижность золота связана с водными растворами, имеющими высокую температуру (сотни градусов) и находящимися под высоким давлением. Золото при этом может находиться в форме различных простых и смешанных комплексов: гидроксильных, гидроксохлоридных, гидросульфидных. В низкотемпературных гидротермальных условиях, а также в биосфере, миграция золота возможна в виде растворимых металлоорганических комплексов.
В нормальных природных условиях золото стойко к различным типам минеральных вод и атмосферной коррозии. Частицы золота практически не меняются с течением времени. Изделия из золота сделанные тысячи лет назад сохраняются практически неизменными в земле и морской воде. Со временем они не только не теряют своей ценности, но становятся дороже. Такая устойчивость дает основание относить золото к группе благородных металлов.
Проба золота.
Количественное содержание химически чистого золота (по массе) в природном твердом растворе или сплаве (изделии) выражается пробой. В международной практике применяются метрическая (в большинстве стран, в том числе и в России) и каратная системы проб.
При метрической системе содержание металла определяется числом его единиц в 1000 единицах лигатурной массы раствора (сплава), при каратной в 24 единицах. До 1927 года в СССР, а также в дореволюционной России, действовала золотниковая система проб, при которой содержание золота определялось количеством золотников в фунте лигатурной массы (1 русский фунт = 409,5 г = 96 золотникам; 1 золотник = 4,27 г = 96 долям; 1 доля = 44,4 мг).
В метрической системе химически чистому золоту соответствует 1000-я проба, а твердый раствор (сплав), например, 750-й пробы, содержит 750 частей химически чистого золота и 250 частей примесей (лигатуры), или же 75,0% золота и 25,0% примесей.
Расчетом устанавливается взаимное отношение и перевод различных систем проб. Например, 450-я метрическая проба изделия (сплава) соответствует:
450/1000 ´ 96= 43,2 золотниковой
и 550/1000 ´ 24= 10,8 каратной пробам.
Самородное золото обладает различной пробой (наиболее часто 940-900, 890-740, 680-600-й и крайне редко 550-й). Для производства ювелирно-бытовых изделий обычно используются золотые сплавы различной пробы, так как золото в чистом виде слишком мягкое и легко истирается.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путём цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3—0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионообменных смолах. При этом происходят реакции
{\displaystyle {\ce {4 Au + 8 NaCN + O2 + 2 H2O -> 4 Na[Au(CN)2] + 4 NaOH}}} 
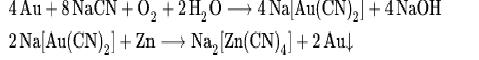 {\displaystyle {\ce {2 Na[Au(CN)2] + Zn -> Na2[Zn(CN)4] + 2 Au v}}}
{\displaystyle {\ce {2 Na[Au(CN)2] + Zn -> Na2[Zn(CN)4] + 2 Au v}}}
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её орошают растворами цианидов, которые, просачиваясь через толщу породы, растворяют золото. После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото, добытое из месторождений, содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах
Домашнее задание: Проработать материал по теме, просмотреть обучающее видео, ответить на один из предложенных вопросов.
https://www.youtube.com/watch?v=td06TollW2Q
1.Всем известно, что смесь двух кислот (как она называется?) растворяет золото. А какая еще кислота растворяет его?
2. У древних славян название «золото» связано с солнцем. Латинское – «aurum» дано в честь богини утренней зари Авроры. Какая страна Восточной Африки названа в честь Золота? Почему?
3. Имеет ли золото отношение к золотому рубину?
4.В царских гробницах древнейших времен найденных в южной части Месопотамии были найдены золотые украшения, в том числе тончайшие пластинки и золотые нити, вплетенные в ткани. Что понимают под термином «сусальное золото»?
5.Что означает выражение «позолотить пилюлю»?
6.Что такое «белое золото», «черное золото», «красное золото», «мягкое золото», «живописное золото»?
7. Что означает выражение «золотое руно», его история?
8.Что означает выражение в литературе «золотое дно», «золотой век», «золотая молодежь», «золотая середина». Их происхождение.
9.Что за мера «золотник»?
10. Какие сплавы золота вам известны и где они применяются?
11.Что означает «червонное золото»?
12.Что такое самородное золото, как его извлекают?
13.В поговорке «не было ни гроша, да вдруг алтын» найдите упоминание о золоте. Какие еще поговорки о золоте вы знаете?
14.Какие географические названия нашей страны связаны с золотом?
15.Какими способами алхимики могли превратить любой металл в золото?
16. Какие химические вещества, имеющиеся в быту, опасно проливать на золотые украшения и почему?
17. Как можно почистить в быту золотое кольцо?
18. Что такое «золотой запас»?