ОСНОВНЫЕ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ
1. Длина химической связи – расстояние между ядрами химически связанных атомов.
Зависит от радиусов атомов (в периоде слева направо R ат. уменьшается; в группе сверху вниз - увеличивается).
Чем меньше атомный радиус, тем короче связь.
Чем короче химическая связь, тем она прочнее.
Задание1. Как меняется Rа, длина связи и ее прочность в рядах:
а) H-N, H-O, H-F
б) H-F, H-Cl, H-Br
2. Кратность связи - определяется числом электронных пар, связывающих два атома.
Так, в молекулах Н2 (H – H), НСl (H – Cl) кратность связи равна единице,
в молекуле O2 (O = O) – двум, а в молекуле азота N2 (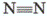 ) – трем.
) – трем.
Одинарная связь длиннее двойной связи, а двойная длиннее тройной связи.
Следовательно, одинарная связь менее прочная, чем двойная связь, а двойная менее прочная, чем тройная.
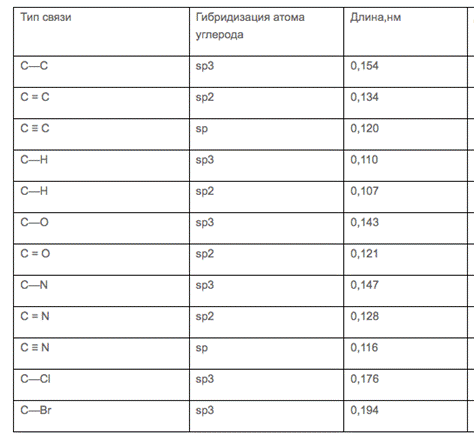
По способу перекрывания электронных облаков химическая связь бывает двух видов: сигма-связь и пи-связь.
Сигма-связь ( s) – это перекрывание электронных облаков на линии, соединяющей ядра атомов (лобовое перекрывание).
Виды
3.
Пи-связь ( p) – перекрывание электронных облаков выше и ниже линии, соединяющей ядра атомов (боковое перекрывание).
Виды
p-связи
Сигма-связь прочнее, чем пи-связь.
Двойная (σ +π)
Тройная (σ + π + π)
F−F
O=O
N≡N
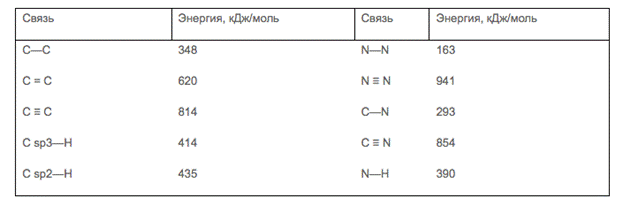
4. Энергия химической связи – энергия, которая выделяется при образовании химической связи или поглощается при разрыве химической связи.
Чем короче связь, тем больше её энергия, тем связь прочнее.
Связь считается прочной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), непрочной - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2).
5. Полярность ковалентной связи — это несимметричность расположения электронной пары на связываемых ею атомах.
С ростом разницы электроотрицательностей атомов химических элементов, образующих химическую связь полярность связи увеличивается.
Например,
в молекуле PH3 связи P—H практически неполярны,
а в молекуле SiF4 связи Si—F очень полярны.
Если связаны одинаковые атомы, то полярность отсутствует: например, в кристалле алмаза связи C—C неполярны, как и связи P—P в молекуле белого фосфора.
6. Поляризуемость – способность молекулы становится полярной в результате действия на молекулу внешнего электрического поля – в частности поля других молекул, вступающих в реакцию.
7. Насыщаемость – определяется способностью атомов образовывать ограниченное число связей. Определяется по валентным возможностям атома, образующего химическую связь (повторите тему «Валентные возможности атомов»).
Например, водород всегда одновалентен:
Азот может быть трехвалентен в молекуле аммиака NH3 и четырёхвалентен в ионе аммония NH4+ (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
8. Направленность – определенное направление химической связи, которое возникает в результате перекрывания электронных облаков. Направленность определяется строением молекулы.
Более подробное представление о форме молекул можно составить на основе гипотезы о гибридизации атомных орбиталей.
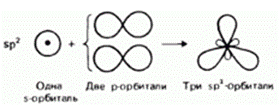
Гибридизация – это выравнивание электронных облаков по форме и энергии.
Виды гибридизации и формы молекул:
| Вид гибридизации | Схема гибридизации | Валентныйугол между гибридными облаками | Геометрия частицы | Число поделенных электронных пар | Число неподеленных электронных пар | Состав частиц | Примеры |
| sp3 | 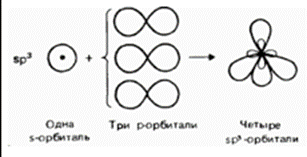
| 
| |||||
| 109028’ | Тетраэдрическая | АВ4 | Алканы (CH4); CCl4, SiCl4, алмаз (С) | ||||
| 107,30 | Пирамидальная | АВ3 | NH3 | ||||
| 104,50 | Угловая | АВ2 | H2O | ||||
| sp2 | 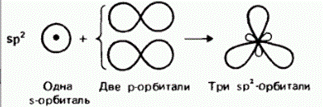
| 1200 | 
| ||||
| Треугольная | АВ3 | Алкены, алкадиены, арены; BCl3, SO3, графит (С) | |||||
| Угловая | АВ2 | O3, SO2 | |||||
| sp | 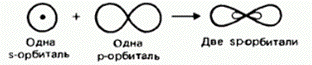
| 1800 |  Линейная
Линейная
| АВ2 | Алкины; BeCl2, CO2, карбин (С) |
Рассмотрим на конкретных примерах.
Задание 2. Заполни последнюю колонку в таблице.
А) sp3-гибридизация
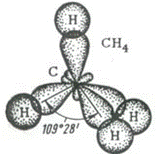
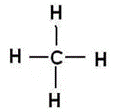
В (С) =
СО (С) =
Способ перекрывания электронных облаков -
Кратность связи –
Форма молекулы -
Угол связи HCH –
NH3
N
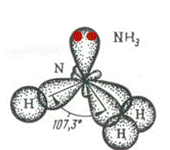
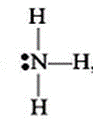
В (N) =
СО (N) =
Способ перекрывания электронных облаков -
Кратность связи –
Форма молекулы –
Угол связи HNH –
H2O
О
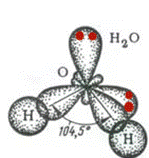
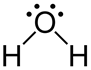
В (O) =
СО (O) =
Способ перекрывания электронных облаков -
Кратность связи –
Форма молекулы –
Угол связи HOH –
Б) sp2-гибридизация

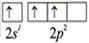
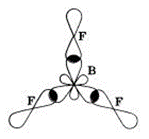
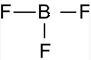
В (B) =
СО (B) =
Способ перекрывания электронных облаков -
Кратность связи –
Форма молекулы –
Угол связи FBF –
Б) sp-гибридизация



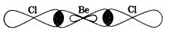
Cl – Be – Cl
В (Be) =
СО (Be) =
Способ перекрывания электронных облаков -
Кратность связи –
Форма молекулы –
Угол связи ClBeCl -
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
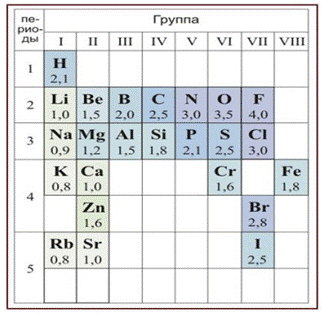
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
Степень окисления элементов в простых веществах равна нулю.
Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
У одноатомных ионов степень окисления равна заряду иона, например: K+ — +1, Ba2+ — +2, Br– — –1, S2– — –2 и т. д.
В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO42–. Ион SO42– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Домашнее задание
1. В каком соединении степень окисления фосфора равна +5?
1) HPO3
2) H3PO3
3) Li3P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO3
2) H3PO3
3) Li3PO4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO2
2) N2O4
3) N2O
4) HNO3
4. В каком соединении степень окисления азота равна –2?
1) NH3
2) N2H4
3) N2O5
4) HNO2
5. В каком соединении степень окисления серы равна +2?
1) Na2SO3
2) SO2
3) SCl2
4) H2SO4
6. В каком соединении степень окисления серы равна +6?
1) Na2SO3
2) SO3
3) SCl2
4) H2SO3
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3P
4) Ca3P2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO3
2) H3PO3
3) Na3PO4
4) Ca3P2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор