Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Для удобства описания окислительно-восстановительных реакций используют понятие степени окисления – величины, численно равной формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой из его связи перешли к более электроотрицательному атому данного соединения. Протекание окислительно-восстановительных реакций сопровождается изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем, вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
1) степень окисления элемента в простом веществе равна нулю;
2) алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
3) алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
4) отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
5) максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической таблице.
Ряд элементов в соединениях проявляют постоянную степень окисления, что используют при определении степеней окисления других элементов:
1) фтор, имеющий наивысшую среди элементов электроотрицательность, во всех соединениях имеет степень окисления –1;
2) водород в соединениях проявляет степень окисления +1, кроме гидридов металлов (–1);
3) металлы IA подгруппы во всех соединениях имеют степень окисления +1;
4) металлы IIA подгруппы, а также цинк и кадмий во всех соединениях имеют степень окисления +2;
5) степень окисления алюминия в соединениях +3;
6) степень окисления кислорода в соединениях равна –2, за исключением соединений, в которых кислород присутствует в виде молекулярных ионов: О2+, О2-, О22-, О3-, а также фторидов OxF2.
Степени окисления атомов элементов в соединении записывают над символом данного элемента, указывая вначале знак степени окисления, а затем ее численное значение, например, 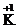
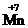
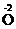 4, в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe2+, SO42–.
4, в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe2+, SO42–.
Окислительно-восстановительные свойства атомов различных элементов проявляются в зависимости от многих факторов, важнейшие из которых – электронное строение элемента, его степень окисления в веществе, характер свойств других участников реакции. Соединения, в состав которых входят атомы элементов в своей максимальной (положительной) степени окисления, например, K 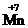 O4, K2
O4, K2 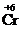 2O7, H
2O7, H 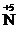 O3,
O3, 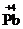 O2, могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например,
O2, могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например,  H3, H2
H3, H2 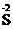 , H
, H 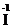 , могут только окисляться и выступать в качестве восстановителей. Вещества, содержащие элементы в промежуточных степенях окисления, например H
, могут только окисляться и выступать в качестве восстановителей. Вещества, содержащие элементы в промежуточных степенях окисления, например H  O2, H2
O2, H2 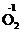 ,
, 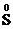 ,
, 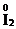 ,
,  Cl3,
Cl3, 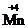 O2, обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать, и отдавать электроны. Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу. Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие соединения переходят окислитель и восстановитель. Основные окислители и восстановители приведены в таблице 12.
O2, обладают окислительно-восстановительной двойственностью. В зависимости от партнера по реакции такие вещества способны и принимать, и отдавать электроны. Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу. Чтобы составить уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие соединения переходят окислитель и восстановитель. Основные окислители и восстановители приведены в таблице 12.
Таблица 12. Основные окислители и восстановители
| Восстановитель | Сила | Среда, условия | До чего окисляется |
| Атомы металлов | Сила восстановителя зависит от свойств металла | Ионы металлов | |
| Водород | Слабый восстановитель | Ионы водорода | |
| Углерод | Сильный восстановитель | При взаимодействии с окислителем средней силы | СO |
| При взаимодействии с сильным окислителем | СO2 | ||
| Фосфор, сера | Слабые восстановители | При взаимодействии с сильным окислителем | P2O5, H3PO4 SO2, H2SO4 |
| H2S и ее соли | Сильный восстановитель | При взаимодействии с окислителем средней силы | S0 |
| При взаимодействии с сильным окислителем | S+6 (в виде SO4 2-) | ||
| SO2 и соли H2SO3 | Слабый восстановитель | SO3, H2SO4 и ее соли | |
| Азотистая кислота HNO2 и ее соли | Слабый восстановитель | Азотная кислота HNO3 и ее соли | |
| Cu + | Слабый восстановитель | Cu 2+ | |
| Fe2+, Cr2+ | Сильный восстановитель | В кислой среде | Fe 3+, Cr 3+ |
| В щелочной среде | Fe(ОН)3, Cr(ОН)3 | ||
| Cr3+ | Слабый восстановитель | В кислой среде | Cr2O7 2- |
| В щелочной среде | CrO4 2- | ||
| Галогеноводород-ные кислоты и их соли | Сильные восстановители (HCl слабый) | Галогены - простые вещества | |
| H2O2 (О -1) | Слабый восстановитель | O20 | |
| Окислитель | Сила | Среда, условия | До чего вос-станавливается |
| Галогены - простые вещества | Сильные окислители (I20 - слабый) | Галогеноводородные кисло-ты и их соли | |
| Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2 | Сильные окислители | В кислой среде | Mn2+(в составе солей) |
| KMnO4 | Сильный окислитель | В нейтральной и слабощелочной среде | MnO2 |
| В сильнощелочной | K2MnO4 (MnО4 2-) | ||
| Хромат калия K2CrO4 и дихромат калия K2Cr2O7 | Сильные окислители | В кислой среде | Cr 3+ (в составе солей) |
| В сильнощелочной | [ Cr(ОН)6 ] 3- | ||
| Серная кислота H2SO4 конц | Сильный окислитель | С неактивными металлами, неметаллами, HBr | SO2 |
| С магнием | S0 | ||
| С цинком | H2S | ||
| Азотная кислота HNO3 разбавл | Сильный окислитель | С тяжелыми металлами | N+2O |
| С легкими металлами | N20; N2+1O | ||
| Очень разбавленная с активными металлами | N-3H3 (NH4NO3) | ||
| HNO3 конц | Сильный окислитель | С неметаллами, тяжелыми металлами | N+4O2 |
| С легкимим металлами | N2+1O | ||
| Кислородсодержащие кислоты галогенов и их соли | Сильные окислители | HОCl HClО3 HBrО3 | Cl -, Br - |
| HIО, HIО3 | I20 | ||
| Fe 3+, Cr 3+ | Слабые окислители | Fe2+, Cr2+ | |
| SO2 и соли H2SO3 | Слабый окислитель | S0 | |
| H2O2 (О -1) | Сильный окислитель | В кислой среде | H2O |
| В нейтральной и щелочной среде | ОН - |
Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса. Метод электронно-ионных полуреакций применяют при составлении уравнений реакций, протекающих в водном растворе, а также реакций с участием веществ, в которых трудно определить степени окисления элементов (например, KNСS, CH3CH2OH). Согласно этому методу выделяют следующие главные этапы составления уравнения реакций:
Записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например:
SO2 + K2Cr2O7 + H2SO4(разб) ®...
Учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов Н+ и ОН-:
SO2 + Cr2O72– + H+ ®...
Определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
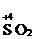 ®
® 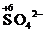 - Окисление восстановителя
- Окисление восстановителя
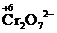 ® 2Cr3+ - Восстановление окислителя
® 2Cr3+ - Восстановление окислителя
Записывают материальный баланс полуреакции окисления и восстановления:
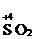 + 2H2O – 2e =
+ 2H2O – 2e = 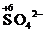 + 4H+
+ 4H+
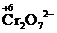 + 14H+ + 6e = 2Cr3+ + 7H2O
+ 14H+ + 6e = 2Cr3+ + 7H2O
Суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:
3∙ôSO2 + 2H2O – 2e = 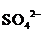 + 4H+
+ 4H+
1∙ô 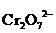 + 14H+ + 6e = 2Cr3+ + 7H2О
+ 14H+ + 6e = 2Cr3+ + 7H2О
3 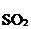 + 6H2O +
+ 6H2O + 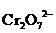 + 14H+ = 3
+ 14H+ = 3 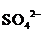 + 12H+ + 2Cr3+ + 7H2О
+ 12H+ + 2Cr3+ + 7H2О
и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение:
3 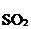 +
+ 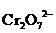 + 2H+ = 3
+ 2H+ = 3 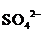 + 2Cr3+ + H2О.
+ 2Cr3+ + H2О.
Добавляют ионы, не участвовавшие в процессе окисления-восстановления, уравнивают их количества слева и справа, и записывают молекулярное уравнение реакции:
3SO2 + K2Cr2O7 + H2SO4 (разб) = Cr2(SO4)3 + K2SO4 + H2O.
При составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя, следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
Метод электронного баланса обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах. Последовательность операций следующая:
1. Записывают формулы реагентов и продуктов реакции в молекулярном виде:
FeCl3 + H2S ® FeCl2 + S + HCl;
2.Определяют степени окисления атомов, меняющих ее в процессе реакции:
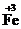 Cl3 + H2
Cl3 + H2 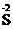 ®
® 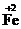 Cl2 +
Cl2 + 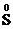 + HCl;
+ HCl;
3.По изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов:
2∙½ 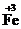 +1e =
+1e = 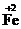
1∙½ 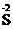 – 2e =
– 2e = 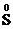
4. Множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты:
2FeCl3 + H2S ® 2FeCl2 + S + HCl
5. Подбирают стехиометрические коэффициенты остальных участников реакции:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl.
Окислительно-восстановительный потенциал. Окислительно-восстановительный потенциал (ОВП) является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах.
ОВП, называемый также редокс-потенциал (от английского RedOx - Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т.е. реакциях, связанных с присоединением или передачей электронов.
Значение окислительно-восстановительного потенциала для каждой окислительно-восстановительной реакции выражается в милливольтах и может иметь как положительное, так и отрицательное значение. В природной воде значение Eh колеблется от -400 до +700 мВ, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе растворов. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в растворах:
Окислительная. Характеризуется значениями Еh > + (100-150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Ситуация, наиболее часто встречающаяся в поверхностных водах.
Переходная окислительно-восстановительная. Определяется величинами Еh от 0 до +100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов.
Восстановительная. Характеризуется значениями Еh < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород.
Окислительно-восстановительный потенциал зависит от температуры и взаимосвязан с рН (кислотностью растворов). ОВП является одним из основных параметров контроля качества воды.