Поведенческие проявления тревоги у животных и тревожные расстройства у людей, как правило, сопровождаются различного рода изменениями на соматическом уровне. Нами на уровне экспериментальных исследований было продемонстрировано, что анксиолитическое действие селанка и даларгина у животных сопровождается коррекцией стресс-индуцированных соматических нарушений сердечно-сосудистой и иммунной систем. На данном этапе работы были выбраны те же условия, в которых проводилось тестирование анксиолитического действия даларгина и селанка.
Так, ранее при тестировании тревожности мышей Balb/c в ПКЛ было обнаружено, что внутрибрюшинные уколы физиологического раствора значительно повышают их тревожность и на этом фоне селанк оказывает выраженное анксиолитическое действие, которое блокируется налоксоном (рис. 3). В исследовании, проведенном по той же схеме на 48 мышах-самцах линии Balb/c, удалось обнаружить кардиотропный эффект селанка. Повышение тревожности, вызванное введением физиологического раствора, сопровождалось стойким повышением ЧСС мышей по сравнению с контрольными животными (632±25 и 527±16 ударов/мин в среднем за 5 мин наблюдения, соответственно, p<0.01). На этом фоне однократное введение селанка (100 мкг/кг) достоверно снижает ЧСС мышей (496±26 ударов/мин в среднем за 5 мин наблюдения) по сравнению с животными, получившими уколы физиологического раствора (p<0.01).
На рисунке 11 представлена динамика сердечного ритма мышей, наблюдавшаяся в течение 5 мин с момента введения электродов мышам, не получавшим до этого никаких инъекций («интактные»), и животным, которым за 30 мин до этого ввели физиологический раствор или селанк. Из рисунка видно, что непосредственно после введения электродов ЧСС «интактных» мышей значительно выше, чем на 2–5 минутах наблюдения (622±17 и 478±23 ударов/мин в первые и последние 30 сек из 5 мин наблюдения, соответственно, p<0.01). Очевидно, это связано с процедурным стрессом введения электродов. Судя по ЧСС, этот стресс сопоставим со стрессом уколов физиологический раствор. Однако, в отличие от «интактных» животных, у мышей, получивших укол физиологический раствор в течение 5 мин тестирования не наблюдается релаксации (снижения сердечного ритма), что соответствует поведенческим данным о повышенной тревожности мышей этой линии, наблюдаемой через 30 мин после укола физиологический раствор (рис. 3).
Введение селанка предотвращает повышение ЧСС мышей в момент введения электродов (460±34 ударов/мин в первые 30 сек наблюдения, p<0.01 по сравнению с тем же показателем у «интактных» животных) и на всем протяжении тестирования достоверно снижает ЧСС мышей по сравнению с животными, получившими уколы физиологический раствор. Сердечный ритм мышей, получивших селанк, в течение 5 минут тестирования достоверно не меняется и остается на уровне ЧСС «интактных» мышей к моменту релаксации после процедурного стресса.
Таким образом, в данном исследовании нам удалось обнаружить кардиотропный эффект селанка, который проявляется в том, что введение этого препарата снижает тахикардию, вызванную как анксиогенным для мышей Balb/c стрессом внутрибрюшинно введения физиологический раствор, так и процедурным стрессом введения электродов.
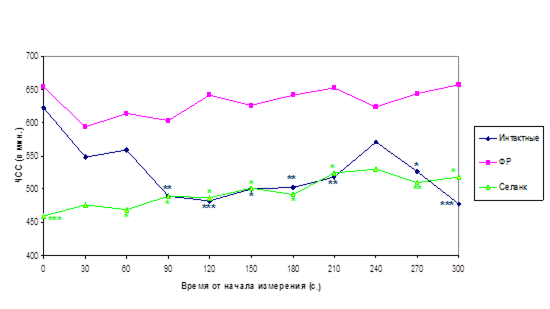
Рисунок 11. Влияние селанка на динамику сердечного ритма мышей Balb/c в условиях процедурного стресса. ЧСС измеряли в течение 5 мин с момента подкожного введения электродов «интактным» мышам и мышам, получившим внутрибрюшинно инъекции физиологический раствор или селанка (100 мкг/кг) за 30 мин до начала тестирования
*, **, *** – p<0.05, 0.01, 0.001 – отличие от ЧСС мышей, получавших физиологический раствор, измеренной в тот же временной интервал.
В настоящее время доказано, что эндогенные опиоидные пептиды, в частности, лей- и мет-энкефалины обладают кардиопротективными свойствами. Помимо центрального действия на эмоциогенные зоны мозга и ядра, отвечающие за вегетативную регуляцию сердечно-сосудистой системы, опиоидные пептиды влияют на симпатическую и парасимпатическую регуляцию сердца и кровеносных сосудов, предотвращая избыточный выброс медиаторов из нервных окончаний соответствующих вегетативных нейронов и нивелируя гиперактивацию адренергических рецепторов на уровне трансмембранной передачи. Считается, что таким путем эндогенные опиоиды предотвращают развитие аритмии, гипертрофии сердца и апоптоз кардиомиоцитов в условиях гиперактивации симпатической нервной системы, например, при хроническом стрессе (Pepe et al., 2004). Кроме того, опиоидные пептиды играют существенную роль в кардиогенезе, выживаемости кардиоцитов в условиях ишемии, репаративных процессах при инфаркте миокарда (Peart et al., 2005).
Таким образом, использование Селанка как ингибитора ферментов деградации эндогенных опиоидных пептидов (энкефалинов) при лечении больных, у которых тревожные расстройства сопровождаются сердечно-сосудистыми заболеваниями, патогенетически вполне обоснованно.
Исследование иммуномодулирующего действия даларгина также проводили в условиях анксиогенного стресса, сопровождающего тестирование животных в «челночных камерах». Изучали пролиферативную активность лимфоцитов крови 84 крыс-самцов популяции Wistar, прошедших обучение в «челночной камере» и получивших после этого пятидневный курс внутрибрюшинного введения физиологического раствора (контрольная группа) или даларгина (20 мкг/кг). В процессе исследования определяли спонтанную пролиферацию лимфоцитов и пролиферативную активность, стимулированную КонА в различных дозах. Затем экстраполяцией кривой доза-эффект вычисляли ту дозу митогена, при которой наблюдается максимальная пролиферация, и определяли индекс стимуляции лимфоцитов по соотношению оптимальной и спонтанной пролиферации. По общей выборке не было обнаружено достоверных отличий между уровнем пролиферации лимфоцитов крови контрольных крыс и крыс, получавших даларгин. Введение даларгина лишь понизило чувствительность клеток к митогену: оптимальная концентрация КонА повысилась от 10.8±1.2 (в контрольной группе) до 14.1±1.0 мкг/мл (p<0,05).
В процессе статистической обработки результатов животные были разбиты на 3 подгруппы в соответствии с их исходной двигательной активностью в ATS. В результате обнаружилось, что спонтанная пролиферация лимфоцитов крыс со «средней» двигательной активностью (СА) значительно ниже, чем у высоко – (ВА) и низко – (НА) активных животных (табл. 10). Величина спонтанной пролиферации в значительной степени отражает функциональную активность лимфоцитов in vivo. Ее изменение может происходить не только под воздействием попадающих в организм антигенов (вирусы, бактерии, искусственная иммунизация и т.д.), но и в результате действия стрессогенных факторов, воздействующих на иммунную систему через ЦНС и нейроэндокринную систему (Pedersen, 1991). Повышение спонтанной пролиферации лимфоцитов НА и ВА крыс по сравнению с СА животными говорит о включении последнего механизма, поскольку с точки зрения антигенных воздействий все животные находились в одинаковых условиях. Возможно, это результат стресса, вызванного обучением в «челночных камерах».
Таблица 10. Влияние даларгина (внутрибрюшинно, 5 дней, 20 мкг/кг ежедневно) на пролиферативную активность лимфоцитов крови крыс популяции Wistar, прошедших курс обучения в «челночной камере»
| показатели пролиф. активн. | Вводимый препарат | Двигательная активность животных | ||
| низкая (n=28) | средняя (n=28) | высокая (n=28) | ||
| Спонтанная пролиферация | физ. р-р | 1114±172 ** | 453±98 | 783±110 * |
| даларгин | 639±55 ** # | 399±44 | 834±135 ** | |
| Оптимальная пролиферация | физ. р-р | 18380±3873 ** | 39680±3490 | 55247±10860++ |
| даларгин | 38899±9375 # | 38502±5073 | 39871±8231 | |
| Индекс стимуляции | физ. р-р | 24±6 ** | 128±26 | 80±19 * ++ |
| даларгин | 49±8 ** # | 102±13 | 63±12 * | |
| Оптимальная конц. КонА | физ. р-р | 11.4±1.6 | 10.4±1.5 | 10.6±1.2 |
| даларгин | 15.9±1.7 | 12.2±0.8 | 14.2±1.0 # |
** p<0.01, * p<0.05 – отличие от среднеактивных,
++ p<0.01 – отличие между высоко- и низкоактивными,
# p<0.05 – эффект даларгина.
Приведены средние значения ± ошибка среднего.
Введение даларгина практически в 2 раза снижает спонтанную пролиферацию лимфоцитов крови НА крыс и не влияет на этот параметр у СА и ВА животных (табл. 10).
Пролиферативный ответ лимфоцитов крови на оптимальную дозу КонА возрастает по мере увеличения исходной двигательной активности исследуемых животных. Оптимальная пролиферация лимфоцитов крови НА крыс в 2 раза ниже, чем у СА крыс, и в 3 раза ниже, чем в группе ВА животных (табл. 10). Введение даларгина оказывает нормализующий эффект на этот параметр: в 2 раза увеличивает его у НА, не влияет на СА и снижает, хотя и в виде тенденции, у ВА крыс. В результате после введения даларгина пролиферация лимфоцитов в присутствии оптимальной дозы КонА во всех группах крыс становится одинаковой (табл. 10). Еще один параметр пролиферативного иммунного ответа – индекс стимуляции лимфоцитов оптимальной дозой митогена – отражает функциональный резерв ответа иммунокомпетентных клеток на митогенный стимул с учетом их исходного состояния. С точки зрения «резервных» способностей лимфоцитов крови, оцениваемых по этому параметру, в наиболее выгодном состоянии находится иммунная система СА крыс: по сравнению с ними индекс стимуляции лимфоцитов у ВА крыс снижен в 1.5 раза, а у НА – в 5 раз (табл. 10). Курсовое введение даларгина в 2 раза повышает индекс стимуляции в группе НА и не влияет достоверно на остальных животных (табл. 10).
Анализ индивидуальных величин концентраций КонА, при которых наблюдается максимальный пролиферативный ответ лимфоцитов крови, показал отсутствие различий по этому параметру между животными выделенных групп (табл. 10). Введение даларгина понизило чувствительность лимфоцитов к митогену у всех животных, но наиболее выражено этот эффект наблюдался у ВА крыс (табл. 10).
Обучение в «челночной камере» является тестом, основанным на выработке условного рефлекса, подкрепляемого аверсивным стимулом, предъявление которого, по определению, сопровождается тревожной реакцией у животного. Анксиолитический эффект даларгина в этом тесте, выражающийся в снижении реактивности на условный сигнал, был обнаружен лишь у ВА крыс. В этой же группе животных под действием даларгина снизилась повышенная в результате стресса реактивность лифоцитов на КонА (табл. 10). Несмотря на отсутствие видимых поведенческих эффектов даларгина на НА крыс в тесте «челночная камера», этот пептид оказал выраженное стимулирующее влияние на иммунную систему НА животных, подавленную в результате хронического анксиогенного воздействия.
Таким образом, анксиолитическое действие селанка и даларгина на животных сопровождается коррекцией стресс-индуцированных соматических нарушений на уровне сердечно-сосудистой и иммунной систем. Селанк снижает тахикардию, индуцированную процедурным стрессом у мышей Balb/c, а курсовое введение даларгина оказывает нормализующий иммуномодулирующий эффект на фоне стресса, вызванного обучением в «челночной камере».
Заключение
Таким образом, собственные и литературные данные свидетельствуют об участии опиоидной системы в регуляции уровня тревожности. Биологические механизмы вариабельности анксиолитических эффектов препаратов, воздействующих на опиоидную систему, связаны с гетерогенностью опиоидных рецепторов, соотношением процессов экспрессии и десенситизации различных их подтипов, синтеза и деградации эндогенных опиоидов. Так, связанный с модуляцией опиоидной системы анксиолитический эффект селанка проявляется в условиях повышенной активности ферментов деградации эндогенных опиоидов. Установлено, что коррекция состояния опиоидной системы с использованием пептидных препаратов может с успехом применяться при терапии некоторых форм тревожных расстройств, сопровождающихся истощением эндогенной опиоидной системы, в частности, ГТР. В заключение можно сказать, что стимуляция опиоидной системы агонистами ОР дельта-типа и ингибиторами ЭДФ сопровождается анксиолитическим эффектом на фоне генетически обусловленной или определяемой внешней средой недостаточности функциональной активности эндогенной опиоидной системы.
Выводы
1. Синтетический аналог энкефалинов даларгин, преимущественно взаимодействующий с опиоидными рецепторами (ОР) дельта-типа, но не ДАГО, лиганд ОР мю-типа, снижает поведенческие проявления тревожности животных в тестах «Открытое поле», «Приподнятый крестообразный лабиринт» (ПКЛ), «Конфликтный тест Вогеля», «Челночная камера» как при центральном, так и при периферическом введении. Анксиолитический эффект даларгина наблюдается на фоне дополнительных стрессорных воздействий, приводящих к повышению уровня тревожности, и зависит от исходного поведенческого статуса животных.
2. Обнаружены отличия в плотности и аффинности центральных ОР к лиганду δ- и μ-ОР ДАДЛЭ, активности эндогенных лигандов ОР в гиппокампе и в плазме крови, скорости деградации лей-энкефалина в плазме крови животных с различными поведенческими проявлениями тревожности.
3. Обнаружена взаимосвязь между активностью энкефалиндеградирующих ферментов (ЭДФ) плазмы крови и конституционально-личностными характеристиками людей. Время полупревращения (τ1/2) лей-энкефалина в плазме крови здоровых людей прямо коррелирует с уровнем личностной тревожности по Спилбергеру и обратно – с уровнем экстравертированности по Айзенку. В условия развития генерализованного тревожного расстройства (ГТР) различия по τ1/2 между пациентами с различным уровнем экстравертированности нивелируются. При этом τ1/2 лей-энкефалина в плазме крови больных ГТР положительно коррелирует с выраженностью ряда симптомов тревожной, астенической и гипотимической групп, а также вегетативных расстройств, присущих этому заболеванию.
4. В плазме крови больных ГТР достоверно снижено как τ1/2, так и максимальная скорость реакции гидролиза лей-энкефалина по сравнению со здоровыми донорами и больными агорафобией и паническим расстройством, что свидетельствует о недостатке эндогенных ингибиторов ЭДФ у больных ГТР.
5. Селанк и его пептидные фрагменты, тафтсин и Pro-Arg-Pro-Gly-Pro, ингибируют активность ЭДФ плазмы крови человека и мембранной фракции мозга крысы in vitro. Наиболее выражено ингибирующее действие селанка на дикарбоксипептидазы, которые, в частности, ангиотензинпревращающий фермент, непосредственно участвуют в его гидролизе.
6. Один из механизмов поведенческих эффектов селанка связан с действием на опиоидную систему: анксиолитическое действие селанка на мышей Balb/с, регистрируемое в тесте ПКЛ, блокируется антагонистом ОР налоксоном. Анксиолитический эффект препарата на мышей Balb/с, с фенотипом повышенной тревожности в тесте «открытое поле» сопровождается снижением скорости распада энкефалинов в их крови. Ведение селанка резистентным к анксиолитическому действию этого препарата мышам C57Black/6 не влияет на активность ЭДФ в их крови.
7. Выраженный клинический эффект селанка наблюдается при ГТР, характеризующемся недостатком эндогенных ингибиторов ЭДФ. В результате терапии селанком, но не медазепамом происходит повышение среднего значения τ 1/2 лей-энкефалина в сыворотке крови больных ГТР.
8. Анксиолитическое действие селанка и даларгина на животных сопровождается коррекцией стресс-индуцированных соматических нарушений на уровне сердечно-сосудистой и иммунной систем. Селанк снижает тахикардию, индуцированную процедурным стрессом у мышей Balb/c. На фоне стресса, вызванного обучением в «челночной камере», курсовое введение даларгина оказывает нормализующий эффект на Т-клеточное звено иммунитета крыс.
9. Стимуляция опиоидной системы агонистами ОР дельта-типа и ингибиторами ЭДФ вызывает анксиолитический эффект на фоне генетически обусловленной или определяемой внешней средой недостаточности функциональной активности эндогенной опиоидной системы. Использование подобных препаратов патогенетически обосновано при терапии и профилактике тревожных расстройств и стресс-индуцированных нарушений сердечно-сосудистой и иммунной систем.