Радиационное загрязнение
Изотопы – это атомы элемента с одним и тем же атомным номером, но с различными атомными массами. Термин «изотоп» предложил Содди в 1918 г. для обозначения двух или более веществ с разной массой, занимающих одно и то же место в периодической таблице. Известно 340 естественных изотопов элементов.
A=Z+N,
N=A–Z,
Z=A–N,
где A – массовое число, Z – порядковый номер элемента в периодической системе, равный заряду ядра, числу протонов и числу орбитальных электронов атома, N – число нейтронов. У легких изотопов A=2Z. Это соотношение выдерживается до кальция-40. По принципу четности нейтронов и протонов все изотопы могут быть разделены на 4 типа:
| Z | N | |
| Четное | Нечетное | |
| Четное | Четно-четные, 166 изотопов, 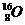
| Четно-нечетные, 55 изотопов, 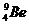
|
| Нечетное | Нечетно-четные, 47 изотопов, 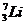
| Нечетно-нечетные, 5 изотопов, 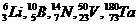
|
Еще Д. И. Менделеев обнаружил аномальность соотношений для трех пар элементов (более тяжелые элементы с меньшими порядковыми номерами, чем более легкие):
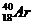 и
и 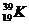 ;
;
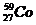 и
и 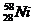 ;
;
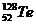 и
и 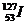 .
.
Эти и другие аномалии были объяснены с открытием радиоактивности. Радиоактивность – самопроизвольный переход ядер нестабильных атомов в более стабильное состояние. В результате изменений в ядрах атомов выделяется издучение:
α-лучи (ионы гелия);
β-лучи (электроны);
γ-лучи (электромагнитные волны).
Удаление α-частицы из ядра смещает атомный номер в периодической таблице на 2 позиции влево. Массовое число элемента при этом уменьшается на 4 единицы.
При β–распаде массовое число не изменяется. При обычном β-распаде нейтрон превращается в протон с выделением электрона, а атомный номер элемента увеличивается на единицу. При электронном захвате протон переходит в нейтрон в результате перемещения электрона их К-оболочки атома в ядро. Атомный номер при этом уменьшается на единицу, β-излучение отсутствует, но выделяются Х-лучи.
γ-лучи испускаются при возвращении ядра из возбужденного состояния в обычное состояние.
Все три вида излучения являются ионизирующими и способны наносить повреждения биологическим объектам (лучевая болезнь, мутации, образование злокачественных опухолей). Наибольшей проникающей способностью обладает γ-излучение.
Содержание стабильных изотопов часто выражают с помощью
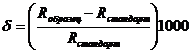 , где R – соотношение стабильных изотопов (13С/12С), (34S/32S), (18O/16O) и т. д.
, где R – соотношение стабильных изотопов (13С/12С), (34S/32S), (18O/16O) и т. д.
Так, например, δ 13С составляет для атмосферы –7‰, а для ископаемого топлива –26‰, δ 34S для ископаемых топлив лежит от 0 до +5‰, а для ДМС +20‰. Это позволяет различать источники поступления различных веществ в окружающую среду.
При радиоактивном распаде с изменением атомного номера первоначальный изотоп называется материнским, новообразованный – дочерним.
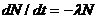 ,
,
где N – число неизмененных атомов, t – время, λ – постоянная распада данного радиоактивного изотопа, которую можно выразить как долю распавшихся атомов на один атом в секунду.
Если интегрировать уравнение распада от t =0 до t и от N 0 до N, где N 0 – число атомов при t =0, потенцируем и получаем:
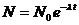 .
.
Часто используется период полураспада – время распада половины первоначального числа атомов. Константа распада λ и период полураспада t ½ связаны между собой
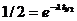 или
или 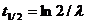 .
.
Если P – число материнских атомов в минерале, а D – число дочерних атомов, то
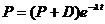 или
или 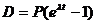 .
.
Отсюда
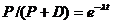 ,
,
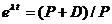 ,
,
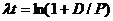 ,
,
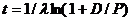 .
.