Образцы выполнения с/р2
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. РАВНОВЕСИЕ. КИНЕТИКА.
ЗАДАЧА 1. Теплота сгорания топлива.
| Объем топлива, л | Состав топливной смеси, % | ||||
| СН4 | С2Н6 | С3Н8 | С4Н10 | С6Н6 | |
| - | - | - |
Имеем газовую топливную смесь: 50%СН4 + 50%С4Н10.
Суммарный объем V=1000 л=1м3.
Напишите химические уравнения реакций горения газовых составляющих заданной топливной смеси.
Реакция горения метана:
СН4 (г) + 2О2 (г) ® СО2 (г) + 2Н2О(ж)
Реакция горения бутана:
С4Н10 (г) + 13/2О2 (г) ® 4СО2 (г) + 5Н2О(ж).
Энтальпия Δ r Н0 298 этих химических реакций является теплотой сгорания газового топлива Δ Н0 сг.
2. Рассчитайте, сколько теплоты можно получить при сжигании заданного объема топливной смеси заданного состава (объемные %), условия считать нормальными.
С использованием закона Гесса рассчитаем теплоту сгорания газового топлива Δ Н0 сг при стандартном состоянии и 298 К, используя табличные данные (см. приложение, табл.) теплоты образования всех веществ, участвующих в реакции горения (Δ f Н0 298):
для метана
Δ Н0 сг СН4 = Δ r Н0 298 = Δ f Н0 СО2 + Δ f Н0 Н2О - Δ f Н0 СН4 - 2Δ f Н0 О2 =
= - 393,62 + 2. (-285,84) – (-74,78) - 0 = -802,28 кДж/моль.
для бутана
Δ Н0 сг С4Н10 = Δ r Н0 298 = 4Δ f Н0 СО2 + 5Δ f Н0 Н2О - Δ f Н0 С4Н10 - 13/2Δ f Н0 О2 =
= 4.(- 393,62) + 5. (-285,84) – (-126,15) - 0 = -2877,53 кДж/моль.
Удельная теплота сгорания QТ газового топлива:
QT = - (Δ Н сг.1000/22,4), кДж/м3,
где 22,4 л/моль – молярный объем газа при н.у.
для метана
QT , СН4= - (-802,28 . 1000 / 22,4) =35816 кДж/м3.
для бутана
QT , С4Н10= - (-2877,53 . 1000 / 22,4) =128461 кДж/м3.
Суммарное количество теплоты, полученное при сгорании данной топливной смеси с учетом объемов газов:
Q = QT , СН4. VСН4 + QT , С4Н10. VС4Н10 =
=35816.(1.0,5)+128461.(1.0,5) =82138,5 кДж.
3. Из заданной топливной смеси выберите наиболее энергоэффективное топливо. Рассчитайте удельную теплоту сгорания этого топлива QT, кДж/м3. Рассчитайте минимальный объем этого топлива для получения 100 МДж теплоты.
Наиболее энергоэффективное топливо в данной топливной смеси – бутан, удельная теплота сгорания QT , С4Н10 = 128461 кДж/м3.
Для получения 100 МДж теплоты необходимо сжечь:
VС4Н10 = Q/ QT , С4Н10 =100000/128461=0,778 м3 = 778 л.
ЗАДАЧА 2. Химическая термодинамика.
| Химическая реакция (п.1) | р газ. 10-5 , Па (п.2) | С исх, моль/л (п.3) | ||||
| А | В | D | М | А | В | |
| СO2 (г) + C(к) «2CО(г) | - | 0,02 | - | 0,5 | - |
Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
Для химической реакции
СO2 (г) + C(к) «2CО(г)
Вещество C(к) – простое, устойчивое при 298 К и давлении 100 кПа, энтальпия его образования D H 0 f, 298, = 0.
Термохимические уравнения реакций, тепловой эффект которых является теплотой образования реагентов заданной химической реакции СO2 (г) и CО(г):
O2 (г) + C(к) «CО2 (г) , D H 0 f, 298 = -393,51 кДж/моль,
(см. табл.);
1/2 O2 (г) + C(к) «CО(г) , D H 0 f, 298 = -110,5 кДж/моль,
(см. табл.).
2. Рассчитайте величины энтальпии D r H 0298 , энтропии D r S 0298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Сделайте вывод о тепловом эффекте реакции.
По табличным данным (см. табл.) запишем термодинамические функции состояния реагентов заданной химической реакции при стандартном состоянии и 298 К
| вещество | D H 0 f, 298, кДж/моль | D G 0 f, 298, кДж/моль | S 0 f, 298, Дж/моль.К | ср, Дж/моль.К | Температурный интервал, К |
| С(графит) | 5,74 | 8,54 | 298-2300 | ||
| СО2 (г) | -393,51 | -394,38 | 213,68 | 37,41 | 298-2500 |
| СО (г) | -110,5 | -137,14 | 197,54 | 29,14 | 298-2500 |
С использованием закона Гесса рассчитаем энтальпию Δ rН0 298, энтропию ∆rS0 298 и энергию Гиббса Δ r G0 298 химической реакции при стандартном состоянии и 298 К:
Δ r Н0 298 = 2 Δf Н0 298 СОг - Δf Н0 298 Ск - Δ f Н0 298 СО2г =
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
Δ r Н0 298 >0 - реакция эндотермическая, идет с поглощением теплоты.
∆rS0 298 = 2 S0f, 298,СО(г) - S 0 f, 298,С(к) - S 0 f, 298,СО2(г) = 2(197,54) – 5,74 – 213,68 =
= 175,66 Дж/К.
∆rS0 298>0 – система стала более неупорядоченной вследствие образования дополнительного количества газа.
3. Рассчитайте величину энергии Гиббса D rG0 298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Определите, в каком направлении будет самопроизвольно протекать данная реакция при стандартном состоянии всех реагентов и температуре 298 К.
Δ r G0 298 = 2 Δf G0 298 СОг - Δf G0 298 Ск - Δ f G0 298 СО2г =
= 2(-137,14) – 0 – (-394,38) = 120,15 кДж.
Δ rG0 298 >0 – самопроизвольное протекание реакции в прямом направлении при стандартном состоянии и 298 К невозможно. Реакция протекает в обратном направлении.
4. Определите область температур, при которых возможно самопроизвольное протекание прямой реакции при стандартном состоянии всех реагентов без учета зависимости D r H 0 и D r S 0 от температуры. Постройте график зависимости энергии Гиббса реакции от температуры D rG 0 = f (Т).
Возможность самопроизвольного протекания реакции при стандартном состоянии определяется неравенством ∆r G0T < 0.
Т.е., если
∆r G0T = ∆ r H 0298 + 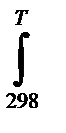 ∆ r с0pdT - Т ∆ r S0 298 - Т
∆ r с0pdT - Т ∆ r S0 298 - Т 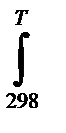 ∆ r с0p/T) dT < 0
∆ r с0p/T) dT < 0
Если считать, что ∆rH0 и ∆rS0 не зависят от температуры:
∆r G0T ≈ ∆ r H 0298 - Т ∆ r S0 298 < 0
∆ r G0Т = (172,5 – Т .175,66.10-3) < 0, отсюда Т > 982 К.
График зависимости D rG 0 = f (Т):
∆ rG0Т
298 982 2300 Т
С учетом температурных интервалов существования реагентов температурная область самопроизвольного протекания реакции при стандартном состоянии 982 < Т < 2300 К.
5. Рассчитайте величину энергии Гиббса D rG 298 химической реакции при заданных значениях парциальных давлений газов (п.2. табл. к задачам 1, 2) и температуре 298 К. Определите, изменится ли направление протекания процесса при 298 К при изменении парциальных давлений газов по сравнению со стандартным состоянием.
Расчет энергии Гиббса химической реакции при любой температуре и любых относительных парциальных давлениях газов производится по уравнению изотермы Вант-Гоффа:
Δ rGТ = ∆rG0Т + RT ln  .
.
Рассчитаем Δ r G 298 при 298 К и давлениях газов: р СО = 2.103 Па,
р СО2 = 8.105 Па.
Относительные парциальные давления газов:
 СО= 2.103 Па/105 Па = 0,02;
СО= 2.103 Па/105 Па = 0,02; 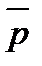 СО2 = 8.105 Па/105 Па = 8.
СО2 = 8.105 Па/105 Па = 8.
Δ r G 298 = Δ r G0 298 + RTln (р 2СО/ р СО2) = 120,15 +8,31.10-3. 298. ln (0,02/8) =
=105,3 кДж.
Δ rG 298 >0 – самопроизвольное протекание реакции в прямом направлении при заданных парциальных давлениях газов и 298 К невозможно. Реакция протекает в обратном направлении.
6. Определите, как нужно (теоретически) изменить парциальное давление любого из исходных газов (р А или р В) для изменения направления протекания процесса по сравнению со стандартным состоянием при 298 К и стандартном парциальном давлении всех других компонентов химической реакции.
При стандартном состоянии и 298 К возможно самопроизвольное протекание реакции в обратном направлении, т.к. Δ rG0 298 >0.
Для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К можно изменить парциальное давление СО2 , (состояние всех других компонентов стандартное). Условием самопроизвольного протекания реакции в прямом направлении является Δ rG 298 < 0.
По уравнению изотермы Вант-Гоффа:
Δ rGТ = ∆rG0Т + RT ln  < 0
< 0
Δ r G 298 = 120,15 + 8,31.10-3.298 ln  < 0
< 0
Решаем неравенство ln  < - 48,5и получаем:
< - 48,5и получаем:  < 10-21 .
< 10-21 .
Таким образом, р СО < р СО2 ≈ в 105 раз.
Таким образом, для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К и давлении р СО = 105 Па нужно увеличить парциальное давление СО2 в 105 раз, т.е. парциальное давление СО2 должно быть: р СО2 > 1025 Па.
При таком давлении СО2 заданная химическая реакция может самопроизвольно протекать в прямом направлении при 298 К.