Способы приготовления растворов.
Растворы с известной концентрацией, которые служат для определения концентрации других растворов, называются стандартными или рабочими. Это некоторые растворы кислот, щелочей, солей.
1. Метод точной навески. Предполагает работу с растворами, которые не меняют свою молекулярную массу и объем при взаимодействии с воздухом.
На аналитических (погрешность таких весов составляет 0,0002г) весах точно взвешивают вещество и переносят в мерную колбу для растворения, доводят до метки растворителем (водой) и тщательно перемешивают.
Растворы точной навески можно приготовить лишь для немногих веществ. Эти вещества должны отвечать следующим требованиям:
- вещество должно быть чистым (без примесей)
- иметь постоянный состав (соответствовать определённой химической формуле)
- быть устойчивым как на воздухе, так и в растворе
- иметь достаточно высокую молекулярную массу.
Такие соединения называются установочными. К ним относятся: щавелевая кислота (Н2С2О4 · 2Н2О), тетраборат натрия (бура) (Na2B4O7·10H2O), дихромат калия (K2Cr2O7). Для веществ, неудовлетворяющих требованиям, растворы готовят методом неточной навески или разбавлением.
2. Метод неточной или приблизительной навески. Предполагает работу с растворами, которые не соответствуют этим требованиям, например, меняют свою массу на воздухе, например, перманганат калия. Перед применением их в качестве стандартных растворов, необходимо оттитровать другим раствором с точно известной концентрацией.
3. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного.
4. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал - ампула с сухим веществом или раствором с точно известным количеством эквивалентов. концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным.
Посуда, применяемая в объемном анализе.
В объемном анализе применяется специальная мерная посуда: бюретки, пипетки и мерные колбы.
Бюретки. Это градуированные стеклянные трубки, приспособленные для отмеривания растворов небольшими порциями или отдельными каплями. Бюретка укрепляется вертикально в штативе, и отсчет делений ведется сверху вниз. Нижняя часть бюретки сужена и соединяется короткой резиновой трубкой с тонким стеклянным носиком. Бюретки изготавливаются объемом от 1 до 50мл. Раствор заливают в бюретку через воронку.
Пипетки. Это специальные стеклянные трубки, предназначенные для отмеривания и переноса заданного объема раствора из одного сосуда в другой. При выливании раствора из пипетки, наполненной до метки, объем раствора в точности соответствует маркировке. Наполнение пипетки производят всасыванием раствора резиновой грушей, плотно приставленной к верхнему концу пипетки. Пипетки изготавливаются различных объемов: от 0,1 до 10мл.
Мерные колбы. Это колбы с длинным узким горлышком, на котором наносится кольцевая метка. На колбе указывается объем, который реализуется при наполнении колбы до метки. Объем мерной колбы составляет 25, 50, 100, 200, 250, 500, 1000 или 2000мл.
Мерные цилиндры. В объемном анализе они используются для приблизительного измерения объемов некоторых вспомогательных растворов или воды и имеют второстепенное значение при необходимости измерения объемов меньшей точности.
Примеры решения задач на приготовление растворов с массовой концентрацией.
Задача 1. Приготовить 500 г раствора С6Н12О6 с массовой долей равной 10%?
Дано: Решение:
m (р-ра С6Н12О6) = 500 г 
ωС6Н12О6 = 10% 1. Определяем массу С6Н12О6 согласно
__________________ формуле: m (в-ва) = 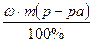
Найти: m (С6Н12О6) =? m (С6Н12О6) = 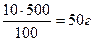
m (H2O) =?
2. Определяем массу воды согласно формуле:
m (р-ра) = m (р-ля) + m (вещ-ва), m (Н2О) = m (р-ра) – m (в-ва),
m (H2O) = 500 – 50 = 450 г.
Согласно формуле:  , где ρ – плотность раствора, m – масса раствора, V – объём раствора. Определяем V (H2O) =
, где ρ – плотность раствора, m – масса раствора, V – объём раствора. Определяем V (H2O) = 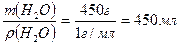 .
.
Ответ: чтобы приготовить 500 г раствора глюкозы с массовой долей 10%, необходимо отвесить на весах 50 г глюкозы, отмерить цилиндром 450 мл воды, поместить этот раствор в колбу и перемешать. Этот раствор приготовлен методом навески.
Задача 2. Приготовить 800 мл раствора NaCl с массовой долей равной 12% и плотностью равной 1,1 г/мл?
Дано: Решение:
V (р-ра) = 800 мл 
ω NaCl = 12 %
ρ = 1,1 г/мл 1. Определяем массу р-ра NaCl согласно
__________________ формуле: m (р-ра)= V ∙ ρ = 800 мл · 1,1г/мл = 880 г
Найти: m (NaCl) =?
m (H2O) =?
2. Определяем массу NaCl согласно формуле: m (в-ва) = 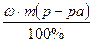
m (NaCl) = 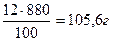
3. Определяем массу воды согласно формуле:
m (Н2О) = m (р-ра) – m (в-ва),), m (Н2О) = 880 – 105,6 = 774,4 г или 774,4 мл, т.к. плотность воды равна 1 г/мл.
Ответ: для приготовления 800 мл раствора хлорида натрия с массовой долей равной 12 %, необходимо отвесить на весах 105,6 г NaCl, отмерить мерным цилиндром 774,4 мл воды, поместить раствор в колбу и перемешать. Этот раствор приготовлен методом навески.
Задача 3 Приготовить 100 г ра-ра MgSO4 c ω = 2 % из р-ра MgSO4 c ω = 10 %?
Дано: Решение:
ω1(MgSO4) = 10 % 
m2 (MgSO4) р-ра = 100 г
ρ = 1,1 г/мл 1. Определяем массу чистого MgSO4
__________________ содержащегося в 100 г 2 % р-ра MgSO4
Найти: m 1 (MgSO4) =? m (в-ва) = 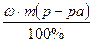 ,
,
m (H2O) =? m (MgSO4) = 
2. Определяем массу р-ра MgSO4 (исходного) с ω = 10 % содержащего 2 г чистого MgSO4 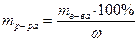 , m1(MgSO4) =
, m1(MgSO4) = 
3. Определяем объём исходного (первого) р-ра MgSO4 с ω = 10 %
Vр-ра =  , Vр-ра (MgSO4) =
, Vр-ра (MgSO4) = 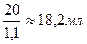
4. Определяем массу Н2О, которая необходима для разбавления исходного раствора MgSO4.
m (H2O) = 100 – 20 = 80 г или для чистой воды 80 мл.
Ответ: для приготовления 100 г раствора MgSO4 с массовой долей равной 2 % из раствора MgSO4 с массовой долей 10 % и ρ = 1,1 г/мл, необходимо отмерить из бюретки или пипетки 18,2 мл 10 % р-ра MgSO4, поместить их в колбу, добавить туда цилиндром 80 мл воды и перемешать. Этот раствор приготовлен методом разбавления.
Упражнения и ситуационные задачи.
1. В медицинской практике используются растворы с точной концентрацией, поэтому для приготовления растворов с нормальной концентрацией необходимо рассчитывать эквивалентные массы кислот, оснований и солей. Рассчитайте MЭ Н3РО4 в реакциях с КОН; МЭ АI(ОН)3 в реакциях с НNО3; МЭ солей Fе(SО4)3, NаНСО3, Fе(ОН)2СI, КАI(SО4)2 · 12Н2О.
2. При коньюктивитах применяют в виде глазных капель раствор сульфата цинка. Рассчитайте сколько грамм сульфата цинка и воды необходимо для приготовления 25 мл 0,25% раствора (ρ = 1,02 г/мл)?
3. При обезвоживании организма внутривенно вводится 5% раствор глюкозы. Рассчитайте как приготовить 400 г 5 % раствора глюкозы из раствора с массовой долей 15 %?
4. Для обтирания и компрессов применяют этиловый спирт. Как приготовить 300 мл 40 % раствора спирта из 96 %? (ρ = 0,8 г/мл).
5. Для местной анестезии применяется 2% раствор новокаина Как приготовить 600 г 2 % раствора новокаина из раствора с массовой долей 10 %?
6. Для промывания при уретритах и вагинитах как антисептическое средство применяется 0,25 % раствор медного купороса. Рассчитайте сколько грамм CuSO4 · H2O и воды потребуется для приготовления 200 г 0,25 % раствора CuSO4, рассчитанного на безводную соль.
7. При кожной практике для обработки эрозий, трещин, избыточных грануляциях используют 0,05% раствор AgNO3 Какую массу AgNO3 надо растворить в 250 г Н2О для получения 0,05 % раствора?