Больцман доказал, что не только в поле тяготения, но и в любом потенциальном поле концентрация любых одинаковых частиц, находящихся в состоянии хаотического теплового движения, убывает с ростом их потенциальной энергии Eп по экспоненциальному закону n=n(нулевое)*exp(-Eп/kT) где n(нулевое)-концентрация частиц на нулевом уровне (там где Eп = 0).Этот закон,который даёт распределение молекул по значениям потенциальной энергии, называется Распределение Больцмана. Ещё раз заментим что распределение Больцмана справедливо не только для молекул но и для любых одинаковых частиц находящихся в состоянии хаотического теплового движения.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии: 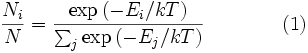 где
где  является числом молекул имеющих энергию
является числом молекул имеющих энергию  при температуре системы
при температуре системы  ,
,  является общим числом молекул в системе и
является общим числом молекул в системе и  , — постоянная Больцмана.
, — постоянная Больцмана.
36. Уравнение состояния идеального газа. Газовые законы.
уравнение состояния идеального газа – pV=(m/M)RT – ур. Менделеева-Клапейрона, где R- универсальная газовая постоянная. Физический смысл Rпоказывает на сколько изменяется внутренняя энергия одного моля иг при изменении температуры на 1 К.
изотермический процесс – закон Бойля-Мариотта – T=const, а Vи pизменяются
Изобарный процесс – закон Гей-Люссака– p=const, аV иT изменяются
изохорный процесс - закон Шарля – v=const, а pиT изменяются
37. Термодинамический метод описания системы многих тел. Основные понятия термодинамики.
Для изучения тепловых процессов в естествознании сформировался термодинамический метод исследования. Он заключается в том, что термодинам. сис-ма рассматривается как один целостный объект(а не как множество ее элементов, молекул) и ее состояние системы задается термодинамическими параметрами (параметрами системы), характеризующими ее свойства. в качестве таковых выбирают абсолютную температуру(температура по шкале кельвина – T), давление (Р), молярный объем (Vm объем одного моля вещества). Параметры связаны друг с другом, поэтому состояние системы можно представить в виде уравнения. Например, для идеального газа массой в один моль эту связь выражает уравнение Менделеева – Клапейрона.
38. Внутренняя энергия термодинамической системы, ее выражение для идеального газа. Количество теплоты и работы совершаемой газом.
внутренняя энергия идеального газа –в результате тепловых процессов изменяется внутренняя энергия термодинамической системы. Внутреннюю энергию тела составляет кинетическая энергия движения молекул и потенциальная энергия их взаимодействия. Все тела обладают внутренней энергией. U=i/2*m/M*RT – Внутренняя энергия газа, где I– число степеней свободы (I =3(одноатомный газ)=5(двухатомный газ)=6(трехатомный газ))
способы изменения внутренней энергии – 1) теплопередача (а) теплопроводность – передача тепла от более нагретых участков тела, менее нагретым; б) конвекция – передача тепла нагретыми потоками жидкости или газа; в) излучение)
2) Совершение работы (телом или над телом).
| Нагревание/охлаждение | Q=cm(t2-t1) |
| Плавление/кристаллизация | Q= 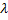 m m
|
| Испарение/конденсация | Q=Lm |
| Сгорание топлива | Q=qm |
работа газа в изопроцессах – а)Изохорный-V=const, ∆V=0, A=0б) Изобарный – p=const, A=p∆V
в) Изотермический T=const, A=V(ню)RT*lnv2/v1г) адиабатный A=-∆U.
Работа, совершаемая в процессе численно рана площади фигуры лежащей под графиком процесса в координатах PV
39. Изобарный, изохорный, изотермический и адиабатический процессы для идеального газа. Теплоемкость и работа процессов.
Изобарный: p=const. Q=U+A. Изохорный: v=const. Q=U. Изотермический: T=const. Q=A.
Адиабатический: Q= const. A=-U
Теплоёмкость системы наз. величина, равная кол.теплоты, которое необходимо сообщить системе, для того, чтобы повысить её температуру на 10.
Молярная теплоёмкость численно равна кол теплоты, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на 10.
Удельная теплоемкость численно равна кол теплоты, которое необходимо передать системе массой 1 кг, чтобы повысить его температуру на 10.
Работа - это кол мера изменения энергии термодинамической системы при её переходе из одного состояния в другое.
работа газа в изопроцессах – а)Изохорный-V=const, ∆V=0, A=0б) Изобарный – p=const, A=p∆V
в) Изотермический T=const, A=V(ню)RT*lnv2/v1г) адиабатный A=-∆U.
Работа совершаемая в процессе численно рана площади фигуры лежащей под графиком процесса в координатах PV
40. Обратимый и необратимый тепловые процессы. Первое начало термодинамики.
Обратимым называется процесс, для которого возможен обратный переход из конечного состояние в начальное через одни и те же промежуточные состояния, а вне системы после совершения обратного перехода не происходит никаких изменений.Процесс не удовлетворяющий этим условиям, наз. необратимым. Очевидно, что неравновесный процесс всегда необратим. Первое начало термодинамики представляет собой закон сохр. энергии применительно к теплоте, работе и внутр. энергии.Q=∆U+A: Теплота сообщаемая системе расходуется на изменение ее внутренней энергии и на совершение системой работы против внешних сил.
41. Тепловые двигатели. Цикл Карно. Максимальный КПД тепловой машины. Второе начало термодинамики.
Тепловые двигатели. Устройство, совершающее работу за счет получаемой извне теплоты, называется тепловым двигателем.
Цикл Карно. Цикл Карно состоит из двух изотермических и двух адиабатических процессов.
Максимальный КПД: 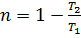 Нагреватель Т1, холодильник T2.
Нагреватель Т1, холодильник T2.
Второе начало термодинамики. Второе начало термодинамики указывает на направление самопроизвольного термодинамического процесса в замкнутой системе.
Формулировка Клаузиуса: невозможен процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
Формулировка Кельвина – Планка: невозможен циклический процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
42. Энтропия. Физический смысл энтропии. Расчет изменения энтропии для изопроцессов.
Энтропия – одно из функций состояния в термодинамике. 
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему.При изохорном процессе: 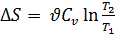 . При изотермическом процессе:
. При изотермическом процессе: 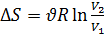 .При адиабатном процессе:
.При адиабатном процессе: