Тема 1.4. Типы химической связи: ионная, ковалентная, металлическая, водородная
Цель занятия:
· Методическая:
- усовершенствоватьметодику актуализации опорных знаний
· Дидактическая:
- систематизировать и расширить знания о химической связи в различных соединениях;
- ознакомить с механизмом образования химических связей в соединениях;
- сформировать понятия о различии между ковалентной неполярной и ионной связями;
- совершенствовать умения анализировать, делать выводы.
· Воспитательная:
- достичь понимания важности изучения дисциплины;
- развивать аккуратность, внимательность, настойчивость при выполнении заданий;
- прививать интерес к предмету.
Вид занятия: комбинированное занятие.
Тип занятия: приобретение новых знаний.
Ход занятия
Организационный момент
- проверка присутствия студентов;
- записи в журнале;
- проверка подготовки к занятию студентов.
Сообщение темы, цели и основных задач занятия.
Мотивация к изучению материала
Из школьного курса химии вам известно, что атомы могут соединяться друг с другом с образованием простых и сложных веществ. При этом между атомами возникают различного рода химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Все виды связи имеют общую природу – это предоставление собственных электронов, которое дополняется электростатическим взаимодействием между разноименными зарядами, возникающими при переходах электронов.
Актуализация опорных знаний
1) Какие типы химической связи вы знаете?
2) Чем определяется валентность элемента?
3) В каких веществах существует металлическая связь?
4) Что называется ковалентной связью?
5) Что такое электроотрицательность?
Изучение нового материала
Химической связью называют различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллов и других веществ.
Причиной образования химической связи является стремление системы к более устойчивому состоянию с минимально возможным запасом энергии.
Основное условие образования химической связи – понижение полной энергии системы по сравнению с суммарной энергией изолированных атомов.
Образование такой системы может идти несколькими способами и приводит к образованию соединений с различными видами химической связи: ковалентной, ионной, металлической и водородной.
Важнейшей характеристикой атома при образовании химической связи является его электроотрицательность (ЭО) – способность притягивать электроны.
Определение типа связи:
- если атомы неметаллов обладают одинаковой ЭО, возникает ковалентная неполярная связь;
- если атомы обладают разной ЭО, возникает ковалентная полярная связь;
- если атомы обладают разной ЭО, но не резко отличаются, разность в ЭО<1.7, то возникает ковалентная полярная связь;
- если атомы обладают разной ЭО, резко отличаются, разность в ЭО>1.7, то возникает ионная связь.
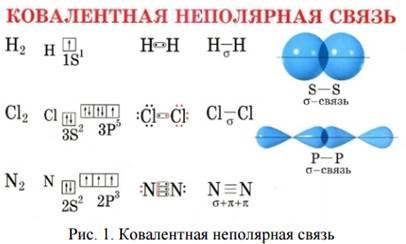
Ковалентная связь
Связь посредством общих электронных пар называется ковалентной. Она возникает в случае разности в ЭО меньше 1.7 и приближающейся к нулю. Если атомы неметаллов обладают одинаковой ЭО, возникает ковалентная неполярная связь, если атомы неметаллов обладают разной ЭО и эта разность в ЭО<1.7, то возникает ковалентная полярная связь. Ковалентной полярной будет также связь между атомами нетипичных металлов и неметаллов в случае небольшой разницы в значении их ЭО, например, AlBr3, GeH4 и др.
Существуют два механизма образования ковалентной связи: обменный и донорно-акцепторный.
1) Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов
Пример 1: образование молекулы водорода Н2
атом водорода Н1; +1;1s1, ⍐, на внешнем энергетическом уровне 1s-неспаренный электрон, Н•
Химическая связь возникает благодаря образованию общей электронной пары s-электронами атома водорода (перекрыванию s- облаков).
Н•+•Н—›Н∶Н или Н-Н, или Н2
Пример 2: образование молекулы фтора Cl2
атом хлора Cl17;+17; 1s22s22p63s23p5, на внешнем энергетическом уровне 1р-неспаренный электрон, CI•
Cl•+•Cl—›Cl∶Cl или Cl-Cl, или Cl2.
Химическая связь возникает благодаря образованию общей электронной пары p-электронами атома водорода (перекрыванию p-облаков).
Пример 3: образование молекулы азота N2
атом азота N7; +7; 1s22s22p3, на внешнем энергетическом уровне 3р-неспаренных электрона.
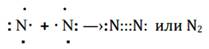
Связь, осуществленная за счет образования общих электронных пар, в одинаковой мере принадлежащим обоим атомам, называется ковалентной неполярной.
Разновидности ковалентной связи:
· неполярная ковалентная связь возникает между атомами, обладающими одинаковой ЭО. Например, О2, О3, CI2, Н2, N2, F2, CI2, Br2, I2, At2.
· ковалентная полярная связь возникает между атомами, которые различаются не резко в ЭО, разность в ЭО<1.7
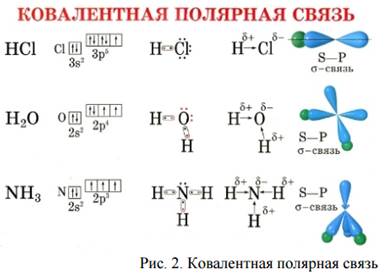
Пример 4: образование молекулы хлороводорода НCl
атом водорода Н1;+1;1s1, на внешнем энергетическом уровне 1s-неспаренный электрон, Н•
атом хлора Cl17;+17; 1s22s22p63s23p5, на внешнем энергетическом уровне 1р- неспаренный электрон, Cl•
Н•+•Сl—›H ∶Cl или Н-Cl, или НCl.
Химическая связь возникает благодаря образованию общей электронной пары из s- и р- электронов (перекрыванию s- и р-облаков).
Пример 5: образование молекулы воды Н2О
атом водорода Н1;+1;1s1, на внешнем энергетическом уровне 1s-неспаренный электрон, Н•
атом кислорода О8; +8; 1s22s22p4, на внешнем энергетическом уровне 2р-неспаренных электрона
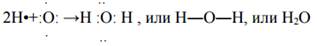
Пример 6: образование молекулы аммиака NH3
атом водорода Н1; +1;1s1, ⍐, на внешнем энергетическом уровне 1s- неспаренный электрон, Н•
атом азота N7; +7; 1s22s22p3, на внешнем энергетическом уровне 3р-неспаренных электрона
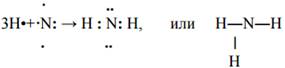
2) Донорно-акцепторный механизм – это механизм образования химической связи за счет неподеленной электронной пары одного атома и свободной орбитали другого атома.
Атом, обдающий электроны для образования химической связи, называется донором. Атом, предоставляющий орбиталь для образования химической связи, называется акцептором.
По способу перекрывания электронных облаков различают σ- и π- ковалентные связи.
σ-связь (сигма-связь)- это связь, образующаяся при перекрывании электронных облаков вдоль прямой, соединяющей центры атомов, например, s-s (H2), s-p (HCI), p-p(CI2).
π -связь (пи-связь) – это связь, образующаяся при перекрывании электронных облаков в плоскости, перпендикулярной прямой, соединяющей центры атомов, например, p-p, d-p, d-d.
π –связь менее прочная, чем σ-связь; π –связь образуется между атомами, которые уже связаны σ-связью.
Следует отличать полярность связи и полярность молекулы. Полярность связи зависит от значений электроотрицательности связанных атомов. Полярность молекулы зависит: от значений электроотрицательности связанных атомов и от геометрии молекулы. Например, в молекуле углекислого газа СО2 связи будут полярными, а молекула не будет полярной, так как имеет линейное строение О=С=О. Молекула воды полярная, так как образована с помощью двух ковалентных полярных связей Н-О-H и имеет угловую форму.
Основные характеристики ковалентной связи:
· энергия связи – это энергия, которую необходимо затратить на разрыв связи.
· длина связи – это расстояние между ядрами связанных атомов.
· насыщаемость – это способность атомов образовывать ограниченное число химических связей (например, атом водорода образует одну связь, атом углерода – четыре связи).
· направленность - это расположение связей в молекуле под определенными углами относительно друг друга, обуславливает пространственную структуру молекулы, то есть геометрию или форму.
· полярность – неравномерное распределение между атомами электронной плотности, образованной общими электронными парами.
· поляризуемость – это способность молекул (и связей в них) изменять свою полярность под действием внешнего электрического поля.
Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов. Кристаллическая решетка – трехмерный план расположения частиц в пространстве, получаемый путем соединения частиц.
Атомная кристаллическая решетка – очень прочная, например, алмаз, графит, кварц и др. - вещества твердые, тугоплавкие, нерастворимые в воде, диэлектрики или полупроводники. Атомная кристаллическая решетка – в узлах решетки находятся отдельные атомы.
Молекулярная кристаллическая решетка – в обычных условиях это газы, легколетучие жидкости и твердые, но легкоплавкие или возгоняющиеся вещества, например, хлор, вода, йод, сухой лед СО2. Молекулярная кристаллическая решетка – в узлах решетки находятся молекулы.
Ионная связь
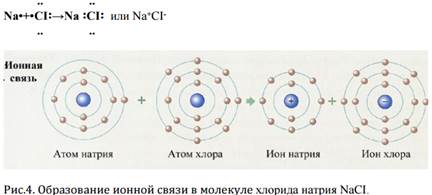
Ионная связь – это связь, осуществляемая за счет электростатического взаимодействия противоположно заряженных ионов.
Процесс образования ионной связи сводится к переходу электронов от атома типичного металла (элементы I и IIА групп) к атомам типичного неметалла (элементы VII A группы, O и N).
Пример: образование хлорида натрия NaCI
При взаимодействии натрия с хлором: 2Na+Cl2=2NaCl
в результате окислительно-восстановительной реакции образуются ионы: катионы натрия и анионы хлора.
Na 1s22s22p63s1→Na-1e=Na+ 1s22s22p6
Cl 1s22s22p63s23p5→Cl+1e=Cl- 1s22s22p63s23p6
Основные характеристики ионной связи в отличие от ковалентной:
· ненаправленность - каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению.
· ненасыщаемость – взаимодействие ионов противоположного знака не приводит к компенсации силовых и у них сохраняется способность притягивать ионы противоположного знака.
Вещества с ионной связью характеризуются ионной кристаллической решеткой, в узлах которой находятся ионы. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений - электролиты.
За счет ионной связи образованы: оксиды и галогениды металлов I и IIА групп – Na2O, BaO, NaF; щелочи – NaOH, KOH; соли кислородсодержащих кислот – Na2SO4, Ca(NO3)2, CuSO4.
Металлическая связь
Металлическая связь – это связь в металлах и расплавах между катионами металлов, расположенными в узлах кристаллической решетки, которую осуществляют обобществленные валентные электроны («электронный газ»).
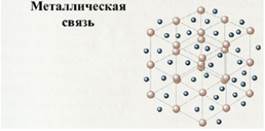
Такая химическая связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов.
Схема образования металлической связи (М- металл): М0 – ne ↔ Mn+. Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость (кроме ртути), электро- и теплопроводность, ковкость, пластичность, металлический блеск. Все вещества с металлической связью имеют металлическую кристаллическую решетку, в узлах которой находятся ионы и атомы металлов, между которыми движутся делокализованные электроны.
Металлическая связь существует в простых веществах металлах (в твердом или расплавленном состоянии), сплавах, интерметаллидах (Na3Pb7, KNa2).
Единая природа химических связей
Деление химических связей на типы носит условный характер. Причиной единства всех типов и видов химических связей служит их одинаковая физическая природа – электронно-ядерное взаимодействие.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи. Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
Различные типы химических связей могут содержаться в одних и тех же веществах, например,
· в основаниях – между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой – ионная;
· в солях кислородсодержащих кислот – между атомами неметалла и кислородом в кислотном остатке – ковалентная полярная, а между металлом и кислотным остатком – ионная;
· в солях аммония, метиламмония - между атомами азота и водорода – ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком – ионная;
Различные типы химических связей могут переходить одна в другую:
-при электролитической диссоциации в воде ковалентная полярная связь переходит в ионную;
-при испарении металлов металлическая связь переходит в ковалентную неполярную.