Гипохлорит - каталитический продукт и эффектор биоцидного действия миелопероксидазы. Благодаря способности геминовых пероксидаз атаковать наиболее устойчивые к окислению структуры, создаются условия не только для непосредственного воздействия этих ферментов на субстраты, но и для использования продуктов окисления субстратов в качестве эффекторов-окислителей. Такие продукты обладают выраженными электроноакцепторными свойствами. Это обстоятельство и было использовано для создания в результате эволюции наиболее мощных факторов антимикробной защиты - ряда пероксидаз, выполняющих микробицидную функцию в организме: МПО, лактопероксидаза и эозинофильная пероксидаза.
В качестве кофакторов биоцидного действия этих ферментов выступают, главным образом, ионы галогенов (J-, Br-) и псевдогалоид - тиоцианат (SCN-). Однако среди указанных ферментов только МПО способна окислять Cl- и использовать продукт его окисления, OCl-, для поражения мишени (OCl- является основным эффекторным фактором биоцидного действия МПО). Для эффективной продукции гипохлорита миелопероксидазой NADPH-оксидаза выступает не только в качестве поставщика предшественника перекиси водорода - О2-·, но и как фактор, потенциирующий биоцидную функцию МПО. Образующееся в ходе функционирования МПО Соединение II не способно катализировать продукцию гипохлорита. Накапливаясь и выступая в этом процессе "инертной" редокс-формой МПО, Соединение II тормозит образование ОCl-. Однако, регенерация исходной ферри-формы фермента из Соединения II под воздействием О2-· как субстрата-восстановителя (первичного продукта катализа NADPH-оксидазой) возобновляет каталитический процесс продукции гипохлорита.
Аналогично супероксидному радикалу, регенерировать исходную ферриформу фермента из Соединения II способен и аскорбат, то есть в данном случае проявляется прооксидантная роль этого классического антиоксиданта.
Количество образуемого OCl- под действием МПО очень велико: на его долю приходится около 30% от потребляемого нейтрофилом кислорода и до 35% от генерируемой лейкоцитом Н2О2. Именно это обстоятельство и послужило основанием для отнесения гипохлорита в состав активных метаболитов кислорода (как одного из важнейших биоцидных продуктов кислород-зависимой антимикробной системы нейтрофильных лейкоцитов).
При физиологических рН соотношение концентраций OCl- и HOCl приблизительно одинаково (рКа=7.53). В условиях закисления среды в фаголизосоме клетки или в очаге воспаления (рН<6.0) вклад протонированной и более активной формы гипохлорита возрастает.
Из-за высокой химической активности гипохлорит способен окислять широкий круг веществ различной химической природы. В результате деструкции таких молекул образуются вторичные токсические соединения. Наиболее подробно в этом плане исследованы продукты окисления первичных и вторичных аминов как элементов важнейших биологических структур (белков, нуклеиновых кислот, коферментов и т.п.). В результате действия гипохлорита наблюдается не только деструкция жизненно важных субстанций, но и преобразование их в хлорирующие агенты (хлорамины и хлорамиды):
HOCl + RNH2 ® H2O + RNHCl
2RNHCl ® RNH2 + RNCl2
HOCl + RNHCl ® H2O + RNCl2
RNHCl + Cl- + H+ ® RNH2 + Cl2
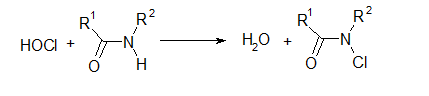
Эмпирически было установлено, что эффективность хлорирования аминов миелопероксидазой (следовательно, и продукция гипохлорита) определяется следующей зависимостью между рН реакционной среды и концентрациями субстратов МПО:
рН = 560·lg[Cl-]/[H2O2]
Используя это выражение легко показать, что рН-оптимум реакции хлорирования имеет место в интервале рН 4.0-7.4, то есть в области функционирования этого фермента, что, по-видимому, является особенностью организации МПО как биоцидного фактора лейкоцитов.
При взаимодействии HOCl со свободными аминокислотами (суммарная их концентрация в плазме крови достигает 4мМ), наряду с моно- и дихлораминами (хлорирующие агенты), образуются и такие токсические вещества как альдегиды:
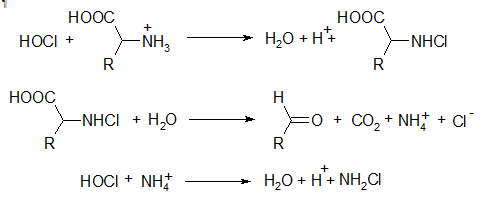
Хлорирование гипохлоритом аминокислот практически не зависит от типа аминокислоты (значения соответствующих констант скоростей близки и составляют около 107М-1с-1). Образующийся в ходе этих превращений простейший монохлорамин (NH2Cl) является даже более токсичным агентом, чем сам OCl-. Что касается альдегидов, то наиболее реакционноспособные среди них - это производные серина, треонина (α-гидрокси- и α,β-ненасыщенные альдегиды), а также тирозина (п-гидроксифенилацетальдегид):
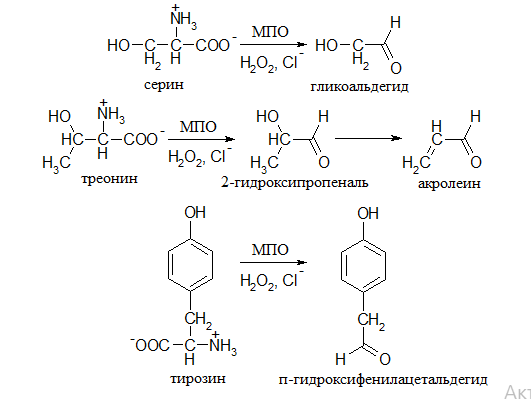
В случае тирозина, наряду с продуктом п-гидроксифенилацетальдегидом, образуется и 3-хлортирозин. Причиной этого является реакция (1), которая ведет к образованию сильнейшего окислителя и хлорирующего агента - Cl2 (хотя в стандартных условиях ее равновесие и сдвинуто в сторону гидролиза молекулярного хлора):
k1
HOCl + Cl- + H+ «H2O + Cl2 k1 =1.8×104 M-1c-1, (1)
k-1 k-1 =3.28×107 M-1c-1
Важно отметить, что тирозин способен и непосредственно выступать в качестве субстрата-восстановителя миелопероксидазной реакции, продуктом которой являются высоко активные тирозил-радикалы:
СоединениеI + Tyr ® СоединениеII + Tyr· k =7.7×105 M-1c-1 (2)
СоединениеII + Tyr ® МПО + Tyr· k =1.57×104 M-1c-1 (3)
Tyr· + Tyr· ® Tyr-Tyr (битирозилы) (4)
Это является основной причиной не только конъюгации свободного тирозина с белками, но и возникновения межмолекулярных ковалентных сшивок полипептидных цепей под действием геминовых пероксидаз. Конечный же продукт окислительной трансформации тирозина с участием гипохлорита (п-гидроксифенилацетат) в результате аналогичного процесса, где он также выступает в качестве субстрата-восстановителя в пероксидазной реакции, может превращаться в возбужденную (триплетную) форму бензальдегида с отщеплением муравьиной кислоты (НСООН). Однако данный процесс требует участия молекулярного кислорода и осуществляется по механизму пероксидазно-оксидазных реакций.
Сильным хлорирующим агентом, помимо указанных, выступает и NO2Cl (продукт взаимодействия гипохлорита с нитритом), обладающий к тому же и нитрирующей активностью:
HOCl + NO2- + H+ ® H2O + NO2Cl. (5)
При непосредственном окислении МПО-зой в ее каталитическом цикле, нитрит трансформируется в активный свободный радикал - NO2·. В каталитический цикл МПО в качестве субстрата вовлекается и пероксинитрит (HONOO). В результате нитрирующая активность HONOO возрастает на порядки.
По устойчивости к действию OCl- свободные аминокислоты можно расположить в следующем порядке:
Cys ~ Met >> Trp > His ~ Arg ~ Asp > Lys,
Cys ~ Met >> Ser > Leu.
Цистеин и метионин в 100 раз более чувствительны к действию гипохлорита, чем ближайшие в этом ряду к ним аминокислоты. Соединения с дисульфидной связью (цистин и окисленный глутатион) более устойчивы. Только одна из аминокислот - метионин, будучи трансформированной под действием OCl- в метионинсульфоксид, может быть восстановленна до исходного состояния. Цистеин и другие тиолы в результате воздействия этого окислителя трансформируются в соответствующие сульфоновые, сульфиновые и сульфеновые кислоты, и только лишь в небольшое количество регенерируемых продуктов - дисульфидов.
Превращение других аминокислот под воздействием OCl- (в концентрациях агента, модифицирующих их структуру и встречающихся в очаге воспаления) заключается в образовании нестабильных хлораминов. Последние подвергаются декарбоксилированию и дезаминированию (как описано выше) с образованием токсичных альдегидов.
Характер продуктов окислительной модификации аминокислотных остатков в структуре белков и свободных аминокислот может не совпадать. Тем не менее, можно полагать, что наиболее подверженные окислению аминокислоты будут подвергаться в первую очередь окислительной модификации и в структуре белка. Так цистеин и метионин оказались теми критичными остатками, окисление которых происходит при более низких концентрациях окислителя (OCl-) и отражается на функциональной активности белков:
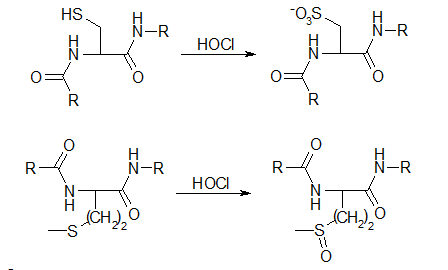
Наряду с хлорирующей активностью и ролью в качестве предшественников альдегидов, упомянутые выше хлорамины способны осуществлять и конъюгацию полипептидных цепей путем окисления тиоловых групп белков:
RNHCl + 2R'SH ® RNH2 + R'SSR'+ H+ + Cl- (6)
Источником биологически активных альдегидов выступают и продукты взаимодействия гипохлорита с липидами мембран и липопротеидами крови.
OCl- участвует в образовании гидроксильного радикала и синглетного кислорода:
HOCl + O2-· ® Cl- + O2 + HO· k=7.5×106 M-1c-1 (7)
Альтернативным или дополнительным к указанному механизму МПО-зависимой продукции НО· служит реакция образования дихлоридрадикала с участием Fe2+:
HOCl + HCl + Fe2+ ® Fe3+ + H2O + Cl2-· (8)
При рН>4 этот анион-радикал быстро превращается в гидроксильный радикал:
Cl2-. ® Cl- + Cl· (9)
Cl· + H2O ® ClOH-· + H+ (10)
ClOH-· ® Cl- + HO· (11)
Образующийся в ходе этих (а также уже ранее рассмотренных) реакций гидроксильный радикал частично может расходоваться и на некаталитический путь генерации гипохлорита:
2НО· + Н+ + Cl- ® HOCl + H2O (12)
Реакция эта высоко экзергонична и характеризуется разностью редокс-потенциалов, равной +1.24В.
Дихлоридный анион радикал способен участвовать и в следующих превращениях:
Cl2- + HO· ® HOCl + Cl- k =109 M-1c-1
Cl2- + HO2· ® 2Cl- + O2 + H+ k =109 M-1c-1
Cl2- + Cl2- ® Cl2 + 2Cl- k =7×107 M-1c-1
Наряду с реакцией полной дисмутации дихлоридных радикалов, при их взаимодействии наблюдается образование и нового окислителя:
Cl2- + Cl2- ® Cl3- + Cl- k =7.9×109 M-1c-1
Причем, эта реакция протекает быстрее по сравнению с предыдущей, что следует из сопоставления величин констант скоростей.
МПО может выступать и эффективным ингибитором образования НО· (осуществляемого по «неуправляемому» механизму Фентона). Константа скорости взаимодействия МПО с Н2О2 (k =2.5×107 M-1c-1) на порядки выше, чем аналогичная константа реакции восстановления пероксида ионами железа и меди. Таким образом, этот фермент способен не только служить продуцентом АМК (и других повреждающих) факторов, но и минимизировать общее биоцидное действие "несанкционированно" образующихся АФК, канализируя их действие в микробицидное.
Основным источником образования синглетного кислорода фагоцитирующими нейтрофилами выступают реакции:
HOCl + H2O2 ® H2O + Cl- + H+ + 1O2 (13)
(энергетический выход этой реакции до О2 в его основном триплетном состоянии составляет: ΔG0=-156.5 кДж/моль и ΔH0=-145.6 кДж/моль), а также:
OCl- + H2O2 ® H2O + Cl- +1O2 k=3.4×103 M-1c-1 (14)
(ΔG0 = -199.2 кДж/моль, ΔH0 = -162.8 кДж/моль - для О2 в основном состоянии).
Нейтрофилы содержат значительные количества одной из неканонических аминокислот - таурина. Таурин играет роль как фактора, сдерживающего развитие гипохлоритзависимых повреждений, так и фактора их инициирующего. Продукт взаимодействия OCl- c таурином - тауринхлорамин:
HOCl + H2N-CH2-CH2-SO3H ® H2O + ClHN-CH2-CH2-SO3H (15),
обладает собственным окислительным потенциалом, но гораздо более узконаправленным, а именно, будучи долгоживущей субстанцией, по сравнению с OCl-, тауринхлорамин преимущественно воздействует на метиониловые остатки белков, трансформируя их в метионилсульфоксид. Последний является той формой окисления метионила, которая может быть регенерирована в исходный аминокислотный остаток в белках и пептидах с помощью специализированного фермента – метионилсульфоксидредуктазы. В данном случае таурин выполняет функцию кофактора метионилсульфоксидредуктазной системы, обеспечивающего переориентацию деструктивного потенциала МПО в сторону редокс-регуляторных процессов.