Мышечная ткань составляет 40–42 % массы тела. А у атлетов высокого класса, в том числе у культуристов, может доходить до 70 % (см. презентацию). Она выполняет важнейшую динамическую функцию – обеспечивает подвижность, чередуя процессы сокращения и последующего расслабления. Это единственная ткань в организме, которая при сокращении превращает химическую энергию в механическую. К биохимическим функциям мышц относятся:
• осуществление метаболизма;
• энергетическое обеспечение мышечной деятельности;
• осуществление мышечного сокращения и расслабления, их регуляция.
Выделяют три вида мышечной ткани: скелетная мускулатура, сердечная мышца (миокард) и гладкая мускулатура. Первые две из перечисленных имеют поперечно-полосатую исчерченность, что определяется их морфо-функциональным строением (см. презентацию).
В мышечной ткани человека содержится 72–80 % воды. Около 20–28 % приходится на долю сухого остатка, преимущественно белков. В состав входят гликоген и другие углеводы, липиды, экстрактивные азотсодержащие вещества, соли органических и неорганических кислот, минеральные вещества и др. (табл. 1).
Таблица 1 Химический состав поперечно-полосатых мышц млекопитающих
| Состав | Содержание в процентах от сырой массы |
| Вода | 72–80 |
| Плотные вещества | 20–28 |
| В том числе: | |
| белок | 16,5– 0,9 |
| гликоген | 0,3–3,0 |
| глицерофосфолипиды | 0,4–1,0 |
| холестерол | 0,06–0,2 |
| креатин и креатинфосфат | 0,2–0,55 |
| креатинин | 0,003–0,55 |
| АТФ | 0,25–0,40 5 |
| карнозин | 0,2–0,3 |
| карнитин | 0,02–0,05 |
| ансерин | 0,09–0,15 |
| свободные аминокислоты | 0,1–0,7 |
| лактат | 0,01–0,02 |
| минеральные вещества | 1,0–1 |
В мышцах вода входит в состав большинства клеточных структур и выполняет теже функции, что и в других тканях. Из катионов больше всего. калия и натрия. K+ сосредоточен, главным образом, внутри мышечных волокон, а Na+ – преимущественно в межклеточном веществе. В небольшой концентрации присутствуют магний, кальций, железо и ряд микроэлементов: кобальт, алюминий, никель, бор, цинк и др.
Скелетные мышцы активно участвуют в метаболизме белков и аминокислот. В клетке белки распределены следующим образом: в миофибриллах – 4 % от общей суммы, в саркоплазме – 30 %, в митохондриях – 14 %, в сарколемме – 15 %, в ядрах и других клеточных органеллах – около 1 %. В скелетных мышцах интенсивно протекают процессы деградации аминокислот, особенно с разветвленной боковой цепью, осуществляется ресинтез и высвобождение в кровь глутамина и аланина. Таким путем мышцы обеспечивают печень и почки азотом.
При голодании мышечные белки служат энергетическим резервом организма. Они интенсивно гидролизуются. Образовавшиеся аминокислоты переносятся в печень и метаболизируют до ацетил-КоА и ацетоацетил-КоА. Последние окисляются в цикле трикарбоновых кислот или используются как субстраты для глюконеогенеза. Синтез и расщепление мышцечных белков контролируется стероидными гормонами. Кортизол подавляет биосинтез белка, а тестостерон и синтетические анаболики его стимулируют.
На основании физико-химических свойств экстрагируемые мышечные белки разделяют на 3 класса:
• растворимые в воде;
• экстрагируемые 8–12 % раствором аммоний хлорида;
• извлекаемые разбавленными растворами кислот и щелочей.
На основании локализации в мышечной клетке выделяют три основные группы белков:
• саркоплазматические. На их долю приходится около 35 % от всех белков;
• стромы – 20 % от всего количества мышечного белка
• миофибриллярные, составляющие около 45 %;
Эти группы существенно отличаются друг от друга по растворимости в воде и солевых средах с различной ионной силой.
Белки саркоплазмы в основном относятся к протеинам, растворимым в солевых средах с низкой ионной силой. В саркоплазме локализованы дыхательный пигмент миоглобин, ферменты гликолиза, митохондриальные белки, катализирующие процессы тканевого дыхания, окислительного фосфорилирования, белки, обеспечивающие метаболизм азотистого и липидного обмена.
Белки стромы в поперечнополосатой мускулатуре преимущественно представлены коллагеном и эластином. Строма скелетных мышц в значительной мере состоит из соединительнотканных элементов стенок сосудов и нервов, а также сарколеммы и некоторых других структур.
Белки миофибрилл. К это группе относятся белки, растворимые в солевых средах с высокой ионной силой – миозин, актин и актомиозин, и белки с регуляторными свойствами, образующие в мышце с актомиозином единый комплекс, – тропомиозин, тропонин, и другие белки (α- и β-актинины, десмин, коннектин, виментин и т.д.). Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц. Сократительные элементы (саркомеры) состоят из двух типов параллельных нитей, тонких филаментов F-актина и толстых филаментов миозина. Мономерный актин (G-актин) – это глобулярный белок с М.м.43 кДа, составляет 25 % общей массы мышечного белка. Молекула G-актина с М.м. 42 кД состоит из 374 аминокислотной остатков, собранных в одну полипептидную цепь, упакованную в глобулу. При физиологической величине ионной силы и в присутствии Mg++ молекулы G-актин нековалентно объединяются, образуя фибриллярный F-актин. Две цепи F-актина связаны в спираль. Волокно F-актина имеет толщину 6–7 нм, через 35,5 нм структурные элементы повторяются. G- и F-актины не обладают каталитической активностью.
Вместе с актином присутствуют еще четыре минорных белка – тропомиозин и три белка тропониновой системы. Тропомиозин – вытянутая в виде тяжа молекула длиной 40 нм, его М.м. 65 кД. Он состоит из α- и β-цепей, примыкающих к F-актину в щели между его двумя полимерными цепями. На долю тропомиозина приходится 4–7 % от содержания всех белков миофибрилл, он присутствует во всех мышцах и подобных им структурах. Характерной особенностью поперечнополосатых мышц является наличие тропониновой системы. Она составляет 2 % от всех миофибриллярных белков и включает три белка:
• тропонин Т (ТnТ), связывается с тропомиозином и тропонином TnI;
• тропонин I (TnI) ингибирует взаимодействие между F-актином и миозином и связывается с другими компонентами тропонина.
• тропонин С (ТпС) – кальций-связывающий белок, взаимодействует с TnI и тропомиозином. Первичная и вторичная структура и его функции аналогичны этим же характеристикам распространенного в природе белка кальмодулина. Молекула тропонина С (и кальмодулина) связывает четыре иона кальция, имеет М.м. 17 кДа.
Из F-актина, тропомиозина и трех тропониновых компонентов: ТпС, Tnl и ТпТ формируется тонкий филамент поперечнополосатой мышцы. Тропомиозин и тропониновая система чередуются через каждые 38,5 нм (рис. 1).
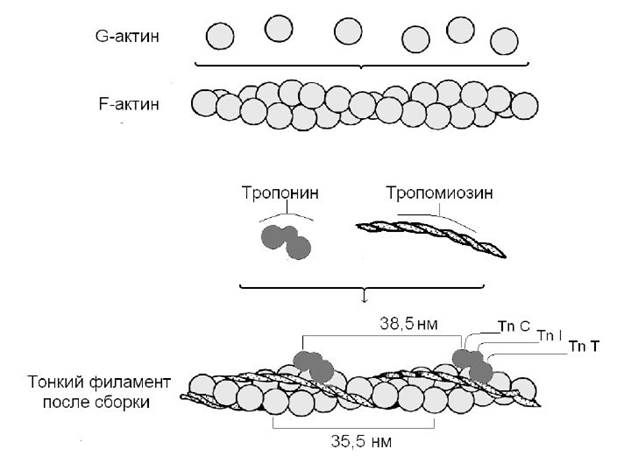
Рис. 1 Структурные белки и строение тонких филаментов
В поперечно-полосатых мышцах содерюится титин (тайтин или коннектин) – самый большой белок из одиночных полипептидов (М.м.около 2993,442 кДа). Он играет важную роль в процессе сокращения мышц. Титин состоит главным образом из линейных блоков модулей двух типов: тип I – фибронектиновый домен, тип II – иммуноглобулиноподобный домен. Эти линейные блоки далее формируют два участка:
N-терминальный (в составе I-полос саркомера). Действует как эластичная часть молекулы и состоит, в основном, из модулей типа II. Располагается между миозином и Z-диском. C-терминальный (в составе А-полос) выполняет управляющую функцию и, вероятно, обладает протеинкиназной активностью. А-полосы состоят из чередующихся модулей типа I и типа II. N-концевой участок Z-диска и C-концевой участок титина связаны с Z-диском и М-линией саркомера таким образом, что молекула титина занимает половину длины саркомера. Титин содержит скрепляющие участки для присоединения мышечных белков и служит матрицей для правильной сборки белков саркомера. Он также входит в качестве структурного белка в состав хромосом.
Миозин – составляет 50–55 % от сухой массы миофибрилл. Он образует толстые филаменты (нити). Одна молекула миозина представляет собой асимметричный гексамер с М.м. 500 кДа (из скелетных мышц человека), имеет длину 150 нм и сильно вытянутую форму. В миозине различают фибриллярную часть, состоящую из двух переплетенных в спираль тяжелых цепей (Т), с общей М.м. 223 кДа. Каждая Т-цепь заканчивается глобулярной головкой. К головкам примыкают по две пары легких цепей (L) с суммарной М.м. 15–27 кДа. В физиологических условиях (оптимальнае pH, температура, концентрация солей) формируется гексамерная вытянутая структура. Головки остаются свободными (рис. 2).
Головка миозина обладает Са2+-зависимой АТР-азной активностью и может связывается с F-актином. Легкие цепи регулируют активность. Приблизительно 400 молекул миозина объединяются в толстый филамент. Половина молекул миозина повернута головками к одному концу филамента, а вторая половина к другому (рис. 2).
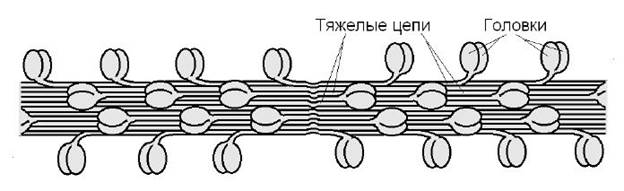
Рис. 2 Строение тяжелых миозиновых филаментов.
Большая часть сведений о миозине получена при изучении продуктов его частичного гидролиза.
Обработка миозина трипсином приводит к образованию двух фрагментов – меромиозинов. Легкий меромиозин (ЛММ) состоит из агрегированных нерастворимых α-спиральных фибрилл. Он не обладает АТФ-азной активностью и не связывается с F-актином. Тяжелый меромиозин (ТММ) представляет собой растворимый белок с М.м. 340 кДа, содержащий и фибриллярный, и глобулярный фрагменты. Он обладает АТФ-азной активностью и связывается с F-актином. При гидролизе ТММ папаином образуются два субфрагмента – ТММ S-1 и ТММ S-2. ТММ S-2 имеет фибриллярную структуру, не проявляет АТФ-азной активности и не связывает F-актин. S-1 характеризуется М.м. 115кДа, проявляет АТФ-азную активность, а в отсутствие АТФ связывает актин, снабжая его «наконечниками». Активность ТММ S-1 и ТММ при добавлении F-актина возрастает в 100–200 раз, что резко ускоряет процесс гидролиза АТФ миозиновой АТФ-азой.
Хотя F-актин сам по себе не влияет на гидролиз АТФ, его способность стимулировать освобождение продуктов АТФ-азной реакции (АДФ и неорганического фосфата) обеспечивает значительное увеличение общей скорости катализа. α-Актинин – это обнаруживаемая в зоне Z-линии белковая молекула, к которой присоединяются концы F-актиновых молекул тонких филаментов. Миофибриллы содержат приблизительно 2500 филаментов. К одной толстой миозиновой нитке примыкает 6 тонких.
В скелетных мышцах содержится ряд важных азотистых веществ: адениновые нуклеотиды (АТФ, АДФ и АМФ), нуклеотиды неаденинового ряда, креатинфосфат, креатин, креатинин, карнозин, ансерин, свободные аминокислоты и др. Концентрация нуклеотидов аденинового ряда во много раз превосходит концентрацию нуклеотидов неаденинового ряда (ГТФ, УТФ, ЦТФ и др.). До 60 % небелкового азота мышц приходится долю креатина и креатинфосфата, участвующих в энергетических процессах, обеспечивающих мышечное сокращение. Как известно, биосинтез креатина в основном происходит в печени. Из нее с током крови он поступает в мышечную ткань, фосфорилируется и превращается в креатинфосфат. В синтезе креатина участвуют аргинин, глицин и метионин. Дипептиды карнозин (β-аланил-L-гистедин) и анзерин (N-метилкарнозин) увеличивают амплитуду мышечного сокращения, предварительно сниженную утомлением. Они не влияют непосредственно на сократительный аппарат, но увеличивают эффективность работы ионных насосов мышечной клетки. Из свободных аминокислот в мышцах больше всего глутамата (около 1,2 г/кг) и глутамина (0,8 – 1,0 г/кг). В состав клеточных мембран входят общеизвестные фосфолипиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и др.). Особенностью мышечной ткани является то, что они принимают участие в обменных процессах в качестве субстратов тканевого дыхания. В небольшом количестве встречаются другие азотсодержащие вещества: мочевина, мочевая кислота, аденин, гуанин, ксантин и гипоксантин. Они, как правило, являются либо промежуточными, либо конечными продуктами азотистого обмена.
Из безазотистых органических веществ мышечной ткани наибольшее значение имеет гликоген. Его концентрация колеблется от 0,3 до 2 % и выше. На долю других углеводов приходится от десятых до сотых долей процента. Глюкоза в мышцах очень быстро метаболизирует и в свободном виде присутствует в следовых количествах. Очень мало гексозофосфатов. В процессе метаболизма из глюкозы и аминокислот в мышечной ткани образуются лактат, пируват и другие карбоновые кислоты. Обнаруживаются также ацилглицеролы и холестерол.
Процесс сокращения и расслабления связан с потреблением большого количества АТР миозин-АТР-азой. Это требует бесперебойного обеспечения мышц макроэргическими соединениями (рис 3). Запас АТФ, имеющийся в мышцах, расходуется менее чем за 1 с после стимуляции.
Потребности работающей мышцы в АТФ обеспечиваются созданием резерва в виде креатинфосфата. Быстрая регенерация АТФ достигается за счет переноса фосфатной группы с креатинфосфата на АДФ креатинкиназой. Но и этот мышечный энергетический резерв расходуется за несколько секунд. В спокойном состоянии креатинфосфат синтезируется из креатина. Фосфатная группа присоединяется по гуанидиновой группе кретина (N-гуанидино-М-метилглицина). Креатин синтезируется в печени, поджелудочной железе, почках и накапливается в мышцах. Здесь он медленно неферментативно циклизуется с образованием креатинина, который поступает в почки и удаляется из организма; В мышечной ткани интенсивно протекают процессы гликогенолиза и анаэробного гликолиза. Долгосрочным энергетическим резервом является гликоген. Он под действием фосфорилазы расщепляется с образованием глюкозо-6-фосфата, который путем гликолиза првращается в пируват. При недостатке кислорода пируват восстанавливается в молочную кислоту, которая диффундирует в кровь (цикл Кори). Гликолитическому расщеплению подвергается и поступающая в мышцы глюкоза.
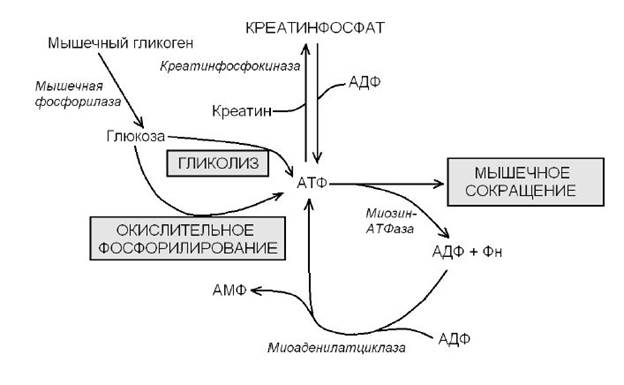
Рис. 3 Схема энергетического обмена в мышцах.
Окислительное фосфорилирование – постоянно действующий путь ситеза АТФ. В аэробных условиях пируват поступает в митохондрии, окисляется в цикле Кребса и дыхательной цепи. Это самый эффективный путь синтеза АТФ, но он реализуется при условии хорошего снабжения мышц кислородом. Для синтеза АТФ используются жирные кислоты и кетоновые тела. В мышцах запас энергии может осуществляться путем образования инозинмонофосфата (ИМФ) Источником быстрого восстановления уровня АТФ является конверсия АДФ в АТФ и АМФ (2АДФ → АТФ + АМФ), катализируемая миокиназой (аденилаткиназой). Образовавшийся АМФ за счет дезаминирования частично превращается в ИМФ, что сдвигает реакцию в сторону образования АТР. В «медленных » (красных) скелетных мышцах источником энергии для синтеза АТФ служит окислительное фосфорилирование. В обеспечении этих мышц кислородом принимает участие миоглобин. Они имеют хорошее кровоснабжение, много митохондрий, высокую активность ферментов окислительного фосфорилирования. Такие мышцы предназначены для работы в аэробном режиме, служат для поддержания тела в определенном положении (поза, осанка). В «быстрых » скелетных мышцах (белых), лишенных миоглобина, главным источником образования АТР является анаэробный гликолиз. В них много гликогена, высокая активность ферментов гликолиза, они недостаточно кровоснабжаются. Такие мышцы способны обеспечивать кратковременную работу максимальной мощности, имеют низкий выход АТР). Мышцы истощаются в результате изменения рН за счет повышения концентрации лактата.
Промежуточные мышцы «быстрые красные » – сохраняют свойства и красных, и белых. У человека нет специализированных мышц, но есть специализированные волокна всех видов: в мышцах-разгибателях больше «белых» волокон, в мышцах спины больше «красных» волокон.
Процентное содержание тех или иных волокон предопределяет специализацию атлета. Обладатели преимущественно красной мускулатуры, чаще всего, достигают лучших результатов в видах на выносливость (бег на средние и длинные дистанции, плавание, велосипедный спорт и т. д.). Те, у кого больше белых мышечных волокон, выигрывают в силовых упражнениях, так как белые волокна легче гипертрофируются (увеличиваются в объеме), и тренируются «на силу». Не все генетически предопределено. Работают и тренировочные факторы.