Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
24.Основные представления о ковалетной связи.Особенности ее Донорно-акценторный механизм.Образования ковалетной связи.
Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, в молекулах Н2, Cl2, О2, в кристалле алмаза), так и между разными атомами (например, в молекулах Н2О и NН3, в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными (С-С, С-Н, С-N, и др.).
Различают два механизма образования ковалентной связи:
1) обменный;
2) донорно-акцепторный.
Обменный механизм образования ковалентной связи заключается в том, что каждый из соединяющихся атомов предоставляет на образование общей электронной пары (связи) по одному неспаренному электрону. Электроны взаимодействующих атомов должны при этом иметь противоположные спины.
Рассмотрим для примера образование ковалентной связи в молекулеводорода. При сближении атомов водорода происходит проникновение их электронных облаков друг в друга, которое называется перекрыванием электронных облаков (рис. 3.2), электронная плотность между ядрами возрастает. Ядра притягиваются друг к другу. Вследствие этого снижается энергия системы. При очень сильном сближении атомов возрастает отталкивание ядер. Поэтому имеется оптимальное расстояние между ядрами (длина связи l), при котором система имеет минимальную энергию. При таком состоянии выделяется энергия, называемая энергией связи Есв.
Н Н Н2

Рис. 3.2. Схема перекрывания электронных облаков при образовании молекулы водорода
Схематично образование молекулы водорода из атомов можно представить следующим образом (точка означает электрон, черта – пару электронов):
Н + Н→Н: Н или Н + Н→Н – Н.
В общем виде для молекул АВ других веществ:
А + В = А: В.
Донорно-акцепторный механизм образования ковалентной связи заключается в том, что одна частица – донор – представляет на образование связи электронную пару, а вторая – акцептор – свободную орбиталь:
А: + В = А: В.
донор акцептор
Рассмотрим механизмы образования химических связей в молекул  е аммиака и ионе аммония
е аммиака и ионе аммония  .
.
1. Образование 
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:


 Атом водорода на s – подуровне имеет один неспаренный электрон.
Атом водорода на s – подуровне имеет один неспаренный электрон.
В молекуле аммиака неспаренные 2р – электроны атома азота образуют три электронные пары с электронами 3-х атомов водорода:
 .
.
В молекуле NH3 образованы 3 ковалентных связи по обменному механизму.
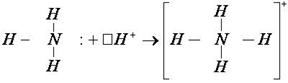
2. Образование комплексного иона – иона аммония.
NH3 + HCl = NH4Cl или NH3 + H+ = NH4+
У атома азота остается неподелённая пара электронов 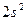 , т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
, т. е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода. Неподеленная пара электронов становится общей для атомов азота и водорода, возникает химическая связь по донорно – акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором:
 .
.
Следует отметить, что в ионе NH4+ все четыре связи равноценны и неразличимы, следовательно, в ионе заряд делокализован (рассредоточен) по всему комплексу.
Рассмотренные примеры показывают, что способность атома образовывать ковалентные связи обусловливается не только одноэлектронными, но и 2-электронными облаками или наличием свободных орбиталей.
По донорно-акцепторному механизму образуются связи в комплексных соединениях: [BF4]-; [Cu(NH3)4]2+; [Zn(OH)4]2- и т. д.
Ковалентная связь обладает следующими свойствами:
-насыщаемость;
- направленность;
- полярность и поляризуемость.
25.Ионная связь. Отличительные свойства.
Ионная связь представляет собой предельный случай полярной связи, когда электроотрицательности взаимодействующих атомов настолько сильно отличаются друг от друга, что связывающая электронная пара полностью переходит от атома с меньшей электроотрицательностью к атому с большей электроотрицательностью, следствием чего является превращение атомов в положительный и отрицательный ионы.
Электростатическая природа ионной связи обуславливает ее основные свойства - ненаправленность и ненасыщаемость. Ненаправленность ионной связи обусловлена сферической симметрией электростатического поля иона, вследствие которой заряженная частица притягивает ионы противоположного знака равномерно по всем направлениям.
Образование ионной связи с частицей противоположного заряда нарушает сферическую симметрию поля, но само поле не исчезает. Поэтому, образовав одну ионную связь, ион не утрачивает способность к электростатическому взаимодействию с другими частицами.
Вследствие этого молекулы с ионным типом связи существуют только при высокой температуре в газовой фазе. В конденсированном состоянии ионы стремятся окружить себя максимальным число ионов противоположного знака, что приводит к образованию веществ с немолекулярной структурой - ионных агрегатов (ионных кристаллов).
Общий тип химической связи обуславливает некоторые общие свойства, присущие всем ионным соединениям:
1. Ионные соединения имеют высокую температуру плавления и низкую летучесть. Это явление объясняется сильным электростатическим притяжением между катионами и анионами в соединении. Так, в кристалле хлорида цезия ион цезия окружают восемь ионов хлора, находящихся на кратчайшем расстоянии от него, а каждый ион хлора - восемь ионов цезия.
2. Ионные соединения, как правило, имеют низкую электрическую проводимость в кристаллическом состоянии, так как ионы, находящиеся в узлах кристаллической решетки, не способны к поступательному движению. В расплавах ионы такую способность обретают, в результате чего расплавы ионных соединений хорошо поводят электрический ток.
3. Ионные кристаллы тверды, но хрупки. Твердость ионных соединений объясняется отсутствием в них направлений, по которым кристаллическая решетка могла бы расслаиваться, как, например, в случае кристалла графита. Хрупкость ионных кристаллов связана с тем, что даже незначительные деформации решетки сопровождаются сближением одноименно заряженных ионов, в результате чего баланс сил отталкивания и притяжения нарушается, а кристалл раскалывается.
4. Ионные соединения обычно заметно растворимы в полярных растворителях. Полярные растворители характеризуются высокими значениями диэлектрической постоянной, которая связана с энергией взаимодействия двух заряженных частиц уравнением
где Z+ и Z- - заряды взаимодействующих частиц, r - расстояние между ними, e - диэлектрическая постоянная среды. Для воды диэлектрическая постоянная составляет 7,25×10-10 Кл2×Дж-1×м-1, тогда как диэлектрическая постоянная вакуума (e0) равна 8,85×10-12 Кл2×Дж-1×м-1, то есть в 82 раза меньше. Изменение диэлектрической постоянной при переходе от вакуума к воде в 82 раза понижает энергию взаимодействия, что способствует распаду вещества на ионы. Примером других жидкостей с высокими значениями диэлектрической проницаемости могут служить циановодород (158 e0), фтороводород (83,6 e0), муравьиная кислота (57,9 e0), метиловый спирт (37,9 e0), жидкий аммиак (25,0 e0).
Повышению растворимости ионных соединений в полярных растворителях может благоприятствовать также сольватация образующихся ионов, являющаяся экзотермическим процессом.