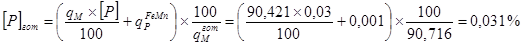Эти потери составляют:
qFeп =10-5*Vг*Feп*qп
где:
Feп =75% -содержание железа в пыли, qп =100г/м^3 - содержание пыли в газе.
Объем газа находим по формуле:
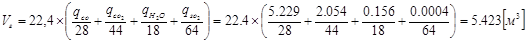
Масса железа теряемая с пылью:
qFeп =10-5*5,423* 75*100=0,407кг
Принимаем:
qмл =0,989кг - масса ржавчины (окалины) и мусора в ломе
qмшл =0,8кг - масса миксерного шлака и определяем выход жидкой стали
qм1=(qмзав+qFeвосст)-(qFeок+qSD[S]+qкор+qвыб+qFeп+qмл+qм.шл)
qм1=100+0,798-1,99-3,751-0,44-2-0,407-0,989-0,8=90,421кг
2.11 Остаточное содержание примесей в металле
Остаточное содержание марганца в металле находим как:

где:
SMn =[Mn]ших + 0,775 * SMnOдр

тогда:
Т =tгот + 273 =1629,08+ 273 =1902,08°К
SMn =0,65+0,775*0,064=0,7кг
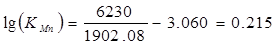 КMn=1.641
КMn=1.641

Остаточное содержание фосфора в металле:

принимаем:
aр1 =60
тогда:
SP=0,123+0,437*0,011=0,128кг

Остаточное содержание серы в металле:

принимаем:
as1 = 6
DSгф =0,075*0,048=0,0036кг
SS=0,048+0,012-0,0036=0,0564кг
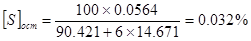
2.12 Расчет количеств удаляемых примесей из металла
D[C] =[C]ших-0,904*[C]=2,981-0,904*0,126=2,867кг
D[Si]=[Si]ших-0,904*[Si]=0,639-0,904*0=0,639кг
D[Mn]=[Mn]ших-0,904*[Mn]=0,65-0,904*0,175=0,492кг
D[P]=[P]ших-0,904*[P]=0,123-0,904*0,0326=0,094кг
D[S]=[S]ших-0,904*[S]=0,048-0,904*0,0266=0,024кг
всего:qSD[S]=4,116кг
2.13 Расход дутья и продолжительности продувки
Расход кислородного дутья на основе рафинирования определяем как:
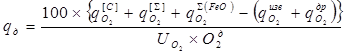
где: О2д=99,5% - содержание кислорода в дутье
UO2 =0,9- коэффициент усвоения кислорода дутья ванной
Значения остальных величин определяем предварительным расчетом.
Расход кислорода на окисление углерода находим по формуле:
qO2[C] =ac * D[C]
где: ac=1,46кг
тогда:
qO2[C]=1,46*2,867=4,186кг
qO2[S]=1,14*[Si]+0,29*[Mn]+1,29*[P]=1,14*0,639+0,29*0,492+1,29*
*0,094=0,992кг
Расход кислорода на образование оксидов железа шлака составит:
qO2S[FeO] =10-4 * qшл * {30 * (Fe2O3) + 22,2 * (FeO)}
следовательно:
qO2S[FeO]=10-4*14,671*(30*6,71284+22,2*13,4331)=0,733кг
В окислительных процессах участвует также кислород извести в виде СО2, количество которого определяем по зависимости:
qО2изв=36,4 * 10-4 * qизв * r * (CO2)
следовательно:
qО2изв=36,4 * 10-4 *8,357* 0,8 *9=0,219кг
Поступление кислорода в ванну из других источников определим как:
qО2др=10-2 * (30 * qFe2O3др + 22,2 * qFeOдр)
следовательно:
qО2др =10-2 * (30 *0,896+ 22,2 *0,219) =0,317кг
тогда расход дутья составит:

Vд =7 * qд =7 *6,002=42,014 м3/т
Определим теперь продолжительность продувки:
Принимаем интенсивность продувки iO2 =4м3/т*мин

2.14 Масса металла в конце продувки
qFeок =qFeO *0,78 + qFe2O3 * 0,7 =1,761* 0,78 +0,88* 0,7 =1,99кг
Тогда масса металла составит:
qм=(100+qFeвосст)-(qFeок+qSD[S]+qкор+qвыб+qFeл+qлм+qмшл)
qм=(100+0,798)-(1,99+3,751+0,44+2+0,407+0,989+0,8)=90,421кг
2.15 Материальный баланс
Для расчета материального баланса находим количества СО, СО2 и N2 в отходящих газах:
qN2 =10-2*qд*N2д
N2д =0,5%
qN2 =10-2 *6,002*0,5=0,03кг
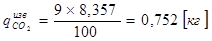

Количество газа выделяемого неметаллической шихтой
qСО2 =0,752+0,167=0,919кг
Общее количество газа
qСО2 =0,919+2,09=3,009кг
Баланс сводим в таблицу
| Задано | Получено | |||
| наименование статьи | количество, кг | наименование статьи | количество, кг | |
| чугун | 75,173 | металл | 90,421 | |
| лом | 24,827 | шлак | 14,671 | |
| известь | 8,357 | выбросы металла | ||
| окатыши | 0,3 | корольки железа в шлаке | 0,44 | |
| дутье кислородное | 6,002 | потери металла с пылью | 0,407 | |
| футеровка | Газы | СО | 5,32 | |
| боксит | 0,8 | СО2 | 3,009 | |
| Н2О | 0,156 | |||
| SO2 | 0,0036 | |||
| N2 | 0,03 | |||
| Итого | 116,459 | Итого | 116,4576 |
невязка: 
2.16 Температура металла в конце продувки
Из уравнения теплового баланса находим:

где:
QприхS- полный приход тепла кДж
Qрасх1- все статьи расхода тепла, кроме нагрева металла и шлака, кДж
Определяем полный приход тепла:
QприхS =Qчугфиз + Q[S]хим + Q(SFeO)обр + Qшо + Qм.шлфиз + QСОдож [кДж]
Qчугфиз=(qчуг-qм.шл)*(6,19+0,88*tчуг)=74,373*(6,19+0,88*1300)=85543,1
Q[S]хим =14770*D[C]+29970*D[Si]+7000*D[Mn]+21730*D[P]
Q[S]хим =14770*2,867+29970*0,639+7000*0,492+21730*0,094=66983кДж
Q(SFeO)обр=10-2*qшл*[3707*(FeO)+5278*(Fe2O3)]
Q(SFeO)обр=10-2*14,671*[3707*13,4331+5278*6,71284]=12503,6кДж
Qшо =qшл * [6,28(CaO) + 14,64(SiO2) + 41,84(P2O5)]
Qшо=14,671*(6,28*57,2544+14,64*17,4637+41,84*1,599)=10007,5кДж
Qм.шлфиз =(1,463*tчуг-585)*qм.шл =(1,463*1300-585)*0,8=1053,52кДж
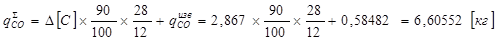
QСОдож=10100 * qCOS *UCO * Z =10100 *6,60552*0,195*0,795=10342,6кДж
Итого полный приход тепла:
QприхS =85543,1+66983+12503,6+10007,5+1053,52+10342,6=186433кДж
Определяем далее расход тепла
QрасхS =Qг + Q(SFeO)разл + Q(Н2О)исп + Qкарбразл + QFeг + QМвыб + Qпот
где:
Qг = QCO + QCO2 + QN2
Qг =(1,32*1500-220)*(5,32+3,009+0,03)=14711,8кДж
Тепло затраченное на полное разложение оксидов железа, составит:
Q(SFeO)разл=5278*qFe2O3+3707*qFeO=5278*0,896+3707*0,219=5540,92кДж
QH2Oисп=(2485+1,88*tсрг)*qH2O=(2485+1,88*1500)*0,156=827,58кДж
Qкарбразл =40,38 * qизвСО2 =40,38 *8,357*9=3037,1кДж
QFeг=(23+0,69*tсрг)*qFeп=(23+0,69*1500)*0,407=430,606кДж
Qмвыб=(54,8+0,84*tм)*qмвыб=(54,8+0,84*1629,08)*2=2846,45кДж
Потери тепла составляют в среднем 2 - 4% от суммарного прихода. Если принять потери тепла равными 2,729%, то получим:
Qпот =0,02729 * QприхS =0,02729*186433=5087,77кДж
Таким образом суммарный расход тепла составит:
QрасхS =32482,3кДж
Определяем температуру металла:
заданная температура металла =1629,08°С


Составим теперь тепловой баланс плавки.
Недостающие статьи теплового баланса определяются как:
Qмфиз= Нмфиз * qм =(54,8+0,8*1629,09) *90,421=122798кДж
| Qшлфиз= Ншлфиз * qшл =(2,09*1629,09- 1379) *14,671=29720,4кДж Приход | кДж | % | Расход | кДж | % |
| физическое тепло чугуна | 85543,1 | 45,884 | физическое тепло металла | 66,3771 | |
| физическое тепло миксерного шлака | 1053,52 | 0,56509 | физическое тепло шлака | 29720,4 | 16,065 |
| химическое тепло от окисления прим | 35,9287 | физическое тепло отходящих газов | 14711,8 | 7,95231 | |
| тепло окисления железа | 12503,6 | 6,70675 | разложение оксидов железа | 5540,92 | 2,99508 |
| тепло шлакообразования | 10007,5 | 5,36787 | тепло испарения влаги | 827,58 | 0,44734 |
| тепло дожигания СО | 10342,6 | 5,54762 | тепло на разложение карбонатов | 3037,1 | 1,64167 |
| тепло железа, уносимое газом | 430,606 | 0,23276 | |||
| тепло выбросов (металла, шлака) | 2846,45 | 1,53862 | |||
| тепловые потери | 5087,77 | 2,75013 | |||
| Итого | Итого |
Невязка: 
Раскисление металла
Материал - ферромарганец Mn3 (C=6,00: Si=1.0: Mn=78.0: P=0.3: S=0.02: Fe=14.68).
Способ раскисления - в ковше
Определяем расход ферромарганца:

Задаемся [Mn]гот =0,45%
UMn =30%
и находим:

Определяем угар и усвоение ферромарганца:
Углерод
 ; окисляется
; окисляется 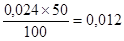
остается 0,012 где 50 % составляет количество углерода, выделившееся за время выпуска.
Кремний
 ; окисляется
; окисляется  остается 0. Принимаем что кремний окисляется полностью.
остается 0. Принимаем что кремний окисляется полностью.
Марганец
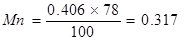 ; окисляется
; окисляется  остается 0,2219 где 30 % составляет количество марганца, окислившееся за время выпуска стали.
остается 0,2219 где 30 % составляет количество марганца, окислившееся за время выпуска стали.
Фосфор
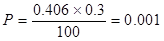 ; окисляется 0, т.е. весь фосфор остается в
; окисляется 0, т.е. весь фосфор остается в
металле.
Железо
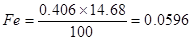 ; не окисляется, остается в металле.
; не окисляется, остается в металле.
Количество образовавшихся оксидов из ферромарганца.
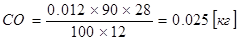 Sферокс =0,161кг
Sферокс =0,161кг
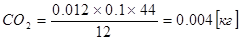 Sэлем.мфер =0,295кг
Sэлем.мфер =0,295кг
 Sэл.окфер =0,111кг
Sэл.окфер =0,111кг
 Sэлемфер =0,406кг
Sэлемфер =0,406кг
Количество кислорода из воздуха на окисление элементов ферромарганца:
qO2 = Sферокс -Sэл.окфер =0,161-0,111=0,05кг
2.18 Масса и состав металла после раскисления
Перед раскислением: qм =90,421кг
Вносится ферромарганцем: mFeMn =0,295кг
Готовой стали:
qмгот =90,421+0,295=90,716кг
Состав металла после раскисления, %: