1.Внимательно прочитать условие задачи.
2. Сделать краткую запись условий. Лучше все данные задачи сразу выразить в одинаковых величинах (СИ).
3. Написать уравнение или систему уравнений, отображающих происходящий физический процесс в общем виде.
4. Решить задачу в общем виде (получить "рабочую формулу"), т.е. выразить искомую величину через данные в задаче.
5.Произвести вычисления
6.Произвести проверку единиц величин, подставив их в "рабочую формулу"
Решение задач на построение графиков.
1.Изучить зависимость между величинами Р, V и Т.
2.Сделать запись зависимости для каждой линии графика.
3.Построить график.
Запомните: если вам дан на графике круговой процесс и надо построить этот процесс в иных координатных осях, то и на графиках, построенных вами, процесс тоже должен быть круговым, т. е. график тоже должен быть замкнут. Если на исходном графике изображен треугольник, то и на графиках построенного вами кругового процесса, каждая сторона которого соответствует одному из изопроцессов в газе неизменной массы, должен получиться тоже треугольник, за исключением построения графика в координатных осях Р-V, где изотерма имеет вид гиперболы.
Принято на графиках процессов в газах давление всегда откладывать по вертикальной оси (оси ординат), а температуру Т- по горизонтальной оси (оси абсцисс). Объем V в координатах Р –V откладывается по оси абсцисс, а координатах V-Т – по оси ординат.
Если масса газа неизменна, то продолжения графиков изобарного в координатах V- Т и изохорного в координатах Р-Т процессов непременно проходят через начало координат О.
Если на графиках в координатах V-Т и Р-Т продолжения отдельных участков изопроцесса в газе при постоянной массе не проходят через начало координат, а пересекают оси координат на некотором расстоянии от начала координат О, значит это не изопроцесс, т.е. при таком процессе изменялись все три параметра –Р,V и Т.
Примеры решения задач
Задача 1
Какое количество вещества содержится в алюминиевой отливке массой 5,4 кг?
Дано: СИ Решение
m (Al)=5,4 кг По таблице Менделеева определим
 -?
-?
 (Al)=27
(Al)=27 
Количества вещества найдем по формуле:
 ;
;  моль
моль
Ответ:200 моль.
Задача 2.
Какой объем занимает 100 моль ртути?
Дано: СИ Решение
 (Hg)=100 моль Объем ртути определим по формуле:
(Hg)=100 моль Объем ртути определим по формуле:
V-?
V= 
 (Hg)=13.6
(Hg)=13.6  10
10  Подставим m=
Подставим m= 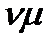
 (Hg)=201
(Hg)=201  в фор-лу(1) V=
в фор-лу(1) V= 
V=  =1,5 *10
=1,5 *10 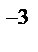 м
м 
Ответ;1,5*10 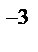 или 1,5 л.
или 1,5 л.
Задача 3.
Чему равно число молекул в 10 г. кислорода?
Дано: СИ Решение
m (O  )=10 г0,01кг Молярную массу кислорода найдем по таблице
)=10 г0,01кг Молярную массу кислорода найдем по таблице
N-? Менделеева.
 (O
(O  ) =32*10
) =32*10 
Количества вещества определим из формул:
 (1)
(1)  (2) =>
(2) => 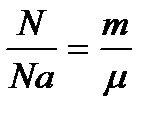
откуда выразим N; 
где Na=6.02*10  моль
моль  - постоянная Авогадро.N=
- постоянная Авогадро.N= 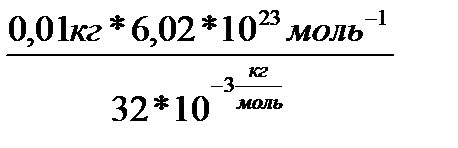 =1,88*10
=1,88*10 
Ответ: N=1,88*10 
Задача 4.
Какой объем занимают 2*103 молей идеального газа при температуре 270К и давлении 8*105 Па?
Дано: СИ Решение
ν =2*103 моль Согласно закону Клапейрона - Менделеева
Т = 270К РV =νRТ, откуда следует, что V = νRТ
Р = 8*105 Па Р
V -? V = 2*103 *8,31*270 =5,6 м3
8*105
Ответ: V =5,6 м3
Задача 5.
В озеро, имеющее среднюю глубину 10м и площадь поверхности 20 км  , бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см
, бросили кристаллик поваренной соли массой 0,01г. Сколько молекул этой соли оказалось бы в наперстке воды объемом 2 см  , зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
, зачерпнутой из озера, если полагать, что соль, растворившись, равномерно распределилась во всем объеме воды?
Решение
Дано: СИ
h=10м Чтобы найти число молекул N  необходимо
необходимо
S=20 км  2*10
2*10  определить объем озера V и количество N
определить объем озера V и количество N
m=0.01 г10  молекул соли находившихся в 0.01г
молекул соли находившихся в 0.01г
V  =2 см
=2 см  2*10
2*10  V=hS (1); N=
V=hS (1); N= 
Na=6.02*10  N= 6.02 *1023 *
N= 6.02 *1023 * 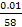 = 1*1020молекул.
= 1*1020молекул.
N  -? Молярная масса поваренной соли равна 58г/моль Объем воды в озере
-? Молярная масса поваренной соли равна 58г/моль Объем воды в озере
V=hS.V= 10*2*107 = 20*107 м3.
Определим, какую долю составляет объем наперстка V1 от всего объема воды в озере.
Для этого нужно V1/V = 2*10  /20*107 м3 =
/20*107 м3 =
1*10-14
Учитывая, что соль равномерна распределена в этом объеме можно найти значение N  .
.
N1=N*(V1/V) = 1*1020 *1*10-14 = 1*106
Ответ: N1=1*106
Задача 6.
В баллоне емкостью 0,1м3 содержится углекислый газ при температуре 303К и давлении 20*105Па. Привести объем газа к нормальным условиям и найти массу газа.
Дано: СИ Решение
V1 = 0,1М3 Согласно уравнению Клапейрона
T1 = 303K Р1V1/T1 = P2V2/T2
P1 = 20*105Па откуда выразим значение V2 = Р1V1T2/P2T1
P2 = 1*105Па V2=20*105Па * 0,1М3 *273K/1*105Па *303K =
T2 = 273К = 1,8М3
V2-? Молярная масса СО2 = 44*10-3 кг/моль.
m2-? Используем уравнение Менделеева – Клапейрона.
PV = mRT/M откуда выразим
m = P2V2M/RT2
m =1*105Па *1,8М3*44*10-3 кг/моль/8,31Дж/моль*к *273К
= 3,49 кг
Ответ: V2=1,8 М3 m =3,49 кг.
Задача 7.
При какой температуре 0,08 кг кислорода в баллоне емкостью 20л создают давление 3*105Па?
Дано: СИ Решение
m=0,08кг Согласно закону Клапейрона - Менделеева
V= 20л20*10-3м3 Р V =  , откуда следует, что T =
, откуда следует, что T = 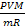
Р = 3*105 Па
M(O2) =32*10-3 кг/моль
T -? T = 3*105 *20*10-3*32*10-3 =289K
8*10-2*8,31
Ответ: 289K
Задача 8.
В баллоне емкостью 0,1м3 содержится углекислый газ при температуре 303К и давлении 20*105Па. Привести объем газа к нормальным условиям и найти массу газа.
Дано: СИ Решение
V1 = 0,1М3 Согласно уравнению Клапейрона
T1 = 303K Р1V1/T1 = P2V2/T2
P1 = 20*105Па откуда выразим значение V2 = Р1V1T2/P2T1
P2 = 1*105Па V2=20*105Па * 0,1М3 *273K/1*105Па *303K =
T2 = 273К = 1,8М3
V2-? Молярная масса СО2 = 44*10-3 кг/моль.
M2-? Используем уравнение Менделеева – Клапейрона.
PV = mRT/M откуда выразим
m = P2V2M/RT2
m =1*105Па *1,8М3*44*10-3 кг/моль/8,31Дж/моль*к *273К
= 3,49 кг.
Ответ: V2=1,8 М3
Задача 9.
По графику процесса, осуществленного с идеальным газом (рис1), постройте график этого процесса в координатных осях Р, Т и V, Т.Температура газа в начальном состоянии была равна 250К.
Р*105
ПА
1 1
0 1 2 3 V, м3
Рис1
Решение
График показывает, что давление газа при переходе из состояния 1 в состояние 2 увеличилось в три раза, а объем в течение всего процесса оставался неизменным. Следовательно, процесс изменения состояния газа был изохорным. При изохорном процессе связь между давлением газа Р и абсолютной температурой Т выражается уравнением:
 . Отсюда выразим Т2 =
. Отсюда выразим Т2 =  . Т2 =
. Т2 = 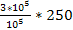 = 750 К
= 750 К
По известным начальным и конечным значения давления и температуры построим в системе координат с осями Р, Т точки 1 и 2, соответствующие начальному и конечному состояниям газа. Зависимость давления Р от температуры Т линейная, следовательно, график изохорного процесса в координатных осях Р, Т является прямой, проходящей через точки 1и 2 (рис2). В координатных осях V, Т график изохорного процесса – это отрезок прямой, параллельной оси абсцисс (рис 3).
Р*105,
ПА
3 2
1 1
0 250500750Т, К
Рис2
V, м3
3 1 2
0 250500750 Т,К
Рис3
Задача 10.
Один сосуд сферической формы радиусом R1 заполнен газом под давлением Р1, а в другом сосуде радиусом R2 – вакуум. Сосуды соединяют трубкой, объемом которой можно пренебречь. Какое давление Р2 установится в сосудах после соединения?
Дано Решение
R1 После того как сосуды соединили трубкой в них установится
Р1 одинаковое давление Р2. Температура не изменилась, следовательно
R2 процесс изотермический. Применяем закон Бойля-мариотта.
Т- const Р1V1 =Р2(V1 + V2) (1)
Р2 -? Здесь V1 =  – объем одного шара,
– объем одного шара,
V2=  – объем второго шара.
– объем второго шара.
Подставив в уравнение (1) выражения объемов сосудов через их радиусы, получим Р1*  = Р2(
= Р2(
Р1  = Р2(
= Р2(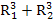 ). (2)
). (2)
Из уравнения (2) найдем давление Р2.
Р2= 
Ответ:Р2= 