В дробном анализе «металлических ядов» для маскировки мешающих ионов применяются цианиды, фториды, фосфаты, тиосульфаты, тиомочевина и другие вещества.
1. Цианиды. Применение цианидов для маскировки ионов основано на том, что с их помощью мешающие ионы можно перевести в комплексы:
[Со(СN)6]4-, [Fe(CN) ]4-, [Fe(CN)6]3-, [Ni(CN)6]4-, [Zn(CN)4]2-, [Cd(CN)4]2-, [Hg(CN)4]2-, [Ag(CN)2]-.
Образование цианидных комплексов меди происходит в 2 этпа. Вначале восстанавливаются ионы меди (II), а затем образуется комплексный ион:
CuS04 + 2KCN → Си (CN)2 + K2SO4;
2Си (СN)2 → 2CuCN + (CN)2;
CuCN + 3KCN → K3 [Си (CN)4].
2. Фториды. Фториды часто используются для маскировки ионов железа (III), с которыми они образуют бесцветные устойчивые комплексные ионы [FeF6]3-.
3. Фосфаты. В дробном анализе фосфаты также применяются для маскировки ионов железа (III). В кислой среде фосфаты и фосфорная кислота с ионами железа образуют бесцветные комплексы [Ре(Р04)2]3-.
4. Тиосульфаты. Тиосульфаты применяются для маскировки ионов серебра, свинца, железа (III), меди и других катионов. При взаимодействии тиосульфатов с перечисленными ионами образуются комплексы: [Ag2(S203)3]4-, [Pb(S2O3)3]-4, [Fe(S2O3)2]-.
Реакция ионов меди с тиосульфатом происходит в 2 этапа. В начале тиосульфаты восстанавливают ионы меди (II), а затем образуются комплексы:
CuSO4 + NaaS2O3 → CuS2O3 + Na2SO4;
4CuS2O3 → 2Cu2S2Oa + S4O62-;
Cu2S203 + Na2S203 → Na2 [Cu2 (SaO3)2].
5. Гидроксиламин. Маскирующее действие гидроксиламина основано на том, что с одними ионами он образует комплексы, а с другимивступает в реакции окисления-восстановления.
С ионами кобальта гидроксиламин образует комплекс [Co(NH2ОН)6]2+. В зависимости от природы ионов, с которыми реагирует гидроксиламин, он может быть окислителем и восстановителем. Гидроксиламин восстанавливает ионы железа (III) и окисляет ионы AsO2- и SbO2-:
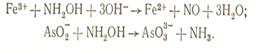
Для связывания избытка гидроксиламина применяют формальдегид, с которым он образует формальдоксим:
NH2OH + НСНО → CH2=N— ОН + Н2О.
6. Тиомочевина. В дробном анализе тиомочевина используется для маскировки ионов висмута, железа (III), сурьмы (III), кадмия, ртути, серебра и других катионов. С указанными ионами тиомочевина образует прочные внутрикомплексные соединения.
7. Глицерин. С катионами висмута, свинца, кадмия и другими глицерин образует глицераты:
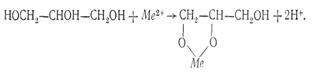
С некоторыми ионами глицерин дает окрашенные соединения. Образование этих соединений используется в анализе для идентификации ионов.
8. Комплексов III (трилон Б) широко применяется в количественном анализе. Однако этот реактив довольно часто используется и для маскировки ионов кадмия, кобальта, меди, железа, марганца, свинца, цинка, магния и др. При взаимодействии комплексона III с указанными ионами образуются прочные внутрикомплексные соединения.
Комплексен III с ионами металлов независимо от их валентности реагирует в соотношении 1: 1. При взаимодействии комплексона III с ионами металлов образуются внутрикомплексные соединения за счет замещения атомов водорода в карбоксильных группах комплексона и за счет образования координационных связей между ионами металлов и атомами азота аминогрупп. Строение внутрикомплексных соединений двух- и трехвалентных металлов с комплексоном III можно представить следующими формулами:

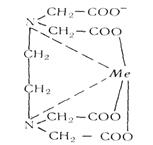

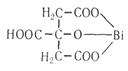
8. Лимонная кислота и ее соли (цитраты) с катионами ряда металлов дают прочные соединения, строение которых можно выразить следующими формулами:
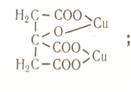
|

В дробном анализе лимонная кислота используется для маскировки ионов висмута, меди, железа (III), сурьмы (III), кадмия, ртути, серебра и некоторых других.
10. Винная кислота и ее соли (тартраты) с многими металлами образуют прочные растворимые в воде комплексы:
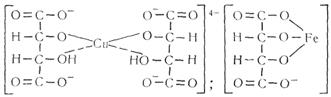
Способность винной кислоты образовывать прочные комплексные соединения с металлами используется для маскировки ионов меди, железа (III), алюминия, висмута, кадмия, ртути, свинца, цинка и др.
11. Аскорбиновая кислота. Применение аскорбиновой кислоты как маскирующего средства в основном базируется на восстановительных свойствах этой кислоты. При взаимодействии лскорбиновой кислоты с сильными окислителями она переходит и щавелевую или треоновую кислоту, а при взаимодействии с окислителями средней силы аскорбиновая кислота превращается в дегидроаскорбиновую кислоту:
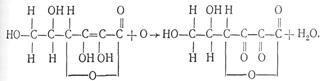
Восстанавливающие свойства аскорбиновой кислоты используются в анализе для маскировки ионов железа (III), олова (IV) и др.
Литература
1. Токсикологическая химия: метаболизм и анализ токсикантов: учебное пособие + СD/ под ред. Н.И. Калетиной. – М., 2008. – 1016 с. Переплет.
2. Токсикологическая химия: учебник / под ред. Т.В. Плетеневой. – 2-ое изд. – М., 2008. – 512 с. Переплет.
3. Крамаренко В. Ф. Токсикологическая химия / В. Ф. Крамаренко. - Киев, «Высшая школа», 1989.- 272 с.
4. Швайкова М.Д. Токсикологическая химия/ М.Д. Швайкова. - М., «Медицина», 1975.-376 с.
6. Контрольные вопросы (обратная связь)
1. Дробный метод анализа «металлических ядов», его сущность.
2. Методология проведения дробного метода анализа
3. Какие органические реагенты используются в дробном анализе «металлических ядов».
4. Методы количественного определения «металлических» ядов.
Кредит №7
1. Тема 1 – Группа веществ, изолируемых дистилляцией. Общая характеристика группы. Методы изолирования. Методология общего ненаправленного анализа дистиллятов на «летучие яды» (аналитический скрининг).
2. Цель: Ознакомить студентов с методами изолирования и направленным ХТА «летучих ядов», чтобы студенты знали и могли применить их в своей практической деятельности.
Тезисы лекции
К группе веществ, изолируемых из биологического материала путем перегонки с водяным паром, относятся отдельные: спирты алифатического ряда, альдегиды, кетоны, органические кислоты, сложные эфиры алифатического ряда, галогенопроизводные углеводородов, фенолы, синильная кислота, белый фосфор, фосфин и др.
Методом перегонки с водяным паром изолируют вещества:
- труднорастворимые или практически нерастворимые в воде,
- а также вещества, имеющие высокие температуры кипения
- или разлагающиеся при собственной температуре кипения.
Смесь начинает кипеть тогда, когда при данной температуре сумма давлений насыщенных паров ее компонентов станет немного больше внешнего (атмосферного) давления. Как вы знаете, при нагревании смеси, состоящей из взаимнонерастворимых веществ, каждый компонент смеси увеличивает упругость своих паров независимо от другого. Поэтому точка кипения смеси не смешивающихся друг с другом жидкостей всегда будет ниже точек кипения обоих ее компонентов, т.к. общее давление паров смеси всегда большее, чем парциальное давление каждой отдельно взятой жидкости.
Различают следующие виды перегонки с водяным паром:
1. простая или дифференциальная перегонка – это такой вид перегонки, когда образовавшийся пар отводится в холодильник и конденсируется. В равновесии с жидкой фазой в перегонном аппарате находится только часть образовавшегося пара.
2. фракционная или дробная перегонка веществ, содержащихся в дистиллятах.
Иногда дистилляты подвергают фракционной перегонке, т.к.
- после простой перегонки с водяным паром концентрация ядовитых веществ в дистиллятах может быть незначительной, находящейся за пределами их обнаружения;
- а также потому, что с водяным паром могут перегоняться летучие примеси, являющиеся продуктами гнилостного разложения биоматериала, которые могут давать некоторые реакции, применяемые для обнаружения «летучих» ядов.
Для фракционной перегонки отбирают и повторно перегоняют отдельные фракции дистиллята и оставшуюся неперегнанную жидкость. С помощью фракционной перегонки можно разделить смеси веществ на отдельные компоненты или на небольшие группы компонентов, имеющие близкие температуры кипения. После фракционной перегонки получают более кон-центрированные растворы соответствующих веществ, чем в дистилляте, подвергающемся этой перегонке. Объединение последовательных испарений и конденсаций в непрерывный процесс называется ректификацией. Проводится она в ректификационной колонке.
В ХТ и судебно-химическом анализах метод фракционной перегонки применяется для:
- выделения из смесей некоторых веществ,
- а так же для очистки
- и концентрирования этих веществ.
3. перегонка в равновесии или азеотропная – когда процесс перегонки проводится без отвода пара при постоянном составе системы.
Состав азеотропной смеси раствора совпадает с составом пара, находящегося с ней в равновесии. Поэтому азеотропные смеси перегоняются при постоянной температуре, а следовательно, они не могут быть разделены на компоненты обычной или фракционной перегонкой.
Разделение азеотропных смесей можно улучшить путем перегонки при пониженном или повышенном давлении.
Например, в случае перегонки этилового спирта с водяным паром. При перегонке этилового спирта при атмосферном давлении образуется азеотропная смесь, кипящая при 78,17 °С, в которой содержится 96% этанола. Если понизить давление до 100 мм, то содержание этанола в азеотропной смеси увеличится до 99,66%, а температура кипения понизится до 34,2 °С.
Азеотропные смеси можно разделить и химическими методами. Например, если к 96% этанолу прибавить металлический натрий, который взаимодействует с водой, содержащейся в указанном этиловом спирте. После перегонки полученной жидкости отгоняется абсолютный этиловый спирт.
При добавлении бензола к азеотропной смеси спирта и воды образуется двухслойная смесь, кипящая при 64,9 °С и атмосферном давлении. При этом отгоняется бензол и вода, а в остатке получается абсолютный этиловый спирт.
Объектами ХТА на наличие «летучих» ядов могут быть:
- органы трупов – желудок с содержимым, кишечник с содержимым и др.
- различные жидкости и эмульсии.
Значительное количество летучих токсикантов легко перегоняются с водяным паром, за
исключением веществ, имеющих высокую температуру кипения и не образующих с водой
азеотропных смесей: этиленгликоль - Ткип 197,4 °С; уксусная кислота - Ткип 118,5 °С, тетра-
этилсвинец — Ткип 195 °С и другие. Для изолирования летучих токсичных веществ традиционно применяют различные типы дистилляции (перегонки).
• Метод перегонки с водяным паром.
• Микроотгонка — еще один способ подготовки пробы для проведении газохроматографического определения. Количество объекта 5 г. Собирается 2 мл дистиллята.
• Перегонка с водяным паром с одновременной продувкой азотом — частный метод, который
используется для изолирования из биообразцов синильной кислоты и ее солей,
которые согласно принятой в токсикологической химии классификации относят к группе летучих ядов. Проводится в приборе для перегонки с водяным паром. В пробке, которая закрывает перегонную колбу, делают дополнительное отверстие для подачи тока азота. Дистиллят собирают в приемник, содержащий 5 мл 0,1 н. гидроксида натрия. Указанным способом изолируются до 62,90—88,05% синильной кислоты при содержании 50—1000 мкг в 100 г органа. Изолирование можно проводить как из свежего, так и из загнившего трупного материала.
• Дистилляция (простая перегонка) используется для веществ с низкой температурой кипения: ацетона, этанола, метанола и др. Недостатком метода является неполная отгонка анализируемых веществ.
• Азеотропная перегонка. При азеотропной перегонке температура кипения азеотропной смеси ниже, чем температура кипения самого низкокипящего компонента.
• Экстракционный метод применяется при изолировании некоторых высококипящих летучих ядов. Так, при исследовании свежего трупного материала используется экстракция этиленгликоля бензолом из печени и желудка с содержимым.
• Метод микродиффузии. Модифицированные камеры Конвея используют для изолирования
синильной кислоты. Дистиллят собирают в 2 мл 0,1 н. гидроксида натрия, который
помещают в центральное углубление модифицированной камеры Конвея (внутренняя камера). Диаметр внутренней камеры 3 см, диаметр внешней камеры 6 см. Во внешнюю
камеру добавляют 4 мл крови или мочи, 2 мл 10% раствора серной или винной кислоты и
тщательно перемешивают. Камеру закрывают завинчивающейся крышкой, помещают на
1 ч в термостат (50 °С). После охлаждения из центрального углубления камеры отбирают
1 мл жидкости для количественного определения синильной кислоты. Оставшуюся жид
кость исследуют химическим методом. При содержании 50—1000 мкг синильной кислоты в
100 мл крови определяется 86,00—98,10%, в моче - 92,80—99,10%.
Схема скрининга на летучие токсичные вещества, подлежащие судебно-химическому исследованию в лабораториях ЦСМ регламентируется Перечнем (см. выше). При проведении ХТА используют и газохроматографический и химический методы, однако последний малоспецифичен и в настоящее время применяется редко.
Скрининг методом газо-жидкостной хроматографии (ГЖХ) проводится на двух колонках с неподвижными жидкими фазами различной полярности по относительному времени удерживания или индексам удерживания Ковача. Подтверждающие исследования проводят методом ГХ-МС или используют качественные химические реакции, иногда - дополнительные 1- 2 хроматографические колонки.
Один из первых примеров применения в ХТА газовой хроматографии в России — идентификация и количественное определение спиртов С1—С5 (после дериватизации в алкилнитри-ты), дихлороэтана и ацетона на отечественных газовых хроматографах (ХЛ, ЛХМ) с детектором по теплопроводности.
Скрининг летучих токсикантов проводят газохроматографическим методом по унифицированной методике, которая основана на применении фазовых равновесий летучих веществ вне хроматографической колонки — анализа равновесной паровой фазы. При исследовании биообразца на содержание многокомпонентных смесей органических растворителей, бензин, керосин проводят идентификацию по их основным компонентам путем наложения (сравнения) хроматограмм исследуемых объектов и стандартов.
Иллюстративный материал
Таблица 1.
Границы обнаружения хлорорганических и ароматических углеводородов в биоматериале
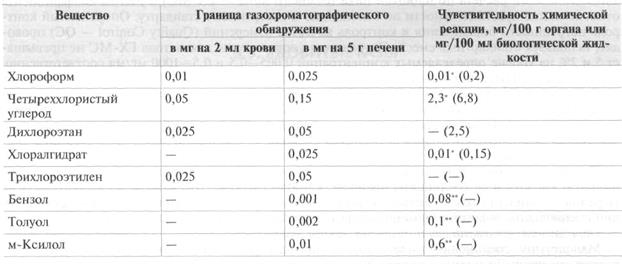
* Чувствительность реакции образования изонитрила (в скобках - чувствительность реакции замещения хлорида).
** Чувствительность реакции нитрования ароматических соединений (определена при экспериментальном исследовании).
Литература
1. Калетина Н.И. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2008.
2. Плетенева Т.В. Токсикологическая химия. – М.: ГЭОТАР-Медиа, 2006.
3. Крамаренко В.Ф. Токсикологическая химия. – Киев: Высшая школа, 1989.
6. Контрольные вопросы (обратная связь)
1. Какими свойствами обладают вещества, изолируемые из биологического материала методом перегонки с водяным паром?
2. Объясните, когда закипает жидкость?
3. Перечислите виды перегонки с водяным паром и охарактеризуйте их.
4. Приведите примеры способов разделения азеотропных смесей.
5. Какие методы используют при проведении ХТА скрининга?
6. Как проводится скрининг методом ГЖХ?
1. Тема 2 – Химический метод анализа «летучих ядов».
2. Цель: Ознакомить студентов с схемой исследования «летучих ядов» химическим методом, чтобы студенты знали и могли применить его в своей практической деятельности.
Тезисы лекции