О.В. Мосин
ВОДА – ГЛАВНЫЙ ПРИРОДНЫЙ РЕСУРС
Проблемы, возникающие в связи с развитием техники и нарушением природного равновесия объединяются под общим названием “загрязнение окружающей среды”. В последнее время человечеству становится всё более очевидной актуальность таких проблем, и в разных странах создаются государственные и частные организации для их исследования и решения.
Решение проблем загрязнения окружающей среды – комплексная проблема. Может показаться, что устранить каждую конкретную причину загрязнения очень просто—достаточно ликвидировать его источник; однако подобные действия могли бы серьезно повлиять на социальное или экономическое благополучие отдельного региона или даже целой страны. Например, одна из основных причин загрязнения морей и океанов в современном обществе является прямым результатом потребления огромных количеств нефти; однако было бы в высшей степени неудобно и сопряжено с чудовищными экономическими последствиями для современного образа жизни полностью прекратить добычу нефти. При решении проблем загрязнения воды нужно принимать во внимание множество различных факторов, и не последним из их числа является приемлемость каждого такого решения для тех людей, которых оно затрагивает. Вместе с тем применение подходящих химических и физических принципов очистки воды позволяет эффективно уничтожать многие отходы, при этом извлекая из них полезные вещества и повторно используя последние.
В странах и регионах, где много пресной воды, люди мало заботятся о ее сохранении и экономном использовании. Однако человечество быстро приближаемся к ощутимой нехватке пресной воды, особенно в больших городах, и это приводит к необходимости экономного расходования и повторного использования воды. Так, например, вода Рейна, который служит одной из важнейших транспортных артерий в Центральной Европе, используется до 30 раз, прежде чем она достигает берегов Северного моря. Это означает, что города и промышленные предприятия, расположенные по берегам Рейна и пользующиеся его водой, должны очищать использованную воду, прежде чем сбрасывать ее снова в реку.
По имеющимся оценкам учёных, на земную сушу ежегодно выпадает около 120000 км3 пресной воды в виде дождя и снега. Из этого количества 32000 км3 воды стекает по земле в ручьи, реки и далее в океаны. Большая часть остальной воды испаряется или остается в растительном или животном мире. В США для ежедневных нужд используется примерно 3600 миллиардов литров воды. В 1900 г. использовалось только 160 миллиардов литров пресной воды; в 1960 г. эта цифра превысила 1200 миллиардов, а по оценкам на 2000 г. она достигла 3500 миллиардов литров в день. Таким образом, США уже стоят перед проблемой повторного использования пресной воды.
В природных условиях проблема очистrи загрязненной воды просто, и решается в результате дистилляции. Хотя вода—прекрасный растворитель и уносит с земли в океаны ил и взвешенные вещества, простые процессы испарения и конденсации удаляют из нее все, кроме растворенных газов. В результате природа создает огромные количества пресной воды даже из самых загрязненных вод. На испарение моля воды при 20 С расходуется энергия, равная 10,42 ккал. Эта энергия поставляется солнцем. Она возвращается в атмосферу при конденсации водяного пара в жидкую воду. Однако эти две стадии естественного процесса дистилляции воды обычно происходят не в одном месте, так как скорость испарения максимальна в зонах земли с наиболее теплым климатом, т. е. в тропиках. Конденсация водяного пара протекает тогда, когда с теплым, насыщенным влагой воздухом соприкасается холодный воздух. В целом круговорот воды в природе приводит к охлаждению тропических зон и нагреванию умеренных зон. Если бы на земле не было воды или другого вещества, обладающего столь же высокой эффективностью в качестве теплоносителя, экваториальные области оказались бы перегретыми, а полярные области— сильно переохлажденными. Это было бы неудобно для тех форм жизни, которые распространены на Земле. Очистка воды происходит также в результате ее последовательного замерзания и оттаивания, что создает такие источники пресной воды, как айсберги.
Таким образом, благодаря круговороту воды в природе человек получает пресную воду в качестве одного из важнейших природных ресурсов. Используя воду, мы загрязняем ее различными веществами, так что ее нельзя повторно применять без предварительной очистки. Если наши потребности в воде превышают природные ресурсы чистой воды, приходится повышать эти ресурсы искусственным путем.
ВИДЫЗАГРЯЗНЕНИЙ ВОДЫИ ИХ КОНТРОЛЬ
Вода обладает уникальными свойствами как растворитель и дисперсионная среда. Поэтому многие вещества, случайно попавшие или намеренно введенные в нее, могут рассматриваться как загрязнения воды. По реакциям с растворенным в воде кислородом все загрязнения воды разделяются на два типа (табл. 1).
Таблица 1. Типы загрязнений воды (по данным службы здравоохранения США)
| Вещества, для окисления которых необходим кислород | |
| Возбудители инфекций | Бактерии и вирусы (сточные воды, отходы животного происхождения) |
| Питательные вещества для растений | Нитраты и фосфаты (удобрения для растений, промышленные отходы |
| Органические соединения | Детергенты, инсектициды, гербициды, сточные воды |
| Другие типы загрязнений воды | |
| Минералы и химикаты | Кислоты, основания и соли (шахтные воды, неорганические промышленные отходы |
| Осадки | Ил (продукты эрозии почвы) |
| Радиоактивные вещества | Радиоактивные изотопы (получаемые в процессе добычи или приготовления радиоактивных веществ) |
| Тепловое загрязнение | Теплосброс (остывающая вода из паровых турбин электростанций) |
Существование в воде важнейших природных организмов зависит от количества растворенного в ней кислорода. Это количество изменяется от 15 млн –1 (миллионные доли) при 0°С до 9 млн –1 при 20°С. В обычных условиях растительная и животная жизнь в воде возможна лишь при достаточном количестве растворенного в ней кислорода. Такие организмы, как фитопланктон, морские водоросли и бактерии, не могут существовать без растворенного в воде кислорода, но наибольшее его количество необходимо для существования рыбы. Отходы, для разложения которых требуется кислород, при сбрасывании в естественные водоемы окисляются растворенным в них кислородом, что приводит к резкому увеличению его расхода. Основываясь на простейшей окислительной реакции превращения углерода в СО2.
С + О2 -> СО2,
можно подсчитать, что для окисления 1 г углерода требуется 1,67 г О2, т.е. весь кислород, содержащийся в 300 л воды при 20 °С. Многотоннажный сброс необработанных канализационных отходов в естественные водные источники (ручьи или реки) приводит к снижению количества растворенного в них кислорода до уровня, недостаточного для поддержания жизни в воде.
Количество кислорода, необходимое для окисления содержащихся в воде окисляемых веществ, называется биохимической потребностью в кислороде (БПК). Экспериментально этот показатель определяют следующим образом: образец воды выдерживают в течение 5 сут при 20"С и измеряют количество растворенного в ней кислорода до и после этого периода. Самые низкие значения ВПК имеют чистейшие природные источники воды; чем больше содержание в воде окисляемых загрязнений, тем больше соответствующее значение БПК. В табл. 2 приведены значения БПК для некоторых типичных образцов воды.
Таблица 2. Биохимическая потребность в кислороде (БПК) для различных образцов воды
| Вода | БПК, млн-1 |
| Чистая из горных ручьёв | <1 |
| Пригодная для питья | <5 |
| Сбрасываемая в реки (допустимый предел) | 20 |
| Канализационная (в городе) | 100-500 |
| С животноводческих ферм | 100-10000 |
| Направляемая на поля орошения | 100-10000 |
При высоких значениях БПК, которые соответствуют полному исчерпанию кислорода в воде, существующие в ней аэробные бактерии (жизнедеятельность которых невозможна без кислорода) уступают место анаэробным бактериям (не требующим кислорода). В результате продукты окислительных реакций — СО2, H2SO4, Н3РО4 и HNO3 — сменяются продуктами восстановительных реакций — СН4, H2S, PH3 и NH3. Поэтому вода с высоким показателем БПК, например в гаванях и перегруженных сточными водами реках, имеет неприятный запах.
Если в загрязнениях, попадающих в воду, содержатся питательные вещества для растений, особенно нитраты и фосфаты, рост водных растений, которым необходим кислород, значительно усиливается. В подобных условиях обычно происходит разрастание водорослей и БПК повышается. Принято обозначать, что в системах, перегруженных загрязнениями такого типа, происходит эутрофикация, т.е. они насыщаются питательными веществами. Постепенно озеро или пруд, подвергающиеся эутрофикации, плотно заселяются растениями и животными, в них накапливаются органические отложения, водоем мельчает и может превратиться в болото или зарасти лесом. Такое перерождение водоемов сильно ускоряется, если в них продолжают поступать питательные вещества. Поэтому необходимо заботиться о том, чтобы фосфаты и другие питательные вещества не накапливались в судоходных реках.
Фосфаты попадают в естественные водоемы по вине человека, в основном в составе сельскохозяйственных удобрений и детергентов. Фосфаты — незаменимые для растений питательные вещества, без которых не может обойтись сельское хозяйство. Однако они усваиваются растениями только в определенное время года и в ограниченных количествах. Внесение фосфатных удобрений в периоды медленного роста растений может приводить к их смыванию в реки. Избыточное количество фосфатов нередко вносят в почву фермеры и производители сельхозпродукции, желающие повысить урожайность сельскохозяйственных культур.
Детергенты содержат до 40% метафосфатов, так как они обладают способностью умягчать воду, образуя комплексы с ионами Са2+, Mg2+ и другими многозарядными катионами. Кроме того, фосфаты гидролизуются, образуя основные растворы, что усиливает моющее действие мыла или смачивателей, которые входят в состав детергента. Чаще всего для приготовления детергентов используется полимерный трифосфат пентанатрия Na5P3O10, содержащий ион

При рН = 7 и обычных температурах полифосфатный ион медленно гидролизуется; период его полуразложения составляет около одного года. Однако при низких рН он гидролизуется в течение нескольких часов. Гидролиз протекает по уравнению
Р30105+ Н20 -> НРО42+ НР2073-
Уничтожение инфекционных бактерий и вирусов в канализационных водах, даже если они довольно чисты в других отношениях и характеризуются невысоким показателем БПК, эффективно осуществляется путем добавления хлора. Между С12 и водой происходит реакция диспропорционирования с образованием хлорноватистой кислоты
С12 + Н2О -> НОС1 + Сl+ Н +
К = 4,7.10-4.
НОСl представляет собой слабую кислоту (Кa=3.10-8), которая медленно разлагается, выделяя кислород
2НОС1 -> 2Н+ + 2Сl + О2.
Окислительный потенциал НОС1 еще больше, чем даже у перманганата калия, и это объясняет ее способность реагировать с бактериями и вирусами, лишая их опасных свойств. В канализационные воды добавляется от 2 до 5 млн –1 С12 в зависимости от степени их загрязнения. По той же причине в воду плавательных бассейнов также добавляют С12.
Загрязнения воды тех типов, которые указаны в табл. 1, особенно минералами, химикатами, осаждающимися веществами, радиактивными изотопами, а также термическое загрязнение заставляют задуматься над таким вопросом: следует ли заниматься удалением загрязнений после того, как они уже попали в водную систему, или же рациональнее предотвращать их попадание туда? Оказывается, что легче предотвратить или по крайней мере ограничить попадание загрязнений в водную систему. Контролировать просачивание в водные системы кислотных шахтных вод довольно трудно, но установлено, что сточные воды многих промышленных предприятий, содержащие химикаты и осаждающиеся вещества, экономически выгоднее утилизировать, а не сбрасывать в ручьи и реки. Например, в пищевой промышленности промывание картофеля и других корнеплодов приводит к значительному насыщению воды осаждающимися веществами. Однако вместо того, чтобы сбрасывать такую воду в природные источники, ее можно отстаивать и осаждающиеся вещества применять как почву для выращивания сельскохозяйственных растений, а очищенную воду использовать повторно. Когда на следующей стадии технологического процесса очищенный и нарезанный картофель снова промывается водой, в нее переходит значительное количество углеводов в виде крахмала. Этот крахмал можно превращать в глюкозу и использовать в качестве пищи, либо добавлять его в промывные воды, чтобы предотвратить экстракцию из картофеля в воду растворимых в ней веществ. Описанный прием представляет собой пример практического применения законов осмоса, так как удаление из картофеля растворимых веществ предотвращается при промывании его водой, в которой содержится приблизительно такое же количество растворенных веществ, как и в самом картофеле.
Круговорот воды в природе приводит к тому, что во время пребывания в атмосфере она становится радиоактивной. В результате захват нейтронов протонами в атмосфере образуется тритий, или водород-3; он выделяется также при ядерной реакции азота под воздействием космических лучей.
Тритий входит в молекулы воды как обычный водород, и поэтому вода, конденсирующаяся из нee паров в атмосфере, т. е. дождь или снег, обладает несколько большей радиоактивностью по сравнению с водой, выпавшей из атмосферы уже давно. Период полураспада трития равен 12,26 года, и, зная это, можно по данным об относительной интенсивности радиоактивного излучения ледников, снежных полей и даже воды, содержащейся в винах, определить, как давно пролежал лед на склоне горы или сколько лет простояло вино в винном погребе.
Другой опасный загрязнитель воды – ртуть. Известны факты отравления ртутью рыб, птиц и людей из-за высокой концентрации ртути в окружающей среде. Ртуть чрезвычайно распространена в природе, ее содержание в морской воде достигает 0,1 млрд -1 (миллиардной доли). Это объясняется вулканической активностью земли и выщелачиванием земной коры, а также накоплением ртути в процессе поедания мелких организмов более крупными.
Случаи отравления ртутью в отдельных районах возникают в результате того, что естественно протекающие в природных условиях процессы приводят к накоплению ртути, содержащейся в невысокой концентрации в промышленных сточных водах; ранее те же осложнения вызывало использование органических соединений ртути в сельском хозяйстве для борьбы с грибковыми заболеваниями растений. Известен случай, когда завод, на котором получали едкий натр путем электролиза соляного раствора допускал утечку ртути со сточными водами, концентрация ртути в которых составляла 0,1 млн -1. Технологический процесс включает электролитическую реакцию
2NaCl + 2Н2О -> 2NaOH + Н2 + С12
с использованием ртутного электрода. Хотя концентрация ртути в сточных водах была невелика, песок и ил в реке ниже по течению сразу же за заводом содержали 650 млн -1 ртути, а в шести километрах от него — 50 млн -1. Под воздействием бактерий элементная ртуть и содержащие ее неорганические соединения превращаются в метилртуть, которая растворима в жирах и в таком виде может последовательно накапливаться в поедающих друг друга все более крупных организмах, пока не попадает в пищу рыбы и человека.
Также опасно тепловое загрязнение воды при работе тепловых электростанций. В некоторых случаях оно может ускорять развитие водных форм жизни, а иногда приводит к тому, что рост рыбы опережает ее обеспеченность пищей. Установлено, что повышение температуры водного источника на 4°С в течение шести лет в экспериментальных условиях не влияет на экологию исследуемой водной системы. Однако, сбрасывая тепло в водные источники и реки, мы попусту расходуем энергию. Было бы намного разумнее использовать эту энергию для отопления жилищ и предприятий, как это и делается в отдельных случаях.
Степень вредности отходов в воде различна. Некоторые из отходов, попадаемые в воду действительно очень вредны, другие менее вредны. В табл. 3 приведены допустимые пределы загрязнения воды различными веществами по рекомендациям службы здравоохранения США (за 1992 г.).
Таблица3. Допустимые пределы загрязнения воды различными веществами
| Загрязнение | Концентрация, млн-1 (мг/л) | Эффект, вызываемый загрязнением |
| Мышьяк | 0,01 | Накапливаясь в организме, оказывает обшее токсическое действие |
| Медь | 1,0 | В высоких концентрациях нарушает функцию печени. Является необходимым для организма элементом (1 мг в сутки). Используется для ограничения роста водорослей |
| Свинец | 0,05 | Накапливаясь в организме оказывает общее токсическое действие; подавляет функцию костного мозга |
| Цинк | 5 | Является необходимым для организма элементом. |
| Цианиды | 0,01 | Вызывает отравление со смертельным исходом при концентрации 1 млн -1 |
| Фтор | 0,7-1,2 | Используется для профилактики кариеса зубов. При концентрации свыше 1,2 млн-1 разрушает зубную эмаль. |
| Нитраты | 40 | Вызывает заболевание крови (метгемоглобинемию) у детей |
Очистка сточных вод включает три последовательные стадии. Первичная очистка по существу представляет собой отфильтровывание твердых примесей, песка и ила и хлорирование воды для обезвреживания находящихся в ней инфекционных бактерий.
Вторичная очистка включает медленную фильтрацию либо аэрацию. На стадии медленного фильтрования сточные воды просачиваются через слой гравия, в котором находятся бактерии, разлагающие 75% содержащихся в воде органических веществ. При аэробной биологической очистке сточные воды обезвреживают, пропуская их сквозь слой бактерий, окисляющих и минерализующих органические вещества, а затем обогащают воздухом и дают отстояться, чтобы удалить осаждающиеся примеси. Этот метод обладает 90%-ной эффективностью.
Третичная очистка воды связана с удалением из нее растворимых ионных веществ и остатков органических веществ, не извлеченных при вторичной очистке. Третичная очистка проводится не всегда одинаково, а зависит от конкретного характера сточных вод. В некоторых случаях для её проведения используются фильтры из активированного древесного угля, в других случаях для осаждения фосфат-иона PO43проводится обработка воды гидроксидом кальция Са(ОН)2. Возможно также применение электродиализа, хотя этот метод сопряжен с большими расходами.
ПОЛУЧЕНИЕ ПРЕСНОЙ ВОДЫИЗ МОРСКОЙ ВОДЫ
По мере того как возрастает заселенность районов вблизи морских берегов, увеличивается потребность в опреснении морской воды. Это делает экономически оправданным превращение океанической воды в пресную воду. Рассмотрим несколько способов опреснения морской воды, перечисляя их в порядке повышения стоимости.
В тех случаях, когда имеются неограниченные источники природного тепла, используются методы дистилляции. В тропических зонах солнечным теплом нагревают воду в мелких лотках (парниковый эффект), после чего происходит конденсация водяного пара. Идеальное место для размещения подобных установок—прибрежные тропические районы, соседствующие с засушливыми землями, которым предельно необходима вода. Конструкция опреснительных установок должна быть хорошо продумана, с тем чтобы в ней предусматривалось вторичное использование тепла, выделяющегося при конденсации паров. Стоимость опреснения морской воды по методу дистилляции не превышает 1 доллара за 4000 л.
В полярных районах происходит естественное замерзание морской воды, и образующийся лед может служить источником пресной воды, если буксировать ледяные поля или ледниковые айсберги в более теплые климатические зоны. При расплавлении льда и отделении талой воды от морской можно получать пресную воду, по существу, по цене буксировки.
Другой способ получения пресной воды, основанный на замораживании морской воды, заключается в том, что ее распыляют в вакуумных камерах. Техника вакуумного охлаждения, уже используемая в пищевой промышленности, позволяет охлаждать воду ниже температуры замерзания, в результате чего образуется смесь кристаллов льда в рассоле. После отделения льда его подвергают повторной перекристаллизации до тех пор, пока не будет достигнут необходимый уровень чистоты. На таком принципе работают заводы, дающие 1 млн. литров пресной воды в день.
Для опреснения морской воды успешно используется также ионный обмен, сущность которого поясняется с помощью рис. 1. В жёсткой воде содержатся растворённые ионы кальция Ca2+, которые переводят в осадок анионы мыла и образуют многие нерастворимые соли, что приводит к появлению нерастворимого белого осадка на стенках котлов и сосудов. Процесс умягчения воды заключается в удалении из ней подобных кальцию катионов. Если обозначить символом Rнерастворимый катионообменник, то, когда он насыщен ионами натрия Na+, его условно можно описать формулой Na+R-. Тогда реакция обмена с раствором, содержащим ионы кальция Ca+, описывается следующим уравнением:
R+ Ca2+ -> Ca2+(R-)2 + 2Na +.
Жесткая вода умягчается в результате замещения ионов Са2 + ионами Na +, неспособными осаждать анионы мыла.
Если требуется удалить из воды все содержащиеся в ней ионные частицы, используется комбинированный анионокатионообменник. В этом случае катионообменник предварительно заряжается ионами Н+, а анионообменник заряжается ионами ОН-. В результате обмена с этими ионами все катионы и анионы удаляются из воды. Этот процесс можно проиллюстрировать на примере раствора хлорида натрия
Na+ + Сl + H+R-> Na+R+ Н+ + СlH++Cl+ R+OH-> R+Cl+H20
Пропущенная через ионообменник жидкость — элюат — оказывается деионизованной. На рис. 1 изображена схема установки для деионизации воды.
Рис.1. Схема действия ионообменного устройства для умягчения воды.
Стоимость процесса определяется в основном расходом механической энергии на прокачивание воды через ионообменники. Основные затраты этого метода сопряжены с первоначальными капиталовложениями на приобретение ионообменных материалов, которые представляют собой синтетические полимерные смолы, а также с затратами на химикаты, необходимые для перезарядки ионообменников.
Появление высококачественных полупроницаемых мембран привлекло большое внимание к технологии опреснения морской воды, основанной на обратном осмосе. При обычном осмосе давление на мембрану действует в направлении от разбавленного раствора к более концентрированному. Если прилагать достаточное давление в противоположном направлении, растворитель выталкивается через мембрану, оставляя на ней растворённон вещество (см. рис.2). Осмотическое давление морской воды относительно пресной воды составляет 22 атм.; следовательно, для осуществления обратного осмоса необходимо приложить к морской воде давление, превыщающее эту величину. Стоимость получения пресной воды этим способом составляет всего 1 доллар за 16000 литров воды, что делает метод обратного осмоса конкурентноспособным с другими способами получения пресной воды.
Рис.2. Принцип обратного осмоса рисунок из книги У. Слейбо, Т. Перонс. Общая химия. Москва, Наука. 1979).
Развитие принципа обычного диализа привело к разработке метода электродиализа, который также используется для получения пресной воды. Морская вода накачивается между двумя полупроницаемыми мембранами, которые отделяют её от электродов (рис.3).
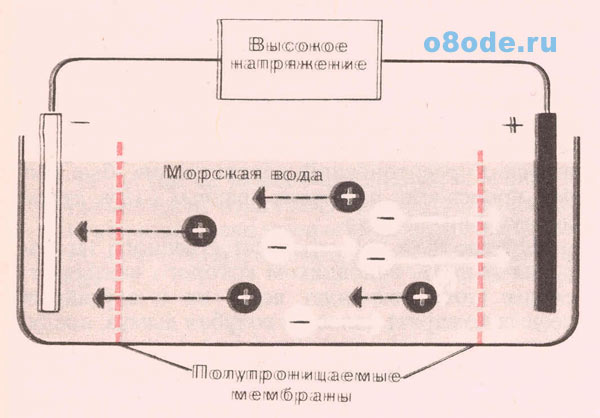
Рис. 3. Схема установки по электродиализу морской воды (рисунок из книги У. Слейбо, Т. Перонс. Общая химия. Москва, Наука. 1979).
При пропускании тока через электроды, катионы перемещаются по направлению к катоду, а анионы – по направлению к аноду. Концентрация ионов вблизи электродов, за пределами полупроницаемых мембран, снижается за счёт прокачивания морской воды, а вода в пространстве между мембранами постепенно опресняется. Для работы установки по опреснению морской воды методом электродиализа, изображённой на рис.3, используется напряжение 500 В и слабые токи порядка миллиампера.
Литература:
У. Слейбо, Т. Перонс. /ред. Е.Л. Розенберга. Общая химия. Москва, Наука. 1979.